维持性腹膜透析患者血清脂联素改变及与心脑血管事件的相关研究*
袁 乙,俞 燕,袁 莉,陈 旭
(1 南通大学附属医院肾内科,南通 226001;2 江苏省盐城市第一人民医院肾内科)
维持性腹膜透析(maintenance peritoneal dialysis,MPD)作为现阶段最常见的家庭透析方式,服务着全球约25 万终末期肾功能衰竭患者,已经成为除血液透析外另一种重要的肾脏替代治疗方式[1],具有保护残余肾功能、居家操作便捷等优势。但MPD 患者除可能发生腹腔感染这一严峻问题外,其远期生存率仍不满意,中位生存期不到5 年[2],各种心脑血管疾病发生率仍居高不下。
脂联素(adiponectin,ADPN)为脂肪细胞分泌的一种具有胰岛素增敏作用的内源性活性多肽[3],对机体具有多种有益作用,包括抗动脉粥样硬化、抗糖尿病和抗炎活性等。在慢性肾脏病非透析患者及维持性血液透析患者中,ADPN 与心脑血管事件具有一定的相关性[4-5]。A.MARKAKI 等[6]发现,血液透析患者中高ADPN 水平与死亡率的降低有关,高ADPN可以改善血液透析患者的预后。但有关MPD 患者血清ADPN 的改变及其与心脑血管事件的相关研究国内外鲜有报道。本研究对MPD 患者血清ADPN 水平改变及相关因素进行分析,研究ADPN 对MPD 患者心脑血管疾病发生的影响,探讨血清ADPN 能否成为MPD 患者心源性、脑源性疾病风险的生物学相关指标,为其临床应用提供理论依据。
1 对象与方法
1.1 研究对象 选择2018 年3 月—2020 年3 月在南通大学附属医院肾内科进行MPD、治疗时间>3 个月的128 例患者作为MPD 组,其中男74 例,女54例,年龄33~80 岁,平均(59.70±14.63)岁,MPD 时间为6~104 个月,平均(65.91±41.31)个月;所有患者未进行调整血脂药物治疗或口服噻唑烷二酮类的调整血糖药物,1 个月内无各系统感染史以及手术史、外伤史,未发生心脑血管事件,最近3 个月内未输血治疗;均采用连续性不卧床腹膜透析,4 次/d、2 000 mL/次透析方式,根据是否需要超滤及超滤量选择含葡萄糖1.5%或2.5%的低钙乳酸盐腹膜透析液,pH 5.2(4.5~6.5),渗透压345 mOsm/L 或395 mOsm/L。另随机抽取30 例在南通大学附属医院行常规体检者作为对照组,其中男17 例,女13 例,年龄29~83 岁,平均(55.80±11.88)岁;既往无心脑血管疾病及肝肾疾病史,且体检未发现高血压、高脂血症、高尿酸血症、糖尿病等,同时近1 个月内无各系统感染史。两组人群性别、年龄、BMI 等指标比较,差异均无统计学意义(均P>0.05)。
1.2 研究方法 通过体检报告了解对照组基本情况、既往病史和完整体检结果,电话或面询既往有无心脑血管疾病、肝肾疾病及近1 月感染病史。通过医院信息系统(Hospital Informatiao System,HIS)记录MPD 组患者现病史、既往史、个人史及输血史,了解口服及静脉用药,同时对患者的基础病因及MPD 方式、透析龄等整理记录。收取各组人员早晨空腹外周肘静脉的血标本,4 ℃冰箱中静置30 min 后离心,分离血清,部分存入-80 ℃冰箱保存。由检验科生化室检测血常规、肝功能、肾功能、电解质、血糖、血脂、CRP,数据收集使用HIS 系统。采用ELISA 法进行血清ADPN 检测,严格按照说明书操作,试剂盒购自上海酶联生物科技有限公司。
1.3 随访监测 MPD 组患者从抽取血标本当天开始随访,主要通过门诊就诊记录、住院记录及定期电话联系等方式,采集患者本人或其家属了解患者1 年时间以内发生的心脑血管事件(包括急性冠脉综合征[7]、心力衰竭[8]、心源性猝死[9]、脑出血[10]、脑梗死[11]),经南通大学附属医院肾内科、心血管内科、神经内科医师会诊明确诊断。
1.4 统计学方法 应用SPSS 22.0 统计软件进行数据分析。计量数据均以表示,两组间采用t 检验进行比较,各组以单因素方差分析(one-way ANOVA)进行比较;计数数据比较采用χ2检验,两因素间的关系采用Pearson 相关分析,使用单因素Logistic 回归分析心源性、脑源性疾病的相关风险因素。P<0.05为差异有统计学意义。
2 结果
2.1 MPD组与对照组临床资料比较 两组高密度脂蛋白(high-density lipoprotein,HDL)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、BMI、血钙、血钾等比较差异均无统计学意义(均P>0.05);MPD 组血肌酐、尿素、尿酸、CRP、血磷、APDN 均显著高于对照组,血红蛋白(hemoglobin,Hb)低于对照组(均P<0.01),见表1。
表1 MPD 组与对照组临床检查指标比较()
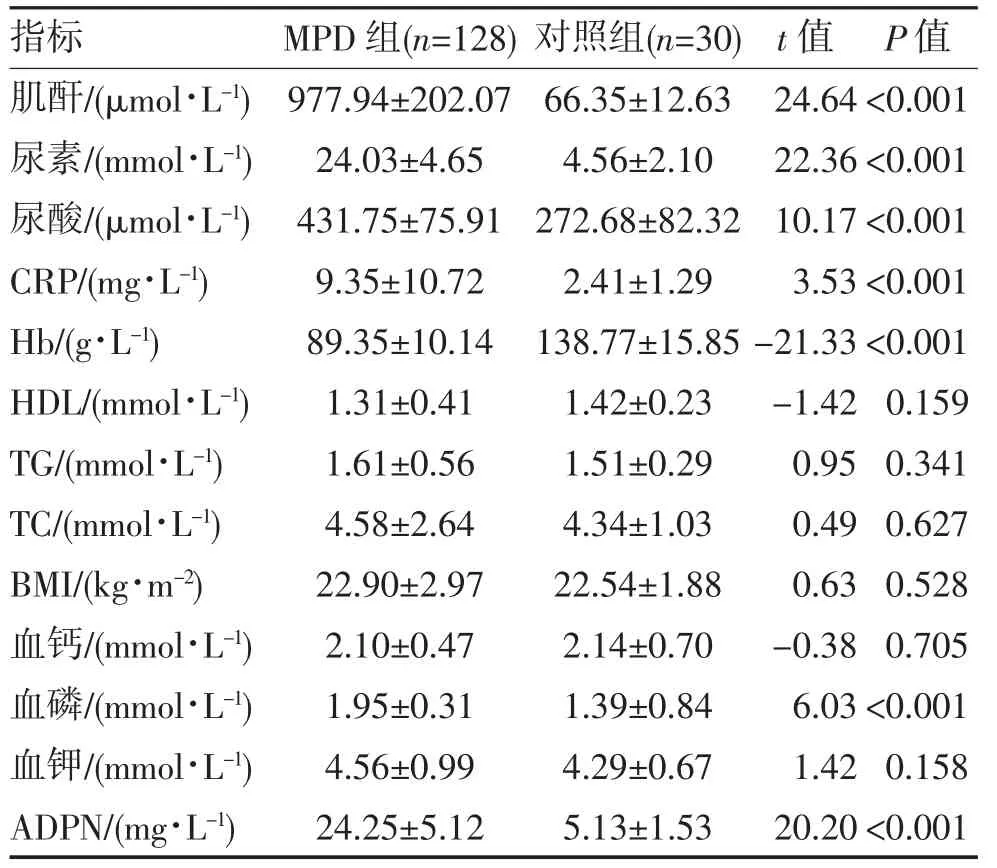
表1 MPD 组与对照组临床检查指标比较()
2.2 MPD 患者不同原发病因之间血清ADPN 水平的比较 原发性肾小球疾病(A 组)、糖尿病肾病(B组)、痛风性肾病(C 组)、多囊肾(D 组)、其他(E 组)等不同病因所致终末期肾病MPD 患者各组间血清ADPN 水平的差异无统计学意义(P>0.05),见图1。
图1 不同病因组血ADPN 水平的比较
2.3 MPD 患者高ADPN 组与低ADPN 组一般临床指标比较 128 例MPD 患者血清ADPN 平均值为(24.25±5.12)mg/L,中位数为22.01 mg/L,以后者为截点分为高ADPN 组和低ADPN 组,各64 例。两亚组间患者性别构成、年龄、血肌酐、尿素、尿酸、Hb、TC、血钙、血磷、血钾比较差异无统计学意义(P>0.05);低ADPN 组BMI、CRP、TG、透析龄均高于高ADPN组,而HDL 低于高ADPN 组(P<0.05),见表2。
表2 MPD 患者高ADPN 与低ADPN 亚组间临床指标比较(n,)
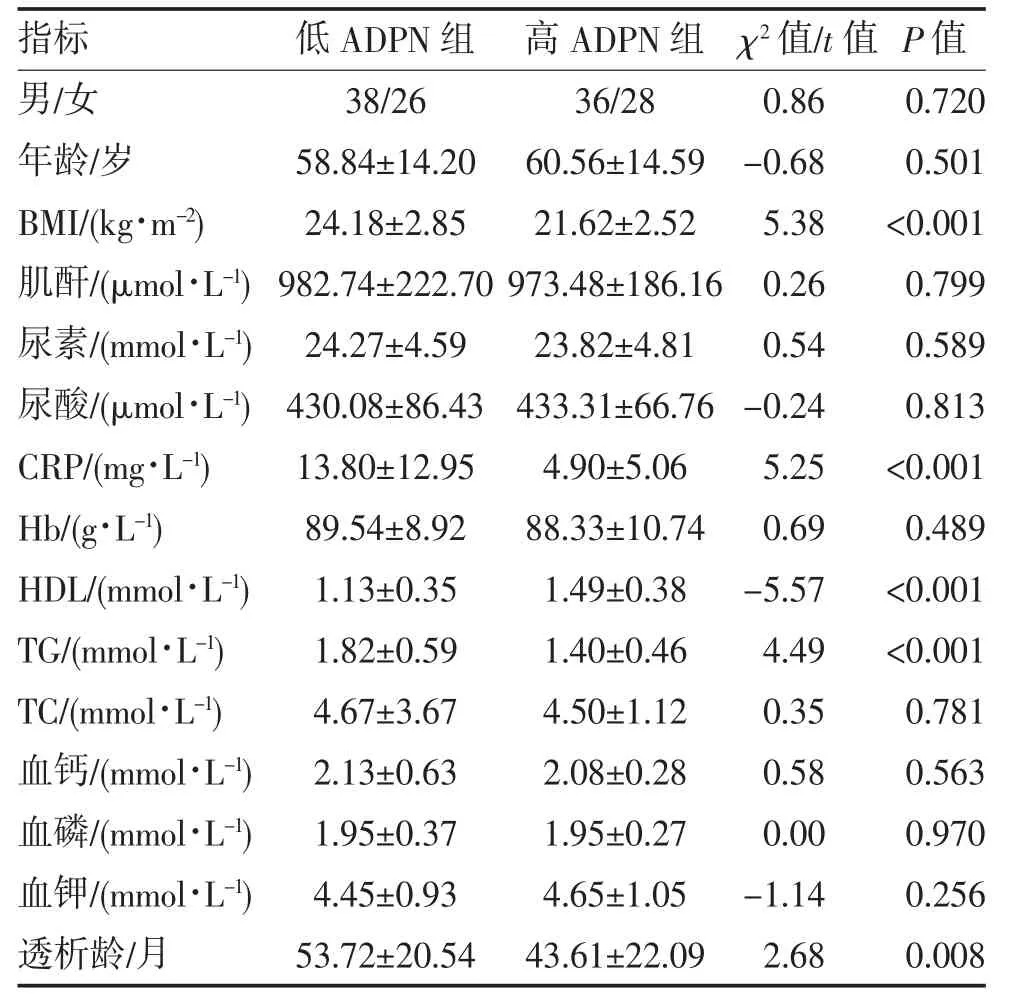
表2 MPD 患者高ADPN 与低ADPN 亚组间临床指标比较(n,)
2.4 MPD 患者血清ADPN 与新发心脑血管事件的关系 MPD 组患者平均随访时间为(12.02±1.55)个月,无失访者。随访期间根据心血管事件发生率由高到低排列依次为:急性冠脉综合征12 例次(9.38%),心力衰竭7 例次(5.47%),脑血管事件4 例次(3.13%),心源性猝死2 例次(1.56%),共25 例次(19.53%);其中低ADPN 组17 例次(26.56%),高ADPN 组8 例次(12.50%),低ADPN 组并发心源性、脑源性疾病的发病率较高ADPN 组显著升高(χ2=4.026,P=0.045)。单因素Logistic 回归分析表明高ADPN 为MPD 患者并发心源性、脑源性疾病的保护因素,其并发心脑血管事件可能性显著小于低ADPN 患者(OR=0.395,95%CI:0.175~0.996,P=0.041)。
2.5 MPD 患者血ADPN 水平变化的相关因素分析MPD 患者血ADPN 与年龄、TC、Hb、血钾、血钙、血磷无相关性(r=0.033、-0.079、-0.077、0.111、-0.072、0.009,均P>0.05);而与BMI、TG、CRP、透析龄均呈负相关(r=-0.554、-0.517、-0.321、-0.437,均P<0.01);与HDL 呈正相关(r=0.473,P<0.01)。
3 讨论
ADPN 是由脂肪细胞产生的细胞因子,以自分泌、旁分泌以及内分泌的信号传导机制发挥作用。2003 年发现了ADPN 的两种受体,即AdipoR1 和AdipoR2;2004 年又在内皮细胞和平滑肌细胞上发现了第3 种类型的受体T-钙黏蛋白(AdipoR3)。ADPN 的多种生物学效应依赖于其组织内蓄积,而后者依赖于T-钙黏蛋白[12]。已有实验和临床研究[3]表明,ADPN 生物活性的降低与心脑血管疾病的病理生理学息息相关,特别是ADPN 抗炎、抗动脉粥样硬化和胰岛素增敏作用的减弱会增加成年患者发生肥胖、胰岛素抵抗和高血压等心脑血管事件的风险。另有研究[13]显示,在心力衰竭、肾损伤、肝病、肺部损伤和肿瘤演变中都有ADPN 的参与。
透析患者各种心脑血管疾病发生率仍居高不下,而造成MPD 患者心脑血管事件高发的原因是多方面的,包括传统危险因素如高血压、糖尿病、血脂异常、吸烟、肥胖等;另外一些非传统的与MPD 相关的因素如高同型半胱氨酸血症、贫血、钙磷代谢紊乱、炎症、营养不良、氧化应激等;此外腹膜透析液系生物不相容性液体,持续接触中会产生不良的炎症和代谢后果[14]。
既往研究[15]发现终末期肾病MPD 患者的血清ADPN 可达健康人群的数倍。肾脏是参与ADPN 生物降解的重要器官,终末期肾病患者血ADPN 质量浓度升高部分与肾脏生物降解和消除功能的丧失有关[16]。生物不相容的透析液、机体酸中毒环境等影响脂肪细胞ADPN 基因的转录、高浓度含葡萄糖腹膜透析液诱导的氧化应激也会干扰ADPN 水平,此时ADPN 及其受体系统上调可能是机体对尿毒症微环境的适应性调节。亦有研究[17]发现ADPN 具有促血管内皮细胞增殖和迁移效应,腹膜透析患者腹膜内新生血管的产生机制与高循环浓度的ADPN 密切相关,血清ADPN 水平是影响腹膜透析龄的重要因素。
ADPN 作为心脑血管的保护因子,目前已有研究[18]证明其为透析患者全因死亡率的重要预测指标,ADPN 质量浓度每增加1 μg/mL,透析患者全因死亡率可下降约4%,血ADPN 浓度较高的患者死亡率甚至降低了70%。C.ZOCCALI 等[19]发现低血浆ADPN 浓度是血液透析患者心血管疾病的新危险因素,但有关ADPN 与MPD 患者心血管疾病的关系鲜有报道。本研究对128 例MPD 患者随访发现低ADPN 组并发心源性、脑源性疾病的发病率较高ADPN 组显著升高,高ADPN 是MPD 患者心源性、脑源性相关疾病的保护因素。MPD 患者血清高ADPN 减少心脑血管事件发生的可能机制包括:(1)ADPN 通过调整脂质代谢进而影响心血管事件发生。目前已发现ADPN 与HDL 和TG 的代谢有关,ADPN 可诱导血清HDL 增加,并可促使富含TG 的脂蛋白分解。TG 降低和HDL 升高以及对葡萄糖代谢的影响可改善血管内皮功能[20],有效预防心脑血管事件发生。(2)ADPN 可以通过抗动脉粥样硬化作用降低心脑血管事件发生率。P.H.DESSEIN 等[21]研究表明低ADPN 是颈动脉粥样硬化的独立预测因子。一方面ADPN 可阻断人主动脉平滑肌细胞的增殖和迁移,进而减缓动脉内膜的增厚和动脉粥样硬化进一步加重;另一方面ADPN 可通过增加肝内载脂蛋白Apo-AI(高密度脂蛋白的主要载脂蛋白)的产生来提高HDL,并增加ATP 结合转运蛋白A1 产生,使胆固醇逆向运输诱导HDL 的生成[18],血清较高的HDL-C浓度可以改善血管内皮功能,在一定程度上减少心脑血管事件发生率。(3)ADPN 还可以通过抗炎、抗氧化作用减少MPD 患者心脑血管事件的发生。ADPN 可减少产生促炎细胞因子的巨噬细胞,同时增加抗炎细胞因子的生成[22],抑制炎症前氧化还原敏感的传导信号,包括NF-κB 和激活蛋白1,同时改善内皮细胞功能[23],增加一氧化氮产生实现抗血栓形成的特性。因此ADPN 作为血管稳态的关键调节剂可降低动脉粥样硬化并发症的发生和发展。
综上所述,MPD 患者血清ADPN 水平较正常人显著增高,且有较高的心脑血管事件发生率;高ADPN组并发心源性、脑源性疾病的发病率较低ADPN 组显著降低;高ADPN 是MPD 患者并发心源性、脑源性疾病的保护因素,对临床预测MPD 患者心脑血管事件具有一定意义,也为防治提供了潜在的途径。

