缺氧预适应BMSC-EVs 在大鼠肠道细胞H2O2 损伤模型中的初步研究*
吴 柯,赵 珺,咸 华***
(1 南通大学医学院,南通 226001;2 南通大学附属医院小儿外科)
肠缺血再灌注损伤(intestinal ischemia reperfusion injury,IIRI)是失血性休克、创伤、绞窄性肠梗阻、严重烧伤、急性肠系膜缺血等病理情况下最常见的临床症状之一[1],具有很高的发病率和病死率。IIRI 最重要的并发症是肠道黏膜屏障功能障碍,进而发生全身炎症反应综合征和多器官功能障碍综合征,最终导致死亡[2-4]。在小儿外科临床工作中,患儿嵌顿疝、肠套叠、坏死性小肠结肠炎、休克等疾病均会导致肠道血供障碍,最终引起IIRI。由于患儿肠壁薄、肠黏膜脆弱、肠道菌群容易失调、肠道免疫力低下,一旦发生IIRI,预后差,致死率较成人高,严重影响患儿的生活质量。
目前,国内外学者[5-6]提出很多防治IIRI 的技术方法,如抗能量缺乏疗法、抗氧自由基疗法、抗白细胞黏附疗法、抗上皮细胞凋亡疗法、缺血预处理等,但在临床上取得的效果却不理想。究其原因,可能是治疗措施只阻断了IIRI 过程的某一种损伤途径,而不能全面逆转损伤。近年来,有学者[7]发现,向发生缺血再灌注损伤的心脏和脑组织注射人干细胞后能改善损伤组织的功能,并促进损伤组织进行重塑。干细胞疗法是通过促进缺血后损伤组织的修复与再生来达到治疗目的。干细胞因具有自我更新能力、高度增殖能力和多向分化潜能,使其成为治疗缺血再灌注损伤的新方向。但后期研究[8]发现,干细胞存在分化效率较低、在受损组织处移植数量有限、易被宿主排斥、归巢能力不稳定等缺点,限制了干细胞的进一步应用。有研究[9]发现干细胞通过旁分泌的方式向微环境中释放许多可溶性活性因子及胞外囊泡(extracellular vesicles,EVs)。EVs 富含生物活性因子,参与细胞间的信息传递,调控多种生物学功能。EVs 不仅可以发挥其母细胞的特性,还具备更好的生物相容性、免疫惰性以及穿透能力等,使其能快速将药物分子运送到受体细胞中,而不会引起毒性和不良免疫反应[10-11]。随着EVs 与靶细胞之间相互作用机制研究的开展,为多种疾病防治提供了新思路,这也为IIRI的治疗提供了新的方向。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有取材方便、易分离培养、强大的分化特性等优势,被广泛用于缺血再灌注损伤的研究。研究[12]发现BMSCs 可以增加抗炎因子前列腺素E 受体3 和IL-1 受体拮抗剂表达,降低促炎因子如IL-1β、TGFβ-1、TNF-α、IL-6、巨噬细胞炎症蛋白-2等表达;也有研究[13-14]表明BMSCs 可以通过减少紧密连接破坏、绒毛损伤和紧密连接蛋白1 下调,从而维持肠黏膜屏障,减轻IIRI 等。BMSCs 对IIRI 具有修复作用,但是对于BMSCs 来源的EVs 在IIRI 中的研究并不多见。有研究[15]发现BMSCs 进行缺氧预适应可以提高其EVs 的分泌量和功能。因此,缺氧预适应BMSCs 来源的EVs(BMSC-EVs)在IIRI 中的作用值得进一步研究。
1 材料与方法
1.1 细胞与试剂 大鼠BMSCs 和大鼠小肠隐窝上皮细胞(IEC-6)均购置于上海中乔新舟生物科技有限公司;DMEM/F12 培养基、DMEM 高糖培养基和FBS 购自Gibco 公司;Trizol、exoRNeasy Serum/Plasma Maxi 试剂盒、QuantiNovaTMReverse Transcription 试剂盒、QIAGEN miScriptII RT 试剂盒、exoEasy Maxi试剂盒均购自Qiagen 公司;SYBR Green 实时定量试剂盒购自罗氏公司;CD63 和CD9 抗体购自Abcam公司;TSG101 和β-actin 抗体购自Proteintech 公司;H2O2溶液购自艾美捷科技有限公司;CCK-8 试剂盒购自Dojindo 公司;EdU 增殖试剂盒购自广州锐博生物技术有限公司;Ibidi 购自德国易必迪ibidi 公司;实时定量PCR(real-time quantitative PCR,RT-qPCR)引物由苏州金唯智生物科技有限公司合成。
1.2 方法
1.2.1 细胞培养 BMSCs 生长于含10%FBS 的DMEM/F12 培养基中,37 ℃、5%CO2加湿培养箱中常规培养。待细胞密度达到80%~90%时,更换为不含FBS 的DMEM/F12 培养基,并移至缺氧箱培养,缺氧箱设置为1%O2,94%N2,5%CO2,48 h 后收集上清液。IEC-6 生长于含10%FBS 的DMEM 培养基中,37 ℃、5%CO2加湿培养箱中常规培养。
1.2.2 缺氧预处理BMSC-EVs 的提取与鉴定 按照操作流程,使用exoEasy Maxi 试剂盒提取缺氧预处理BMSC 上清液中的EVs。使用纳米颗粒跟踪分析仪检测所提囊泡的粒径与浓度,Western Blot 法检测囊泡标志蛋白的表达。
1.2.3 缺氧预处理BMSC-EVs 对H2O2损伤模型中IEC-6 活力的影响 将IEC-6 以2×104个/孔接种于96 孔板,100 μL/孔,12 h 贴壁后,分为Normal 组、H2O2组和H2O2+EVs 组,每组6 个复孔。H2O2组和H2O2+EVs 组用含200 μmol/L H2O2的DMEM 处理。4 h 后,H2O2组改用IEC-6 完全培养基培养;H2O2+EVs 组更换含不同浓度的的缺氧预适应BMSCs-EVs 的IEC-6 完全培养基培养,浓度分别为1×108、5×108、1×109particles/mL;Normal 组正常换液处理。培养24 h 后,加入1/10 培养基总体积的CCK-8 溶液,37 ℃培养箱中孵育2 h 后,用酶标仪测定450 nm 处的吸光度值。
1.2.4 缺氧预处理BMSC-EVs 对H2O2损伤模型中IEC-6 增殖的影响 将IEC-6 以1×104个/孔接种于96 孔板,100 μL/孔,12 h 贴壁后分为Normal 组、H2O2组和H2O2+EVs 组,每组3 个复孔。H2O2组和H2O2+EVs 组用含200 μmol/L H2O2的DMEM 处理。4 h 后,H2O2组改用IEC-6 完全培养基培养;H2O2+EVs 组更换含1×109particles/mL 缺氧预适应BMSCs-EVs 的IEC-6 完全培养基培养;Normal 组正常换液处理。24 h 后按照EdU 试剂盒的操作流程对3组细胞进行固定、染色、拍照。
1.2.5 缺氧预处理BMSCs 囊泡对H2O2损伤模型中IEC-6 迁移能力的影响 在小皿中插入ibidi,进行伤口愈合试验。将IEC-6 以1×104个/孔接种于ibidi,100 μL/孔,12 h 贴壁后,分为Normal 组、H2O2组和H2O2+EVs 组。H2O2组和H2O2+EVs 组用含200 μmol/L H2O2的DMEM 处理。4 h 后,H2O2组改用IEC-6 完全培养基培养;H2O2+EVs 组更换含1×109particles/mL缺氧预适应BMSC-EVs 的IEC-6 完全培养基培养;Normal 组正常换液处理。不同组别在更换培养基后,用无菌镊轻轻拔起ibidi,显微镜下拍照记作0 h 的图像,24 h 后再次拍照记作24 h 的图像。
1.2.6 引物设计 采用RT-qPCR 检测H2O2损伤模型中IEC-6 炎症因子和凋亡因子的表达,设计大鼠炎症因子、凋亡因子的引物及内参GAPDH(表1)。采用QIAGEN miRNeasy Serum/Plasma 试剂盒提取3组细胞总RNA,并采用QuantiNovaTMReverse Transcription 试剂盒和QIAGEN miScriptII RT 试剂盒进行逆转录反应,并根据SYBR Green 实时定量试剂盒说明书进行RT-qPCR 扩增。进行目的基因相对表达量的计算时使用2-△△Ct值法。

表1 引物序列
1.2.7 统计学方法 应用GraphPad Prism 8.0 软件对所有实验数据进行统计分析,定量分析数据以均数±标准误(means±SEM)表示,多组之间采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 缺氧预适应BMSC-EVs 的鉴定 经透射电子显微镜测定,分离的缺氧预适应BMSC-EVs 呈半透明球形颗粒(图1A)。通过纳米颗粒跟踪分析技术(nanoparticle tracking analysis,NTA)粒径分析,观察到囊泡粒径多分布在50~200 nm,平均粒径为115 nm(图1B)。通过Western Blot 分析检测囊泡相关蛋白的表达,发现所提取的囊泡阳性表达CD9、CD63 和TSG101(图1C)。

图1 缺氧预适应BMSC-EVs 的鉴定结果
2.2 缺氧预适应BMSC-EVs 促进H2O2损伤模型IEC-6 的增殖 EdU 增殖实验结果显示,H2O2+EVs组EdU 阳性细胞数量明显高于H2O2组,但低于Normal 组(图2A~B)。CCK-8 法结果显示,H2O2损伤后加入EVs 治疗的IEC-6 细胞活力较Normal 组显著增加,且呈剂量依赖性关系(图2C)。以上结果提示缺氧预适应的BMSC-EVs 可以促进IEC-6 细胞损伤后的增殖能力与活力。

图2 缺氧预适应BMSC-EVs 促进IEC-6 损伤后增殖能力和活力
2.3 缺氧预适应BMSC-EVs 促进H2O2损伤模型IEC-6 的迁移 体外划痕实验结果显示,迁移24 h后,H2O2+EVs 组迁移的面积要高于H2O2组,低于Normal 组(图3A~B),说明缺氧预适应BMSC-EVs 可以促进H2O2损伤模型IEC-6 细胞的迁移。
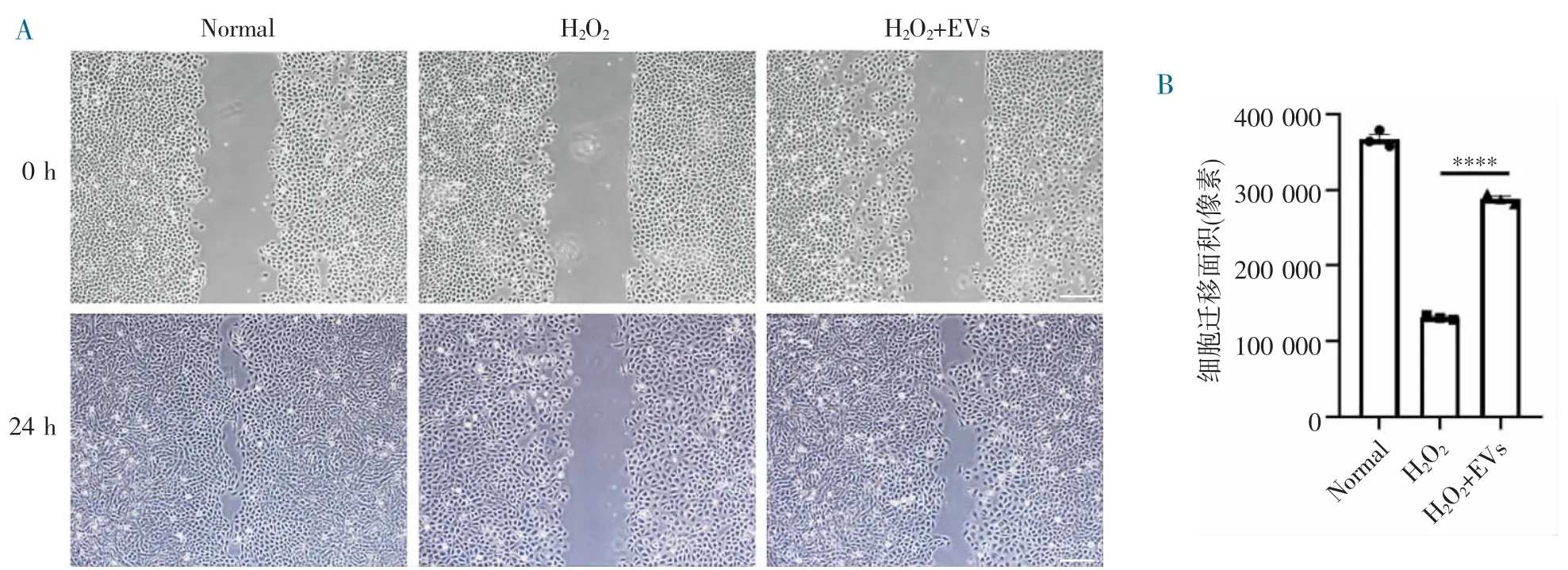
图3 缺氧预适应BMSC-EVs 促进IEC-6 损伤后迁移
2.4 缺氧预适应BMSC-EVs 减轻H2O2损伤模型IEC-6 炎症因子和凋亡因子的表达 RT-qPCR 结果显示,H2O2+EVs 组中炎症因子IL-6、TNF-α 和凋亡因子Caspase-3 mRNA 水平较H2O2组显著下降(P<0.0.5),但不能降至Normal 组水平(图4),说明缺氧预适应的BMSC-EVs 可以在RNA 水平层面上减轻H2O2损伤模型IEC-6 炎症因子和凋亡因子的表达。
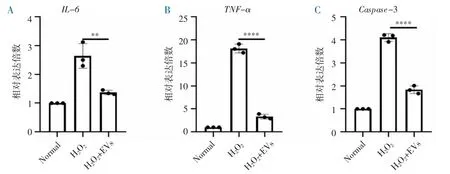
图4 缺氧预适应BMSC-EVs 减少H2O2 损伤后IEC-6 炎症因子和凋亡因子的表达(**P<0.01,****P<0.000 1)
3 讨论
肠内稳态的维持依赖肠上皮细胞的各种功能,包括营养吸收、上皮细胞活力、上皮细胞结构和功能的完整性等[16]。而IIRI 是一种复杂的病理生理过程,可能与细胞凋亡、钙超载、氧自由基损伤、能量衰竭、炎症因子爆发等密切相关。其中氧化应激与炎症反应被认为发挥着重要作用。而近些年来干细胞疗法以及无细胞疗法的出现,极大地推动了现代医学治疗手段的发展。
EVs 同样具备巨大的治疗潜力,是因为细胞来源的EVs 不但具备其母细胞的功效,比如抗凋亡作用、抗炎症反应、免疫抑制等,还拥有其母细胞不具备的生物相容性、免疫惰性等。更有研究[17]表明EVs可以跨越生物屏障,例如血脑屏障等。这表明EVs可能具备材料运输特性和长期循环能力,有望成为新兴的药物递送载体。截至目前,EVs 在多种疾病(如肿瘤、炎症性疾病、神经系统疾病及缺血性疾病等)进程中发挥着积极的生理病理作用。已证实干细胞或干细胞分泌的EVs 能抑制炎症反应或挽救缺血缺氧等,如人脐带间充质干细胞来源的EVs 通过抑制氧化应激和中性粒细胞炎症反应减轻大鼠肝脏缺血再灌注损伤[18],BMSC-EVs 通过激活PTEN 介导的AKT 信号通路预防大鼠脑缺血再灌注损伤[19]。
本研究运用新一代具有膜亲和结合柱的exoEasy Maxi 试剂盒来提取EVs,并通过NTA 测试和Western Blot 等方法鉴定了EVs。试剂盒提取EVs 较超速离心法和差速离心法等传统方法操作便捷,获取的EVs 浓度高,更加节省时间和精力。EVs 具备其母细胞的功能特性,是因为EVs 的内容物反映了其母细胞的分子组成。反过来,母细胞微环境和生理状态的改变也会增强或减弱其EVs 的生物学功能[13]。研究[20]显示,缺氧预处理可以提高脂肪间充质干细胞(adipose-derived mesenchymal stromal cells,ADMSCs)的治疗能力。缺氧状态可以诱导ADMSCs 凋亡减少,增殖增加,提高归巢到损伤组织的能力[21-22]。此外,缺氧状态还改变了ADMSCs 的旁分泌能力,增加了损伤组织再生所需的与免疫调节和增殖相关因子的释放[23],增加ADMSCs-EVs 的分泌量和增强其抗炎特性[24]。
最近的研究[25]指出,EVs 中的miRNA 是母细胞和靶细胞之间进行通信的主要介质,EVs 通过其包含的miRNA 发挥生理作用,如BMSC-EVs 通过向心肌细胞输送miR-144 来抑制缺氧条件下的细胞凋亡[26];BMSC-EVs 通过靶向输送miR-29b-3p 促进血管生成和抑制神经元凋亡从而改善缺血性脑损伤[19];BMSC-EVs 通过miR-185 来抑制口腔白斑的进展[27]等。为此计划下一步对BMSC-EVs 和缺氧预适应的BMSC-EVs 进行高通量测序,分析二者miRNA表达量是否发生变化,为后续EVs 的改造提供基础。目前也有研究[28]报道EVs 在不同的浓度发挥的作用不同,这对后续实验提供了借鉴方向。
体外研究IIRI 的模型有氧糖剥夺-再灌注模型和H2O2损伤模型。本研究运用的是大鼠肠道细胞的H2O2损伤模型,此模型较氧糖剥夺-再灌注模型操作更加便捷,且可同批次大样本量进行实验,但值得注意的是要将H2O2避光避热分装储存,避免使用时浓度发生变化。缺氧预适应BMSC-EVs 可以促进受损大鼠肠道细胞IEC-6 的增殖、迁移,减少H2O2对IEC-6 造成的凋亡和炎症反应。细胞活力、增殖能力得到增强,有助于细胞损伤后的再生;迁移能力得到增强,有助于屏障结构的更快恢复;炎症反应的减弱有助于改善细胞微环境,为细胞损伤修复和组织重建提供良好的基础,将进一步探索缺氧预适应的BMSC-EVs 的作用机制。

