股骨头坏死ARCO 2期CT征象对新发骨质吸收区预测价值分析⋆
史 珊 杨学东,* 罗 萍 孙 黎 谢利民 于 潼 白 杨
1.中国中医科学院广安门医院放射科(北京 100053)
2.中国中医科学院广安门医院骨科(北京 100053)
股骨头坏死(Osteonecrosis of the femoral head,ONFH)是由于股骨头的血供受损或中断,导致骨细胞及骨髓成分死亡的疾病[1]。股骨头塌陷是疾病进展的重要转折点,通常提示预后不良[2-3]。ONFH骨质吸收区在股骨头塌陷进程中起着重要作用[4]。它最早出现在国际骨微循环研究协会(Association Research Circulation Osseous,ARCO)2期,是由破骨细胞过度活动所致[5]。既往研究提示骨质吸收区可能与负重区压力过大有关[6]。但既往文献中,对于股骨头坏死在何种情况下易出现骨质吸收区,并无具体的说明。在临床上,我们发现一些ONFH患者在随访过程中出现新的骨质吸收区,而一些保持稳定不出现骨质吸收区。本研究的目的在于分析并确定对新发骨质吸收区有预测价值的CT征象。
1 材料和方法
1.1 一般资料回顾性分析2011年1月至2017年10月进行髋关节CT检查的186例ARCO 2期ONFH患者,诊断标准为中国成人股骨头坏死诊治专家共识(2016)[7],分期标准为ARCO2019[8]。排除标准:初次CT检查已出现骨质吸收区;随访时间小于3年;无新发骨质吸收区;髋关节外伤史;髋关节有创检查或手术史。186例中92例被排除:67例在初次CT检查时有骨质吸收,25例随访时间短于3年且无新发骨质吸收区,最终入组94例(F/M=24/70,中位年龄41.0(33.3-54.0)岁),其中新发骨质吸收组48例,无骨质吸收组46例。(病例筛选流程图见图1)。
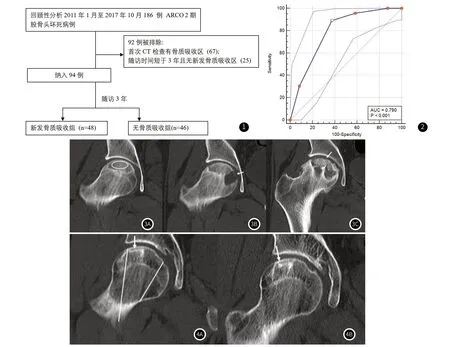
图1 病例筛选流程图。图2 CT征象组合2对预测新发骨质吸收区的ROC曲线下面积。图3 新发骨质吸收组病例随访。41岁男性,初次CT检查为股骨头坏死ARCO2期(图3A,2017-2-20,右髋关节),无骨质吸收区,骨质坏死区位置评分2,范围评分为2,增生反应区为横行,故CT征象总和评分为2分,推测会出现新的骨质吸收区;骨质坏死区密度的测量方法使用椭圆形感兴趣区表示。随访期间(图3B,2017-9-19)出现新的骨质吸收区(箭头),与推测一致。末次随访3年余时(图3C,2020-10-5),股骨头塌陷明显(箭头)。图4 无骨质吸收组病例随访。50岁男性,初次CT检查为股骨头坏死ARCO 2期(图4A,2016-6-16,右髋关节),无骨质吸收区,骨质坏死区位置评分为2,范围评分 为1,增生反应区呈闭环(箭头),故CT征象总和评分为0分,推测不会出现新的骨质吸收区;两条斜线显示了冠状CT上股骨头的分区。末次随访CT(图4B,2019-7-23)无新发骨质吸收区,无股骨头塌陷(箭头),与推测一致。
1.2 CT扫描所有病例均在西门子 SOMATOM Definition Flash 和 Emotion 16 CT 扫描仪上进行扫描。SOMATOM Definition Flash扫描参数为:管电压:140 kVp,自动调节管电流(90-130mA),扫描层厚:0.75mm,DFOV:35.6×35.6cm。Emotion 16 CT管电压:130 kVp;自动调节管电流(70-120mA);扫描层厚:0.75mm,DFOV:38.0×38.0cm。所有髋关节均使用骨算法重建(B60s、锐利、3mm)冠状位图像。扫描时患者仰卧位,双足处于中立位,双髋关节同时扫描,扫描范围从髋臼顶部至股骨小转子。
1.3 CT图像评估
1.3.1 在CT冠状位骨窗图像上评估骨质坏死的位置,根据股骨头的应力传导途径、骨小梁结构特征和骨密度分布用两条线将股骨头分为外侧柱、中间柱和内侧柱。观察冠状位所有层面的图像进行评估,若骨质坏死位于中间柱,评分为1分;若骨质坏死位于中间柱和外侧柱,评分为2分;若骨质坏死位于外侧柱、中间柱和内侧柱,评分为3分。
1.3.2 在CT冠状位骨窗图像上评估骨质坏死的范围,按照ARCO1994分期方法[9],观察冠状位所有层面的图像进行评估,如果骨质坏死范围小于15%,记为1分;若骨质坏死范围为15-30%,则记为2分;若骨质坏死范围大于30%,记为3分。
1.3.3 骨质坏死区的密度 在CT冠状位骨窗图像上,取骨质坏死区的最大层面画一个尽可能大的圆形或椭圆形感兴趣区进行测量,以 Hounsfield (HU)为单位。
1.3.4 增生反应区的形态(横行、闭环或其他) 在CT冠状位骨窗图像上进行评估。横行和闭环的标准参考 Wu 等[10]的研究。
所有CT征象均由一名经验丰富的放射科医师(9年工作经验,骨肌系统方向)按照上述方法盲法评估。所有图像在 20 天后由同一位放射科医师和另一位放射科医师(18 年工作经验,无具体专业方向)进行盲法重复测量,以此计算评估者内和评估者间的一致性。
为了进一步提高CT征象的预测价值,我们根据单个CT征象的曲线下面积(Area Under Curve,AUC),设置了两种CT征象组合:CT征象组合1-骨质坏死的位置和范围;CT 征象组合 2-骨质坏死的位置、范围,以及增生反应区的形态。根据单个CT征象预测结果中的阈值,制定CT征象组合的评分规则:骨质坏死范围评分大于2,+1;骨质坏死位置评分大于1,+1;如果增生反应区为横行,+1;如果增生反应区呈闭环,-1;其他分数记为0,最后计算总分。
1.4 分组标准根据随访3年内有无新发骨质吸收区将病例分为新发骨质吸收组和无骨质吸收组。骨质吸收区在CT骨窗上表现为类软组织密度的低密度区、边界清晰、无骨小梁分布。应与骨质坏死中的骨折相鉴别,后者表现为低密度的条带状裂隙。
1.5 统计分析计量资料用中位数(四分位距)表示。计数资料用计数(百分比)表示。新发骨质吸收组与无骨吸收组性别比较采用卡方检验;两组间年龄及CT征象比较采用Mann-Whitney检验(SPSS 22.0)。用ROC曲线(Medcalc软件,18.2.1版)分析单一和CT征象组合对新发骨质吸收区的预测价值。用组内相关系数(intraclass correlation efficient,ICC)、Kappa 和加权 Kappa 分析2 位放射科医师评估者内及评估者间数据的一致性。P<0.05 具有统计学意义。
2 结果
2.1 一般资料新发骨质吸收组年龄显著大于无骨质吸收组,两组间性别比例无显著性差异(P=1.000),见表1。

表1 新发骨质吸收组及无骨质吸收组的一般资料和初次 CT 征象特征
2.2 两组间CT征象比较见表1,除骨质坏死密度(P=0.513)外,其他两组间CT征象均有显著性差异。
2.3 骨质坏死的位置、范围 以及增生反应区的形态对新发骨质吸收均具有预测价值其中骨质坏死范围预测价值最好,具体结果见表2。两种CT征象组合的预测结果见表2和图2。

表2 单个及CT征象组合的诊断效能
2.4 两种CT征象组合与骨质坏死范围预测新发骨质吸收区的AUC两两比较结果无显著性差异。(骨质坏死范围vs CT征象组合1,P=0.339;骨质坏死范围vs CT征象组合2,P=0.153;CT征象组合1 vs CT征象组合2,P=0.076),但CT征象组合2预测新发骨质吸收区的AUC数值最大,其AUC为0.790,敏感性和特异性分别为89.13%和62.50%,阈值为大于1。
2.5 CT 征象的评估者内和评估者间的一致性见表3。

表3 评估者内及评估者间CT征象评估的一致性
3 讨论
本研究显示CT征象组合2(骨质坏死位置、范围以及增生反应区形态)对预测新发骨质吸收区具有较大价值,阈值 >1。这是首次对预测新发骨质吸收区的CT征象进行具体分析。
研究结果发现较大的骨质坏死区更容易出现骨质吸收,这可能是由于正常骨小梁和髋部应力传递路径的破坏,从而降低了骨质坏死区的承重能力[11]。既往研究发现骨坏死区底部应力大于表面应力[12],因此应力主要集中在坏死病灶与正常骨的交界处(增生反应区),导致应力集中点异常;当峰值应力超过临界值时,会导致深部松质骨的微骨折,骨折后局部炎症刺激会引起破骨细胞过度活动,形成骨质吸收病变区[13]。本研究结果显示新发骨质吸收区多位于增生反应区附近的坏死区,这与Fang等[13]的研究一致。
本研究中累及外侧柱的骨质坏死区更易发生骨质吸收区。这可能是由于股骨头的应力主要集中在外侧柱[14],因此该区域的坏死区也承受着很大的压力。压力过大可引起骨小梁微骨折,刺激局部炎症,再加上严重的缺血缺氧刺激破骨细胞过度活动,从而促进骨质吸收区的形成[15]。这为股骨头坏死治疗中的保护性负重提供了理论支持[16]。
增生反应区位于坏死骨和正常骨的交界处,它是股骨头坏死的薄弱区域。闭环形态中增生反应区被正常的松质骨包围,可以辅助补偿部分应力传递,进而有效地分散应力,因此不易发生骨质吸收区。而在增生反应区呈横行时,其界面会产生应力遮挡效应,导致应力集中在薄弱区,容易导致微骨折[17],促进骨质吸收的形成。
在股骨头坏死修复过程中,破骨细胞和成骨细胞的活性同时增加,导致骨质净吸收[18]。如果病情进展,坏死区营养不足和缺氧,则抑制成骨细胞的增殖,降低碱性磷酸酶活性,刺激破骨细胞、成纤维细胞、脂肪细胞和软骨细胞的增殖[19],致使成骨细胞和破骨细胞动态失衡,成骨不良,修复过程失败[14],进而发生骨质吸收,最终导致股骨头塌陷。
成骨细胞和破骨细胞之间的动态平衡受多种因素影响,受多种分子通路调控,例如与骨保护素、RNAK和RANKL基因表达相关的信号通路[20]。它们的高水平表达可以使破骨细胞活跃并导致骨质吸收、破坏,最终导致股骨头塌陷。
骨质吸收在股骨头塌陷中起关键作用。骨质吸收的出现主要与应力过载有关。病理上,骨质吸收与破骨细胞过度活动有关,因此超负荷刺激与破骨细胞活性的相关性有待进一步研究。推测超负荷刺激引起的坏死病灶的微骨折会增加股骨头坏死区的局部炎症反应,进而通过分子生物学机制促进破骨细胞再生、数量过剩。
此外,本研究发现新发骨质吸收组患者年龄显著大于无骨吸收组,推测年龄与骨修复能力呈负相关。既往研究发现骨质再生受初始炎性微环境的影响,炎性反应随年龄增长而升高,可能会损害成骨[20]。此外,骨修复过程中的血管化程度随着年龄的增长而减少[21]。这些都为我们的推测提供了理论支持。
本研究存在一定的局限性:首先,本研究纳入的病例均在本院接受中药治疗,不能排除药物在随访过程中的疗效;其次,患者没有相关的临床病史和症状;再次,本研究选择随访时间点为3年。部分患者在随访结束后可能出现新发骨质吸收区。因此,在更长的随访期发生骨质吸收还有待进一步研究。
综述所述,若骨骨质坏死区位于中外侧柱或内中外侧柱,坏死范围大于30%,且增生反应区呈横行,则易发生骨质吸收,应密切随诊。

