MSCT和内科胸腔镜在胸腔积液性质诊断中的临床研究⋆
刘长力 闫晓云 张霄晴 曹亚伟 高 叶 杜娟琳
1.衡水市第三人民医院呼吸与危重症医学科一病区 (河北 衡水 053000)
2.衡水市第四人民医院肾内全科(河北 衡水 053000)
3.衡水市第三人民医院放射科(河北 衡水 053000)
胸腔积液常继发于恶性肿瘤、结核等疾病,明确胸腔积液性质是制定治疗方案的基础[1]。病理学诊断是鉴别胸腔积液性质的关键,内科胸腔镜可直视胸腔内部病灶,并行多点活检,通过病理学检测明确病变性质[2]。另外,胸腔积液标志物也对判断其性质有利,腺苷脱氨酶(adenosine deaminase,ADA)为参与嘌呤补救途径的多态性酶,结核杆菌刺激下细胞免疫增强,ADA活性升高,ADA在结核性胸膜炎早期即可大量升高[3]。癌胚抗原(carcinoembryonic antigen,CEA)为临床常见肿瘤标志物,大分子肿瘤标志物在病变早期无法进入血液系统,但能大量进入胸腔积液,辅助诊断积液性质[4]。多层螺旋计算机X线断层扫描(multi-slice spiral computed tomography,MSCT)具有无创、分辨率高等优点,在胸部疾病诊断中应用价值较高[5]。基于此,本研究分析MSCT与胸腔积液ADA、CEA检测对胸腔积液性质的诊断价值,为胸腔积液诊疗提供数据支持。
1 资料与方法
1.1 一般资料回顾性分析2019年6月至2021年12月我院收治的106例胸腔积液患者临床资料。纳入标准:存在咳嗽、胸闷、胸痛、气促等症状,影像学检查提示胸腔积液;胸腔积液初诊;单侧病变;年龄≥18岁;临床资料完整。排除标准:凝血功能障碍;肝、肾等脏器功能不全;合并糖尿病、血液病、自身免疫性疾病;本次诊疗前3个月内胸腔侵入性操作或胸部受损史;混合性胸腔积液(恶性与良性合并存在)。106例胸腔积液患者男性81例,女性25例;年龄22~76(53.49±11.27)岁;左侧胸腔积液42例,右侧胸腔积液64例。
1.2 方法⑴所有患者入院后行内科胸腔镜检查,检查前彩超定位,于距预手术位置大于7厘米处置入中心静脉导管,于此处分三次向胸腔内注入清洁空气400-1000mL,以保证6~10cm的基础操作空间。借助CT定位,确定最佳操作点,一般取腋中线第6-8肋间,采用尖端可弯曲电子胸腔镜(日本奥林巴斯株式会社,型号:LTF-240)患者取健侧卧位,手术部位采用2%利多卡因(H34020933,10mL/0.2g,安徽长江药业有限公司)局部麻醉,切开皮肤,皮下组织止血钳钝性分离,置入套管,插入内科胸腔镜,仔细观察脏层胸膜、壁层胸膜及膈胸膜,在胸腔镜直视下取病变组织,送病理科行病理检查,并收集胸腔积液5mL待检;检查后确定无出血等不良反应后撤镜,缝合切口,消毒后无菌敷料包扎固定;自之前置入的中心静脉导管处立即抽出气体600ml,根据情况决定是否连接闭式引流瓶。腔积液标本经3000r/min离心5min,取上层清液,采用全自动生化分析仪(美国贝克曼库尔特,型号:AU5800)检测ADA、CEA水平,ADA>22U/L、CEA>5ng/mL为阳性。⑵MSCT检测采用16层螺旋CT仪(苏州飞利浦,型号:Access CT),扫描范围由肺尖到肺底,扫描时嘱患者吸气,扫描结束后换气,管电压120kV,管电流180mAs,层间距5mm,层厚5mm,重建层厚1mm,增强扫描经肘正中静脉注射碘佛醇1.2~1.5mL/kg,注射流速2.5~3.0mL/s,延迟时间35s;采集到的原始数据传输至配套的工作站,行多平面重建、容积再现等重建成像。
1.3 病理学诊断标准内科胸腔镜采集到的病变组织,经病理证实为恶性病变则为恶性胸腔积液,纳入恶性组;病理活检见上皮肉芽肿及(或干酪样坏死)则为结核性胸腔积液,纳入结核组。
1.4 统计学方法数据采用SPSS 23.0统计软件处理及分析,符合正态分布的计量资料以()表示,采用t检验;计数资料以n(%)表示,行χ2检验;诊断价值采用Kappa一致性检验,Kappa值越高诊断价值越高;P<0.05表示差异具有统计学意义。
2 结果
2.1 两组MSCT影像学特征恶性组具有胸膜增厚、胸膜外脂肪层消失、大量/中量胸腔积液、明显强化的MSCT影像学特征,两组胸膜变化、胸腔积液量及增强情况比较,差异具有统计学意义(P<0.05),见表1。

表1 两组MSCT影像学特征n(%)
2.2 两组胸腔积液ADA、CEA水平比较恶性组胸腔积液ADA水平显著低于结核组(P<0.05),CEA水平则显著高于结核组(P<0.05),见表2。

表2 两组胸腔积液ADA、CEA水平比较
2.3 MSCT及胸腔积液ADA、CEA检测对胸腔积液性质的诊断价值分析以胸膜增厚或胸膜外脂肪层消失+大量/中量胸腔积液+明显强化作为MSCT诊断恶性胸腔积液的标准,其与病理活检的一致性Kappa值为0.672(P<0.05),见表3;以胸腔积液ADA≤22U/L且CEA>5ng/mL作为诊断恶性胸腔积液的标准,其与病理活检的一致性Kappa值为0.630(P<0.05),见表4。
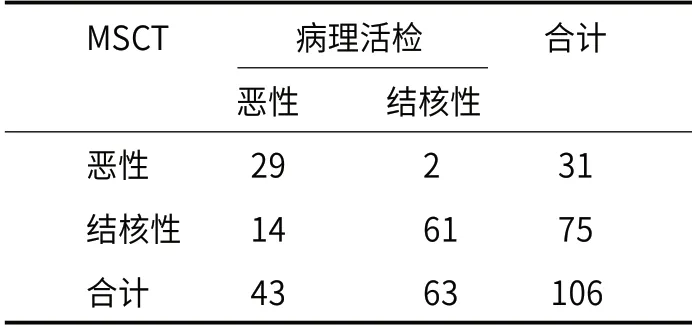
表3 MSCT的诊断价值分析
2.4 典型病例分析图1为恶性胸腔积液患者,普通CT见右侧胸膜粘连增厚,肝脏边缘结节状凸起(图1A),人工气胸术后复查胸部CT见右侧胸膜下结节样凸起,貌似菜花状,肝脏边缘亦见貌似菜花状结节样凸起(图1B),内科胸腔镜下见壁层胸膜及膈胸膜散在结节状凸起,局部融合成片,质韧不易活检,与人工气胸术后的CT表现高度相似(图1C),胸腔镜下活检组织病理可见上皮样细胞乳头状团巢状增生,形态较一致,结合免疫组化结果,诊断为恶性胸膜间皮瘤。图2为结核性胸腔积液患者,人工气胸术后胸部CT可见胸腔积液及气胸,未见明显胸膜粘连(图2A),胸腔镜下见壁层胸膜明充血水肿明显,局部可见片状干酪样坏死物覆盖(图2B),胸腔镜下活检组织病理可见凝固性坏死,诊断为结核(图2C)。

图1 恶性胸腔积液病例。图2 结核性胸腔积液病例。

表4 胸腔积液ADA、CEA检测的诊断价值分析
3 讨论
内科胸腔镜可直视胸腔内病灶,恶性病变可见胸膜表面白色结节样隆起物,且积液常为暗红色血性游离液体,而结核性胸腔积液可见胸膜充血水肿,及典型的干酪样坏死病灶,积液多为淡黄色液体,且能多点活检,直接经病理学定性诊断[6]。不仅如此,内科胸腔镜还能收集胸腔积液标本,分析相关标志物表达情况,辅助鉴别积液性质[7]。CEA等肿瘤标志物在细胞基因调控障碍发生癌变时可表达上调,在血管表皮组织的拦截下,癌变早期CEA不能大量进入血液循环,研究发现[8],CEA在癌变时可率先、大量进入胸腔。ADA在病原菌刺激下活性升高,并由细胞内释放至细胞外,其活性及表达量可随细胞免疫的改变而变化[9]。本研究中,恶性组胸腔积液ADA水平低于结核组,CEA水平则显著高于结核组,以胸腔积液ADA≤22U/L且CEA>5ng/mL作为诊断恶性胸腔积液的标准,与病理学诊断具有良好一致性,提示ADA、CEA可作为胸腔积液性质诊断的标志物,辅助临床诊疗。
另外,本研究发现,胸腔积液性质不同存在不同的MSCT影像学特征,恶性胸腔积液具有胸膜增厚、胸膜外脂肪层消失、大量/中量胸腔积液、明显强化的特征。分析其原因为:恶性肿瘤直接侵犯胸膜,引起胸膜结节样、局限性或弥漫性增厚,密度也相应升高,呈明显强化;胸膜外脂肪内移为肿瘤侵袭性表现,MSCT上则见该脂肪层消失;不仅病变直接侵犯胸膜引起积液,肿瘤还可压迫血管及淋巴管,造成血液及淋巴液回流受限,进一步增加积液[10-11]。不仅如此,以上述影像学征象作为诊断MSCT定性诊断标准,发现其与病理活检具有良好一致性,提示MSCT对鉴别胸腔积液性质有一定应用价值,作为无创性检查在胸腔积液诊疗中具有其优势。
综上所述,内科胸腔镜可多点活检,通过病理学检查诊断胸腔积液性质,且ADA、CEA可作为胸腔积液性质诊断的标志物,辅助临床判断,不同性质胸腔积液MSCT征象不同,MSCT无创性的特点在胸腔积液诊疗中具有其独特优势。

