NLRP3炎性小体促进脓毒症致急性肾损伤的机制研究
朱敏杰,何 琦,苗盈盈 (邯郸市中心医院肾内二科,河北 邯郸 056002)
脓毒症由感染后机体免疫系统的异常反应引起,是一种全身性炎症反应综合征,严重时可引起多器官功能障碍,如多器官衰竭。尽管抗生素治疗和生命支持等取得了巨大进展,但脓毒症患者的病死率仍在25%以上,并且其发病率不断增加[1]。脓毒症是危重病患者发生急性肾损伤的重要原因,占ICU中急性肾损伤的50%以上,具有较高的院内病死率[2]。在美国7个州的192 980例严重败血症患者中,有22%的患者发生急性肾损伤,病死率为38.2%[3]。脓毒症致急性肾损伤对人们的健康造成了巨大威胁,了解其发病机制对于开发新的治疗策略至关重要。NOD样受体家族热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)是一种胞质传感器,由中心NACHT结构域、C末端LRRs和N末端pyrin结构域组成[4]。研究表明,抑制NLRP3炎性小体活化可抑制脂多糖诱导的急性肾损伤小鼠炎症反应和肾损伤标志物中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)和肾损伤分子-1(kidney injury molecule-1,KIM-1)的表达[5]。NLRP3的激活导致Caspase-1成熟介导细胞焦亡,并调节IL-1β和IL-18等促炎细胞因子的分裂和成熟[6]。研究发现,NLRP3炎性小体参与急性肾损伤的进展[7],但其在脓毒症致急性肾损伤中的作用及机制尚未明确。半乳糖结合蛋白Galectin-3是一种β-半乳糖苷酶家族蛋白,其在细胞生长、分化、黏附和凋亡等生物学过程中发挥重要的作用。Galectin-3过表达可促进肾细胞凋亡和I型胶原蛋白合成,导致炎症和纤维化[8]。而NLRP3激活后会诱导细胞内氧化应激,导致Galectin-3的表达增加[9],提示NLRP3可能通过Galectin-3引发肾损伤。基于此,本研究以细胞焦亡和Galectin-3为切入点探讨NLRP3炎性小体对脓毒症致急性肾损伤的影响及机制。
1 材料与方法
1.1 实验材料
NLRP3抑制剂MCC950购自美国Selleck公司;Caspase-1抑制剂Ac-YVAD-CMK购自美国Glpbio公司;尿素氮、血肌酐、NGAL、IL-1β和IL-18检测试剂盒购自南京建成生物工程研究所;NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和 Galectin-3抗体购自英国Abcam公司;Caspase-1、KIM-1和焦亡相关蛋白消皮素D(Gasdermin D,GSDMD)抗体购自美国Cell Signaling Technology公司;GAPDH抗体购自武汉三鹰生物技术有限公司;糖原PAS染色液试剂盒购自北京索莱宝科技有限公司;Multiskan FC酶标检测仪(型号Accessory-Lamp 6V/10W)购自上海赛默飞世尔科技有限公司;垂直电泳转印系统(型号1658033)购自美国Biorad公司。
1.2 实验动物
健康SPF级雄性SD大鼠40只,8周龄,体质量(210±10)g,购自河北医科大学动物实验中心,动物生产许可证号:SCXK(冀)2020-001,动物使用许可证号:SYXK(冀)2020-002。大鼠饲养于温度(22±2)℃、12 h/12 h明暗交替的环境,自由饮水和饮食。本研究经我院动物伦理委员会审批通过(HDCH20210317)。
1.3 分组及造模
将大鼠随机分为对照组、模型组、MCC950组和Ac-YVAD-CMK组,每组10只。对照组大鼠仅探查盲肠,不进行结扎或穿透。采用盲肠结扎穿刺术[10]建立脓毒症大鼠模型:腹腔注射1%戊巴比妥钠50 mg/kg麻醉大鼠,暴露并结扎盲肠,针头穿透游离端2次,将肠管归位并逐层缝合腹腔。造模结束后,MCC950组大鼠腹腔注射MCC950 10 mg/kg[11],Ac-YVAD-CMK组大鼠腹腔注射Ac-YVAD-CMK 5 mg/kg[12]。24 h后,眼眶采血并处死大鼠,取出肾组织。
1.4 尿素氮、肌酐、NGAL含量检测
取各组大鼠血液,室温下1 000 g离心10 min后收集血清,根据尿素氮试剂盒(脲酶法)、肌酐试剂盒(肌氨酸氧化酶法)和NGAL试剂盒(乳胶增强免疫透射比浊法)进行检测,酶标仪测定各样品在450 nm波长处的OD值,根据标准曲线计算尿素氮、肌酐和NGAL的含量。
1.5 Western blot检测相关蛋白表达
将各组大鼠肾组织剪碎,RIPA裂解液裂解组织,在4 ℃下12 000 g离心10 min后取上清,BCA法测定蛋白浓度。取20 μg蛋白进行SDS-PAGE分离并转至PVDF膜上(250 mA,50 min)。10%脱脂奶粉封闭,随后加入 KIM-1(1:1 000)、NLRP3(1:2 000)、ASC(1:1 000)、Caspase-1(1:1 000)、GSDMD(1:1 000)、Galectin-3(1:1 000)和GAPDH(1:5 000)一抗,4 ℃下孵育过夜。加入HRP标记的二抗(1:5 000),室温孵育1 h后,滴加BeyoECL Star工作液到膜上,化学发光成像仪检测。
1.6 HE染色观察肾组织病理学改变
大鼠肾组织用4%多聚甲醛固定72 h,梯度酒精脱水,二甲苯透明。石蜡包埋、切片,常规二甲苯、酒精脱蜡至水,苏木素染色10 min,0.7%盐酸酒精分化,流水清洗后,伊红液浸染3 min。梯度酒精脱水,二甲苯透明,中性树胶封片。切片于光学显微镜下放大观察分析。由3位肾病理专家分别对切片进行组织病理学损伤评分,评分标准见表1。

表1 肾组织病理学评分标准[13]
1.7 PAS染色观察肾小管损伤情况
制备大鼠肾组织石蜡切片,然后常规脱蜡至水,高锰酸酒精溶液反应10 min,70%酒精清洗后,加入还原液1 min,70%酒精清洗后,加入无色碱性品红溶液1 h。流水冲洗后苏木素复染5 min,1%盐酸酒精分化;流水冲洗,脱水,透明,中性树胶封片,光学显微镜下观察。用Image J软件进行糖原沉积相对定量。
1.8 IL-1β和IL-18的检测
取各组大鼠血液,1 000 g离心10 min后收集血清,根据IL-1β和IL-18 ELISA检测试剂盒说明书进行检测,酶标仪测定各样品在450 nm波长处的OD值,根据标准曲线计算IL-1β和IL-18含量。
1.9 统计学分析
采用SPSS 19.0统计学软件进行数据分析。符合正态分布的计量资料以均数±标准差(x-±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),进一步组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 MCC950和Ac-YVAD-CMK改善脓毒症致急性肾损伤大鼠肾功能
与对照组相比,模型组大鼠尿素氮、肌酐、NGAL和KIM-1表达均显著升高(P<0.05);与模型组相比,MCC950组和Ac-YVAD-CMK组大鼠尿素氮、肌酐、NGAL和KIM-1表达均显著降低(P<0.05),见图1。

图1 MCC950和Ac-YVAD-CMK对脓毒症急性肾损伤大鼠肾功能的影响
2.2 MCC950和Ac-YVAD-CMK改善大鼠肾组织病理学损伤
HE染色显示,对照组大鼠肾组织结构正常;与对照组相比,模型组大鼠肾小球肥大伴肾小球间隙扩大,有炎症细胞浸润,肾小管上皮细胞胞浆空泡化,肾组织病理学评分显著升高(P<0.05);与模型组相比,MCC950组和Ac-YVAD-CMK组大鼠肾组织病理学损伤得到明显改善,肾组织病理学评分显著降低(P<0.05),见图2。
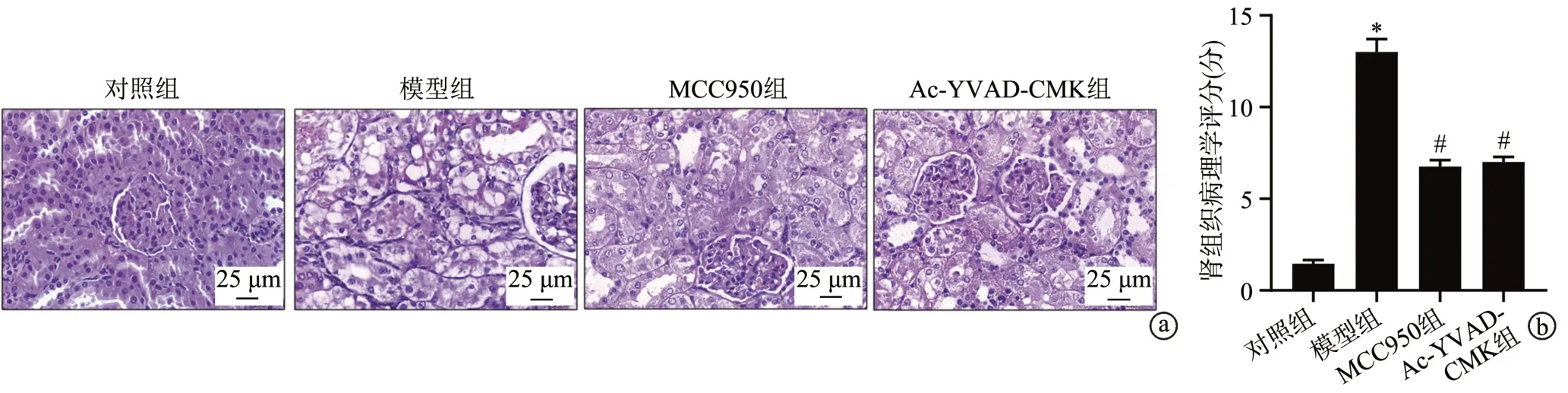
图2 HE染色观察大鼠肾组织病理学变化
PAS染色显示,与对照组相比,模型组大鼠肾组织糖原沉积水平显著升高(P<0.05);与模型组相比,MCC950组和Ac-YVAD-CMK组大鼠肾组织糖原沉积水平显著降低(P<0.05),见图3。

图3 PAS检测大鼠肾组织糖原沉积水平
2.3 MCC950和Ac-YVAD-CMK抑制NLRP3/Caspase-1通路蛋白表达
Western blot结果显示,与对照组相比,模型组NLRP3、ASC和Caspase-1表达显著升高(P<0.05);与模型组相比,MCC950组大鼠NLRP3和Caspase-1表达显著降低(P<0.05),Ac-YVAD-CMK组大鼠Caspase-1表达显著降低(P<0.05),MCC950组和Ac-YVAD-CMK组ASC表达无显著差异(P>0.05),见图4。
2.4 MCC950和Ac-YVAD-CMK抑制大鼠细胞焦亡和炎症反应
Western blot和ELISA结果显示,与对照组相比,模型组大鼠GSDMD蛋白表达、IL-1β和IL-18含量显著升高(P<0.05);与模型组相比,MCC950组和Ac-YVAD-CMK组大鼠GSDMD蛋白表达、IL-1β和IL-18含量显著降低(P<0.05),见图5。
2.5 MCC950和Ac-YVAD-CMK抑制Galectin-3蛋白表达
Western blot结果显示,与对照组相比,模型组大鼠Galectin-3蛋白表达显著升高(P<0.05);与模型组相比,MCC950组和Ac-YVAD-CMK组大鼠Galectin-3蛋白表达显著降低(P<0.05),见图6。
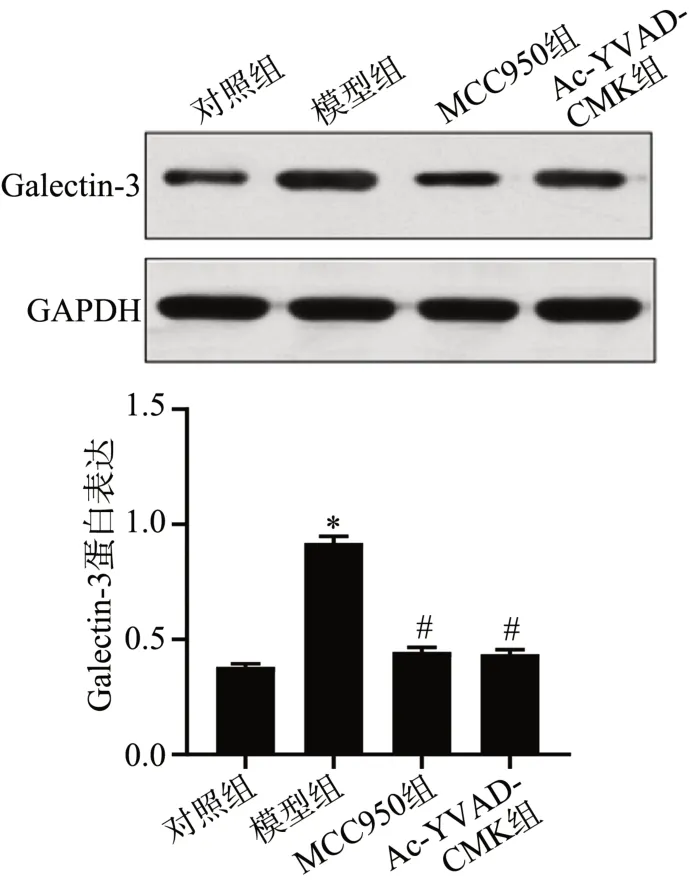
图6 Western blot 检测大鼠Galectin-3表达
3 讨论
肾常驻单核细胞和实质细胞的激活取决于炎症依赖性NLRP3,而这种激活与各种肾疾病中的无菌性炎症和慢性炎症密切相关。因此,炎症依赖性NLRP3的激活在肾疾病的进展中具有重要作用。当NLRP3被激活时,传感器蛋白寡聚并招募衔接蛋白ASC,然后与Caspase-1结合形成NLRP3炎性小体,随后介导IL-1β和IL-18等促炎细胞因子的成熟和分泌[14]。研究表明,造影剂致肾巨噬细胞中NLRP3炎性小体活化,而敲除NLRP3的小鼠肾上皮细胞损伤和炎症减轻,造影剂导致的急性肾损伤得到改善[15]。本研究结果表明,脓毒症致急性肾损伤大鼠NLRP3、ASC和Caspase-1蛋白表达上调,说明脓毒症致急性肾损伤大鼠NLRP3炎性小体被激活;NLRP3抑制剂MCC950和Caspase-1抑制剂Ac-YVAD-CMK干预后,大鼠尿素氮、肌酐、NGAL和KIM-1等肾损伤相关指标表达均明显下调,肾组织病理学损伤得到明显改善,血清IL-1β和IL-18含量明显下调。这说明抑制NLRP3炎性小体的激活可改善脓毒症大鼠急性肾损伤,减轻炎症。
细胞焦亡被认为是炎症性Caspase-1依赖的程序性细胞死亡,与炎性小体的激活密切相关。Caspase-1可切割非活性IL-1β和IL-18前体,将其转化为具有活性的炎症因子,导致细胞焦亡[16]。小鼠心肌梗死后,NLRP3/Caspase-1/IL-1β通路被激活,而抑制NLRP3/Caspase-1/IL-1β通路后,小鼠心肌损伤得到明显改善[17]。此外,Caspase-1可以裂解GSDMD产生N末端裂解产物,该产物进一步形成质膜孔引起细胞焦亡[18]。本研究结果显示,脓毒症致急性肾损伤大鼠肾GSDMD表达及血清IL-1β、IL-18含量较对照组大鼠明显上调,而使用MCC950和Ac-YVAD-CMK后,大鼠GSDMD表达、IL-1β和IL-18含量明显下调,说明激活NLRP3/Caspase-1通路可能通过促进脓毒症大鼠细胞焦亡,加重急性肾损伤。
Galectin-3是一种β-半乳糖苷结合凝集素,在肾纤维化和肾功能衰竭中起重要作用,是肾损伤进展的关键因子之一。研究表明,改性柑桔果胶抑制Galectin-3表达后,可明显改善顺铂诱导的急性肾损伤[19]。急性缺血再灌注诱导的急性肾损伤刺激了肾和心脏组织中Galectin-3的表达,敲低Galectin-3可抑制炎症反应,改善心肌损伤和功能障碍[17]。已有研究表明,可通过上调NLRP3/Caspase-1通路中Galectin-3的表达,促进糖尿病兔心房颤动和结构重塑[20]。本研究结果显示,脓毒症致急性肾损伤大鼠肾组织中Galectin-3表达明显上调,而使用MCC950和Ac-YVAD-CMK后,大鼠肾组织中Galectin-3表达明显下调。说明激活NLRP3/Caspase-1通路可能通过上调Galectin-3的表达,加重脓毒症大鼠急性肾损伤。
综上所述,NLRP3炎性小体通过诱导细胞焦亡和上调Galectin-3的表达促进脓毒症大鼠急性肾损伤。本研究为明确脓毒症致急性肾损伤的发生发展机制提供了新的研究方向。但本研究并未深入探讨NLRP3炎性小体/Galectin-3轴促进脓毒症急性肾损伤的具体机制,有待后续进一步研究。

