过表达CBX7调控PTEN/Akt信号通路干预上皮-间充质转化抑制胃癌细胞迁移、侵袭
谭 斌,刘剑波,李芳芳,彭 艳,钟月圆,邓 晖,王秀丽 (郴州市第一人民医院中心医院消化内科,湖南 郴州 423000)
胃癌是消化道恶性肿瘤之一,其发病率在我国恶性肿瘤中居第2位,病死率居第3位[1]。近年来,医学技术的进步、手术方法的改进、免疫治疗及新辅助化疗的应用极大地延长了胃癌患者的生存期,然而肿瘤转移和复发仍不可避免,导致胃癌患者预后差、生存质量低[2-3]。因此,深入研究胃癌发展、转移的分子机制极为必要。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤远处转移过程中的关键步骤之一,临床上,EMT与癌症预后不良密切相关[4-5]。染色体盒蛋白同源物7(chromosome box protein homologue 7,CBX7)是多梳蛋白家族中的一员,属于黑腹果蝇的异染色质蛋白在人类细胞中的同源物,主要分布于细胞核的染色质中,通过与染色质结合发挥作用[6]。CBX7的表达与多种癌症的不良预后和侵袭转移相关,在癌症发生和进展中起着重要的作用[7-8]。研究发现,CBX7在胃癌组织中低表达,其低表达与胃癌患者的不良预后和生存率低显著相关[9],CBX7通过p16和Akt/NF-κB/miR-21信号通路调节胃癌细胞的干细胞样特性[10]。但CBX7对胃癌细胞迁移、侵袭及EMT的影响尚不明确。因此,本研究就CBX7对胃癌细胞迁移、侵袭及EMT的影响展开探讨,并分析其潜在作用机制。
1 材料与方法
1.1 实验材料
人胃癌细胞SGC7901(中国科学院细胞库);CBX7过表达质粒和阴性对照质粒、CBX7 siRNA和阴性对照siRNA(上海吉玛生物公司);RPMI-1640培养基(深圳华晨阳科技有限公司);Lipofectamine 2000转染试剂盒(美国Invitrogen公司);CCK-8试剂盒、BCA蛋白定量试剂盒、ECL试剂盒(上海碧云天生物技术公司);结晶紫染色液(武汉卡诺斯科技有限公司);Matrigel基质胶、Transwell小室(美国BD公司);CBX7和GAPDH引物(上海捷瑞生物工程有限公司);RNA提取试剂盒、反转录试剂盒、SYBR Premix Ex Taq试剂盒(大连宝生物工程有限公司);兔源GAPDH、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、磷酸酶张力蛋白同源物基因(phosphatase and tensin homolog deleted on chromosometen,PTEN)、蛋白激酶B(Akt)、磷酸化Akt(p-Akt)单克隆抗体及生物素偶联的IgG二抗(英国Abcam公司)。
Heracell VIOS 160i细胞培养箱(美国Thermo Fisher公司);PT-3502PC多功能酶标仪(北京普天新桥技术有限公司);WMF-3690型倒置荧光显微镜(上海无陌光学仪器有限公司);JY-ZY5型电泳仪(济南君意生物科技有限公司);RTQ-960 Pro qRT-PCR仪[艾康生物技术(杭州)有限公司];KETA GL型凝胶成像系统(北京好亿科技发展有限公司)。
1.2 细胞培养
人胃癌细胞SGC7901置于RPMI-1640培养基中培养,培养基中添加10%胎牛血清和1%青霉素-链霉素,培养箱温度为37 ℃,CO2浓度为5%。
1.3 细胞转染与分组
按照Lipofectamine 2000转染试剂盒说明书,将CBX7过表达质粒和阴性对照质粒、CBX7 siRNA和阴性对照siRNA转染至对数生长期的SGC7901细胞,依次记为pcDNA-CBX7组、pcDNA-NC组、si-CBX7组和si-NC组,同时将正常培养的细胞作为阴性对照组(NC组)。转染48 h后检测转染效率。
1.4 qRT-PCR法检测细胞中CBX7 mRNA表达水平
收集各组SGC7901细胞,采用TRIzol试剂提取RNA并进行定量,用反转录试剂盒反转录合成cDNA,按照SYBR Premix Ex Taq试剂盒说明书配置实验体系,进行qRT-PCR检测。引物序列如下:CBX7上游引物为5'-CATGGAGCTGTCAGCCATC-3',下游引物为5'-CTGTACTTTGGGGGCCATC-3';GAPDH 上游引物为5'-ACCCAGAAGACTGTGGATGG-3',下游引物为5'-CAGTGAGCTTCCCGTTCAG-3'。 反 应条件:95 ℃3 min,95 ℃ 15 s,60 ℃ 20 s,72 ℃ 10 s,共40 次循环。实验重复 3次,采用 2-ΔΔCt法进行分析。
1.5 CCK-8法检测细胞增殖活性
各组SGC7901细胞按1×104/mL接种至96孔培养板,设置5个复孔,同时设置对照孔和空白孔,培养24 h后,每孔加入10 μL CCK-8试剂孵育4 h,采用酶标仪测定各孔在450 nm波长处的吸光度(OD)值。实验重复3次,细胞存活率(%)=(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100%。
1.6 细胞划痕实验检测细胞迁移能力
各组SGC7901细胞按1×105/mL接种至6孔培养板,培养至细胞贴壁生长后,以200 μL移液枪枪头垂直划痕,做好标记,PBS冲洗,加入RPMI-1640培养基继续培养24 h。实验重复3次,细胞迁移率(%)=(0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%。
1.7 Transwell小室检测细胞侵袭能力
收集各组SGC7901细胞,取100 μL浓度为2×105/mL的细胞悬液接种至含有Matrigel基质胶包被膜的Transwell小室上室,下室添加600 μL含10%胎牛血清的RPMI-1640培养基,孵育24 h后,清除上室细胞,用4%多聚甲醛固定穿过膜的细胞,并用0.1%结晶紫染色20 min,倒置显微镜下观察,计数侵袭细胞数目,实验重复3次。
1.8 Western blot法检测细胞CBX7蛋白、EMT相关蛋白和PTEN/Akt信号通路蛋白表达水平
蛋白裂解液提取各组SGC7901细胞总蛋白,BCA试剂盒定量,SDS-PAGE分离蛋白样品,并湿转至PVDF膜上,用5%脱脂牛奶封闭膜2 h,TBST洗膜,将膜与 CBX7、E-cadherin、N-cadherin、Vimentin、PTEN、Akt、p-Akt、GAPDH 一抗(1∶1 000)在 4 ℃孵育过夜,TBST洗膜,加入IgG二抗(1∶5 000)室温孵育1 h,ECL试剂显影,分析蛋白条带灰度值。实验重复3次。
1.9 统计学方法
采用SPSS 25.0软件进行统计学分析,实验数据以均数±标准差(-x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 SGC7901细胞中CBX7表达水平
与NC组比较,pcDNA-NC组和si-NC组SGC7901细胞中CBX7 mRNA和蛋白表达量变化均无统计学差异(P>0.05);与pcDNA-NC组比较,pcDNA-CBX7组SGC7901细胞中CBX7 mRNA和蛋白表达量均显著增加(P<0.05);与 si-NC组比较,si-CBX7组 CBX7 mRNA和蛋白表达量均显著下降(P<0.05),见图1,提示转染效果良好。

图1 SGC7901细胞中CBX7表达水平
2.2 过表达CBX7抑制SGC7901细胞增殖、迁移和侵袭
与NC组比较,pcDNA-NC组SGC7901细胞存活率、迁移率及侵袭数变化均无统计学差异(P>0.05);与pcDNA-NC组比较,pcDNA-CBX7组SGC7901细胞存活率、迁移率及侵袭数均显著下降/减少(P<0.05),见图2,提示过表达CBX7抑制SGC7901细胞增殖、迁移和侵袭。

图2 过表达CBX7抑制SGC7901细胞增殖、迁移和侵袭
2.3 过表达CBX7抑制SGC7901细胞EMT
与NC组比较,pcDNA-NC组SGC7901细胞中E-cadherin、N-cadherin、Vimentin蛋白表达量变化均无统计学差异(P>0.05);与pcDNA-NC组比较,pcDNACBX7组SGC7901细胞中E-cadherin蛋白表达量显著升高(P<0.05),N-cadherin、Vimentin蛋白表达量显著下降(P<0.05),见图 3,提示过表达 CBX7抑制SGC7901细胞EMT进程。
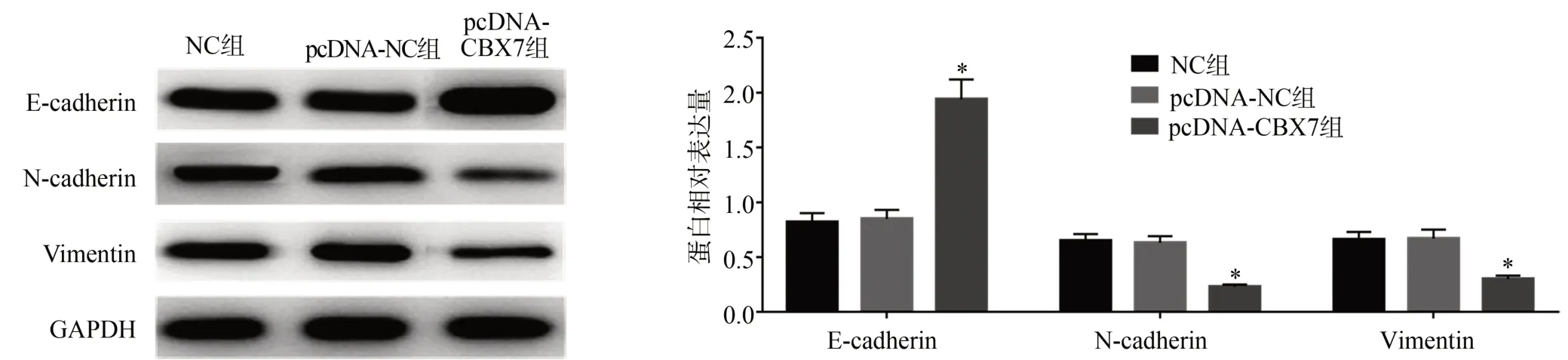
图3 过表达CBX7抑制SGC7901细胞EMT
2.4 下调CBX7表达促进SGC7901细胞增殖、迁移和侵袭
与NC组比较,si-NC组SGC7901细胞存活率、迁移率及侵袭数变化均无统计学差异(P>0.05);与si-NC组比较,si-CBX7组SGC7901细胞存活率、迁移率及侵袭数均显著升高/增加(P<0.05),见图4,提示下调CBX7促进SGC7901细胞增殖、迁移和侵袭。

图4 下调CBX7表达促进SGC7901细胞增殖、迁移和侵袭
2.5 下调CBX7表达促进SGC7901细胞EMT
与NC组比较,si-NC组SGC7901细胞中E-cadherin、N-cadherin、Vimentin蛋白表达量变化均无统计学差异(P>0.05);与si-NC组比较,si-CBX7组SGC7901细胞中E-cadherin蛋白表达量显著下降(P<0.05),N-cadherin、Vimentin蛋白表达量显著升高(P<0.05),见图5,提示下调CBX7促进SGC7901细胞EMT进程。
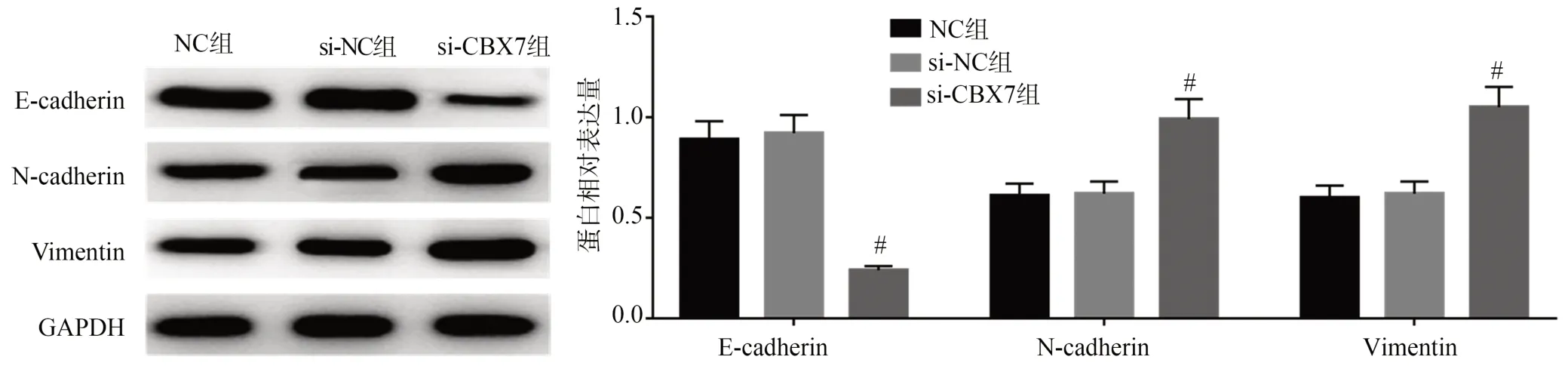
图5 下调CBX7表达促进SGC7901细胞EMT
2.6 CBX7对SGC7901细胞中PTEN/Akt信号通路蛋白表达的影响
与NC组比较,pcDNA-NC组和si-NC组SGC7901细胞中PTEN蛋白表达量、p-Akt/Akt变化均无统计学差异(P>0.05);与pcDNA-NC组比较,pcDNA-CBX7组SGC7901细胞中PTEN蛋白表达量显著升高(P<0.05),p-Akt/Akt显著下降(P<0.05);与si-NC组比较,si-CBX7组SGC7901细胞中PTEN蛋白表达量显著下降(P<0.05),p-Akt/Akt显著升高(P<0.05),见图6,提示过表达CBX7通过上调PTEN抑制Akt信号通路活性。

图6 CBX7对SGC7901细胞中PTEN/Akt信号通路蛋白表达的影响
3 讨论
胃癌起源于胃壁最表层的黏膜上皮细胞,可发生于胃的各个部位,是具有高度侵袭和转移特性的恶性肿瘤。胃癌早期患者临床症状不明显,多数胃癌患者确诊时已发生远处转移,而胃癌细胞发生转移是导致胃癌患者病死率高和预后差的主要原因。因此,探究胃癌侵袭、转移的相关机制,对降低胃癌患者病死率和改善预后具有重要意义。CBX7在哺乳动物大脑、心脏及骨骼肌组织等中均有表达,可维持机体组织的正常生长发育。在细胞中,CBX7通常作为表观遗传调控因子调节基因表达,然而,在病理状态下CBX7的异常表达可导致基因表达失衡,这与肿瘤的发生、发展密切相关。在人类肿瘤中,CBX7起着双重作用,一方面其通过抑制抑癌基因促进某些癌症的进展;另一方面,其通过与不同分子的相互作用调节相关蛋白合成,进而抑制癌症进展[11-12]。在宫颈癌中,CBX7过表达可抑制细胞增殖、迁移和侵袭,诱导细胞凋亡,作为抑癌因子发挥作用[13]。在神经胶质瘤中,CBX7通过沉默CCNE1诱导细胞G1/S期阻滞,可作为神经胶质瘤预后标志物[14]。此外,CBX7可作为miR-19及miR-18a等多种microRNAs的靶基因,对卵巢癌、非小细胞肺癌等肿瘤细胞迁移、侵袭及EMT发挥调控作用[15-16]。但CBX7对胃癌细胞迁移、侵袭的影响尚不清楚。本研究通过调控CBX7的表达,分析CBX7对胃癌细胞增殖、迁移和侵袭的影响,结果显示,过表达CBX7可抑制胃癌SGC7901细胞增殖、迁移和侵袭,下调CBX7表达可促进胃癌SGC7901细胞增殖、迁移和侵袭,提示CBX7可通过调控细胞增殖、迁移和侵袭而调控胃癌进展。
EMT是一个复杂的生物学过程,不仅包括细胞-细胞连接的溶解,还包括顶端外侧极性的丧失。在EMT过程中,上皮细胞失去细胞黏附蛋白(如E-cadherin)和紧密连接蛋白的表达,并同时表达丰富的N-cadherin和Vimentin等间充质标志物,从而完成从上皮到间充质的表型转化,转化后的细胞表现出细胞间黏附减少和运动性增加,使肿瘤细胞获得较强的迁移性和侵袭性[17]。研究报道,复合物CBX7-PRMT1在调节E-cadherin表达和细胞迁移中起关键作用[18]。Tian等[19]报道,CBX7表达降低与宫颈癌EMT和不良预后相关。本研究探讨CBX7表达变化与胃癌EMT的相关性,结果显示,过表达CBX7后SGC7901细胞中E-cadherin蛋白表达升高,N-cadherin、Vimentin蛋白表达下降,下调CBX7表达后SGC7901细胞中E-cadherin蛋白表达下降,N-cadherin、Vimentin蛋白表达升高,提示CBX7可调控胃癌细胞SGC7901的EMT进程。
肿瘤的发生、转移过程涉及多个信号途径和多种分子机制,其中PTEN/Akt通路是近年来研究较多的相关通路之一。PTEN是一种磷酸酶,通过负调节Akt信号通路调节各种转录因子和信号分子的活性,进而调控细胞周期、细胞凋亡,并参与细胞增殖、迁移和侵袭。在胃癌发生、发展进程中,PTEN/Akt信号通路参与胃癌血管生成以及胃癌细胞增殖、迁移、凋亡和EMT等生物学过程。Zhou等[20]报道,靶向miR-21通过PTEN/Akt信号通路抑制胃癌细胞增殖和迁移。Wu等[21]报道,miR-616-3p通过PTEN/Akt/mTOR通路促进胃癌血管生成和EMT。Qiang等[22]报道,姜黄素通过调控miR-21/PTEN/Akt通路,与PD98059协同诱导人胃癌细胞凋亡。还有研究显示,CBX7可通过调节PTEN/Akt信号通路抑制癌细胞增殖、迁移和侵袭[23]。本研究结果显示,过表达CBX7显著上调SGC7901细胞中PTEN蛋白表达,使Akt磷酸化减少;而下调CBX7表达则使SGC7901细胞中PTEN蛋白表达显著下调,Akt磷酸化增加。提示CBX7可通过调控PTEN/Akt信号通路参与胃癌细胞EMT进程及细胞迁移和侵袭。
综上所述,本研究证实过表达CBX7可抑制胃癌细胞增殖,并可通过抑制EMT抑制胃癌细胞迁移、侵袭,其机制可能是与调控PENT/Akt信号通路有关。因此,CBX7可能是胃癌转移和预后的相关标志物及潜在治疗靶点。

