GⅠ.1型人札如病毒的体外培养及其衣壳蛋白VP1多克隆抗体的制备
杜文静,刘丹,丛鑫,庞立丽,毛彤瑶,段招军
1.甘肃中医药大学公共卫生学院,甘肃 兰州 730000;2.中国疾病预防控制中心病毒病预防控制所,北京 102206
札如病毒(sapovirus,SaV)为杯状病毒科札幌病毒属成员,于1976 年首次在英国人腹泻粪便样本中发现,是引起人及动物急性胃肠炎的重要非细菌性病原体,各年龄段人群均可被感染并导致疾病的发生[1-2]。
SaV为单股正链RNA病毒,其基因组全长7 100 ~7 700 bp,编码2 或3 个开放阅读框(open reading flame,ORF),其中ORF1 编码1 个大的多聚蛋白,随后被切割为6 个成熟的非结构蛋白(NS1、NS2、NS3、NS4、NS5 和NS6-7)和1 个主要衣壳蛋白VP1;ORF2编码次要结构蛋白VP2;ORF3 编码1 个小的碱性蛋白,但其功能尚不明确[3-4]。根据VP1基因的多样性,SaV 被分为5 个基因群(GⅠ~GⅤ),其中GⅠ、GⅡ、GⅣ、GⅤ主要感染人[3-9]。2015 年,OKA 等[4]根据完整VP1核苷酸序列,又将人SaV(HuSaV)进一步分为17个基因型,即GⅠ.1 ~7、GⅡ.1 ~7、GⅣ.1和GⅤ.1 ~2。
虽然SaV 已发现几十年,但体外培养的完整体系尚未建立,严重阻碍了其进一步研究。目前仅有少数几株猪SaV 成功在原代猪肾细胞或猪肾细胞系(即LLC-PK1)中获得培养,而这些毒株的成功培养依赖于猪肠内容物或胆汁酸的存在[10-12]。胆汁酸的存在是病毒从内体逃逸至细胞质以启动病毒复制的关键[13-15]。由于HuSaV 具有高度的遗传多样性,随着研究的深入及时间的推移,新基因群或基因型还可能会出现,这将给检测、治疗及防控带来更多的困难。为此,本研究对GⅠ.1 型HuSaV 进行体外细胞培养及其VP1 蛋白多克隆抗体的制备,以期为进一步研究该病毒的感染机制及血清学诊断方法的建立奠定基础。
1 材料与方法
1.1 标本、载体及细胞 GⅠ.1型HuSaV阳性粪便标本和pGEX-6P-1 载体均由中国疾病预防中心病毒病预防控制所腹泻室保存;人十二指肠腺癌细胞(HuTu-80)购自ATCC;E.coliBL21(DE3)感受态细胞购自天根生化科技(北京)有限公司。
1.2 实验动物 2 只SPF 级新西兰大白兔,6 ~8 月龄,雌性,体质量2.5 kg,购自苏州博奥龙科技有限公司,动物合格证号:SCXK(苏)2022-0004。本实验均以科研为目的对实验动物进行养殖和使用,且严格按照中国疾病预防控制中心病毒病预防控制所动物实验伦理相关规定进行(20200921048)。
1.3 主要试剂及仪器 DMEM和FBS购自美国Gibco公司;甘氨鹅脱氧胆酸(GCDCA)、甘氨胆酸(GCA)、IPTG 和弗氏佐剂购自美国Sigma 公司;SuperScript™Ⅲ反转录酶试剂盒购自美国Invitrogen 公司;预染蛋白marker 购自加拿大Fermentas 公司;HRP 标记的山羊抗兔IgG 购自英国Abcam 公司;谷胱甘肽琼脂糖磁珠和凝胶层析纯化柱Superdex20010/600GL购自美国GE Healthcare Life Sciences 公司;QIAGEN One-step RT-PCR 和IAamp 病毒RNA 提取试剂盒购自德国Qiagen公司;Quick Taq HS购自日本Toyobo公司。
1.4 GⅠ.1型HuSaV粪便悬液及稀释液的制备 在生物安全柜内取GⅠ.1 型HuSaV 阳性粪便标本并称重,取0.5 g,加入4.5 mL 无菌DMEM,混匀,用涡旋振荡器反复振荡3 ~4次,4 ℃,1 800×g离心20 min;收集上清至洁净无菌离心管中,重复离心1 次;用0.45 和0.22 μm 的滤膜分别过滤离心后的粪便滤液,分装10%粪便悬液,100 μL/管,置-80 ℃保存。将10%粪便悬液按1∶10 比例用无菌DMEM 稀释:取10 μL 10%粪便悬液(2×108拷贝/μL),加至90 μL DMEM 中,混匀,得到1∶10 的工作液;再取100 μL 1∶10 工作液,加至900 μL DMEM 中,混匀,得到1∶100的10%粪便悬液。
1.5 HuSaV感染HuTu-80细胞及其在细胞中生长动力学检测 将生长状态良好的HuTu-80 细胞均匀接种于7.5 cm 培养皿中,待细胞长至70% ~80%单层后弃去上清,加入100 μL 制备的病毒稀释液(约2×106个拷贝数),同时分别添加终浓度为500 μmol/L的GCDCA或1 000 μmol/L GCA,每种胆酸盐设3个重复,以不加病毒稀释液的细胞作为阴性对照[16],置于37 ℃,5% CO2培养箱中过夜培养;用500 μL 无血清DMEM 洗涤细胞培养皿3 次,加入1 mL 含2% ~3%FBS 的DMEM 培养液,继续培养7 d;取各培养皿细胞上清液,利用病毒RNA 提取试剂盒提取病毒RNA,通过SuperScript™Ⅲ反转录酶合成cDNA,以其为模板,用Quick Taq HS PCR扩增VP1基因(279 bp)。上游引物1245Rfwd:5'-TAGTGTTTGARATGGAGGG-3';下游引物SV-G1-R:5'-CCCBGGTGGKAYGACAGAAG-3',SV-G2-R:5'-CCANCCAGCAAACATNGCRCT-3',SV-G4-R:5'-GCGTAGCAGATCCCAGATAA-3',SV-G5-R:5'-TTGGAGGWTGTTGCTCCTGTG-3'(确定胆酸盐的选择)。引物由北京擎科生物科技有限公司合成。PCR反应条件:94 ℃2 min;94 ℃30 s,56 ℃30 s,68 ℃25 s,共35个循环;68 ℃7 min。
为确定GⅠ.1 型HuSaV 感染HuTu-80 细胞不同时间的感染动力学,采用上述病毒液接种方式,同时添加1 000 μmol/L选择的胆酸盐,分别于感染后1、3、5 和7 d 收获细胞上清液,于-80 ℃保存,提取病毒RNA,进行RT-qPCR检测,引物及探针设计参照文献[16]。首先制备标准品:取2 μL浓度为1011拷贝/μL的RNA加入18 μL DEPC水中,涡旋振荡混匀后,取10 μL加入90 μL DEPC 水中,依次稀释,直至100拷贝/μL。利用QIAGEN One-step RT-PCR 试剂盒对不同时间点提取的病毒RNA进行RT-qPCR。
1.6 不同代次GⅠ.1型HuSaV对HuTu-80细胞感染性的检测 将P1、P2、P3 代次病毒液(约1.5 × 106拷贝)分别接种HuTu-80细胞,同时添加1 000 μmol/L选择的胆酸盐,分别于感染后1、3、5 d收获细胞上清液,提取病毒RNA,进行RT-qPCR 检测。每代次不同时间点均设3个重复。
1.7VP1基因的扩增 根据GⅠ.1 型HuSaV 基因序列设计扩增VP1全长基因引物。上游引物:5'-GAGGATCCATGGAGGGCAATGGCTCCAATTC-3'(斜体部分为BamHⅠ酶切位点),下游引物:5'-ACGCGTCGACTCATTGGAACACCCGTCTGGCC-3'(斜体部分为SalⅠ酶切位点),扩增片段大小为1 686 bp。引物由北京擎科生物科技有限公司合成。利用QIAamp病毒RNA提取试剂盒提取病毒RNA,通过SuperScript™Ⅲ反转录酶合成cDNA,以其为模板进行PCR扩增。PCR反应条件:98 ℃30 s;98 ℃10 s,58 ℃30 s,72 ℃50 s,共35个循环;72 ℃2 min。
1.8 重组表达质粒的构建 用DNA胶回收试剂盒回收PCR 产物,经BamHⅠ和SalⅠ双酶切,通过T4DNA 连接酶连接至同样经BamHⅠ和SalⅠ双酶切的载体pGEX-6P-1 中,获得重组表达质粒pGEX-6P-1-VP1,转化E.coliBL21(DE3)感受态细胞,涂布含100 μg/mL氨苄青霉素的LB培养板,随机挑取单个阳性菌落培养,提取质粒进行双酶切鉴定,并送北京擎科生物科技有限公司测序分析。
1.9 重组VP1 蛋白的表达及纯化 将测序正确的阳性菌液按1%比例转接至新的1.5 L LB 培养基中,37 ℃培养3 ~4 h,待菌液A600达0.6 ~1.0时,加入终浓度为0.5 mmol/L 的IPTG,16 ℃诱导过夜;7 000×g离心10 min,弃上清,收集菌体,PBS 重悬,置于冰浴中超声破碎(功率80%,超声4 s,间隔7 s)90 min;4 ℃,16 000×g离心60 min,0.45 μm 滤膜过滤上清并留取样本;同时设空质粒pGEX-6P-1 转化后并诱导菌液作为阴性对照。利用谷胱甘肽进行蛋白纯化:取过滤上清,与谷胱甘肽琼脂糖磁珠混合,置于翻转摇床中,4 ℃结合;用25 mL PBS 清洗7 次,加入3C 蛋白酶去除GST 蛋白标签,4 ℃翻转过夜;于亲和层析柱中收取流穿液,获得目的蛋白。12%SDS-PAGE及考马斯亮蓝染色鉴定表达及纯化产物。
1.10 动物免疫 按照每剂500 μg 将纯化的VP1 蛋白与弗氏佐剂混合,单剂组分:VP1 抗原380 μL,佐剂500 μL,120 μL 0.9% NaCl。经背部皮下多点注射2 只新西兰大耳白兔,1 mL/只,注射前采集少量兔耳中动脉血作为阴性对照。于18、28、38 d按照初次免疫相同方法分别加强免疫1次。
1.11 血清效价的检测 免疫后18、28、38 和48 d 采集兔耳中动脉血,分离血清,ELISA法检测血清效价:将浓度为2 μg/mL 纯化VP1 蛋白包被96 孔酶标板,60 μL/孔,4 ℃孵育过夜;PBS-T 洗涤3 次,加入5%脱脂乳,250 μL/孔,37 ℃孵育1 h;PBS-T 洗涤3次,加入倍比稀释的待测血清(起始稀释度为1∶500),60 μL/孔,同时设空白对照和阴性血清对照孔,37 ℃孵育2 h;PBS-T 洗涤3次,加入HRP 标记的山羊抗兔IgG(1∶5 000 稀释),60 μL/孔,37 ℃孵育1 h;TMB显色,1%NaF终止反应,酶标仪测定A450值。
1.12 统计学分析 应用GraphpadPrism7.0软件(Graph-Pad Software,CA,USA)对实验数据进行方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HuSaV体外培养胆酸盐的选择 GⅠ.1型HuSaV感染的HuTu-80 细胞添加GCDCA 或GCA 培养7 d后,细胞上清的PCR产物经1.5%琼脂糖凝胶电泳分析,可见279 bp的特异条带,大小与预期一致,且GCA能有效促进病毒对细胞的感染。见图1。
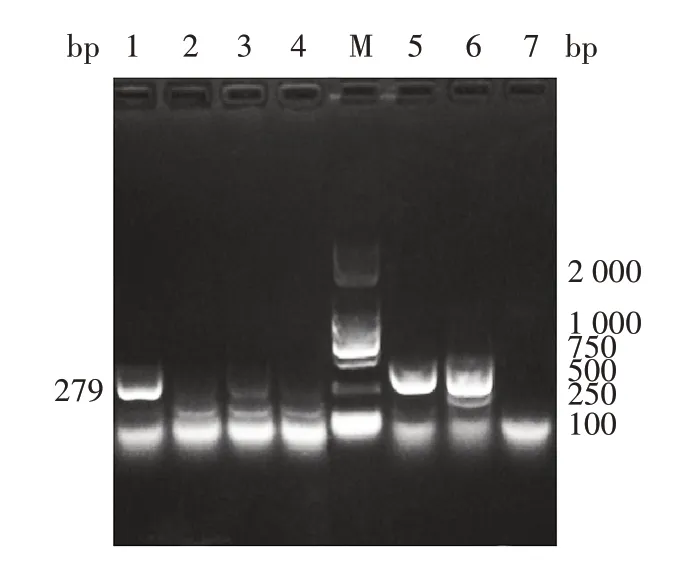
图1 HuSaV感染的HuTu-80的PCR产物电泳图Fig.1 Electrophoretic profile of PCR product of HuTu-80 infected by HuSaV
2.2 GⅠ.1型HuSaV 在HuTu-80细胞中的生长动力学分析 GⅠ.1 型HuSaV 感染HuTu-80 细胞并添加GCA后,病毒滴度从感染后1 d的2 log10拷贝/140 μL快速增加至3 d 的4.1 log10拷贝/140 μL,5 d 时达病毒增殖平台期(约4.5 log10拷贝/140 μL),见图2。表明GⅠ.1 型HuSaV 感染HuTu80 细胞后可显著增殖。

图2 GⅠ.1型HuSaV在HuTu-80细胞中的生长动力学Fig.2 Growth kinetics of HuSaV GI.1 in HuTu-80 cells
2.3 不同代次GⅠ.1型HuSaV对HuTu-80细胞的感染性 RT-qPCR 结果显示,P1、P2、P3 代次GⅠ.1 型HuSaV 均可感染HuTu-80 细胞,且各代次病毒感染后3、5 d 与1 d 相比,RNA 拷贝数均显著上升(P1:F= 143.5,P<0.000 1;P2:F= 41.04,P= 0.000 3;P3:F= 124.3,P<0.000 1),见图3。表明GⅠ.1 型HuSaV在HuTu-80细胞中能稳定连续传3代次。
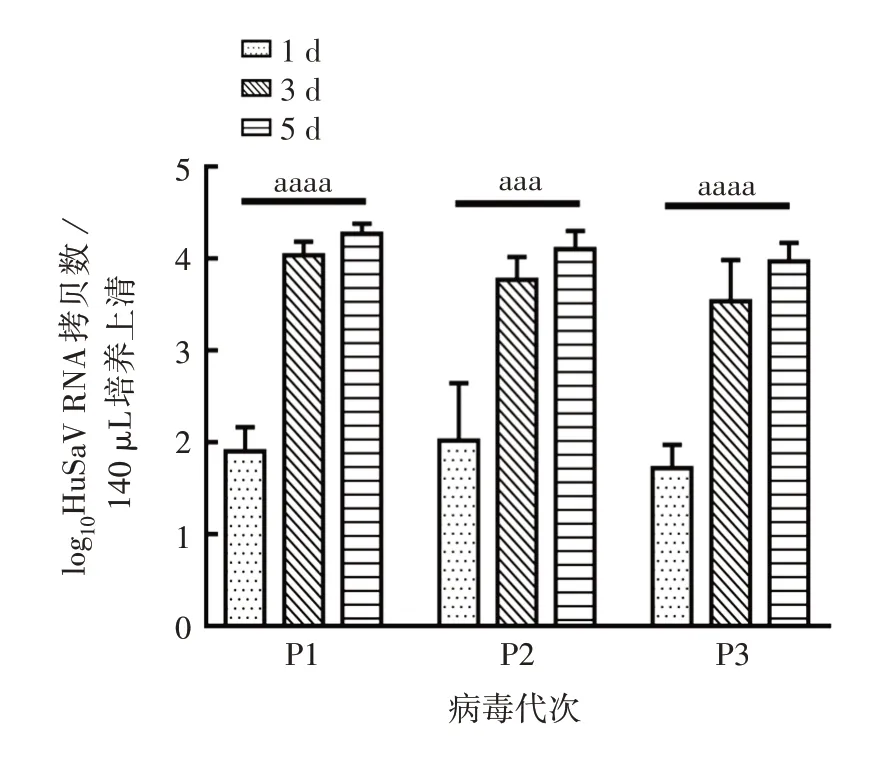
图3 不同代次GⅠ.1型HuSaV感染性的鉴定Fig.3 Identification of infectivity of different passages of HuSaV GⅠ.1
2.4VP1基因扩增产物的鉴定VP1基因扩增产物经1.5%琼脂糖凝胶电泳分析,可见1 686 bp 的特异性片段,大小与预期一致,见图4。
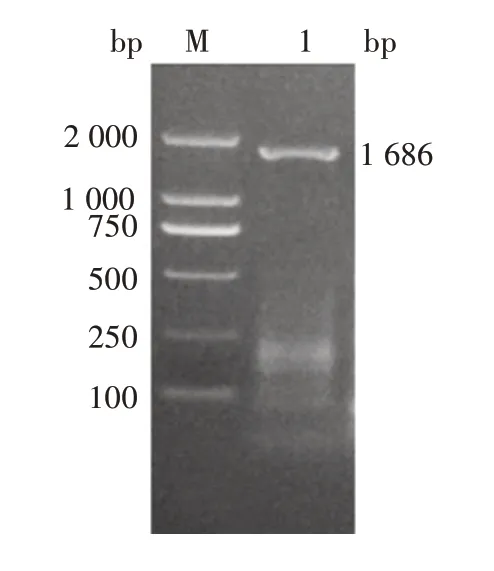
图4 VP1基因PCR扩增产物电泳图Fig.4 Electrophoretic profile of PCR product of VP1 gene
2.5 重组表达质粒的鉴定 1.5%琼脂糖凝胶电泳分析显示,重组表达质粒pGEX-GⅠ.1-VP1经BamHⅠ和SalⅠ双酶切,可见4 984 bp的载体片段和1 686 bp的目的基因片段,大小均与预期一致,见图5。测序结果表明,重组表达质粒构建正确。
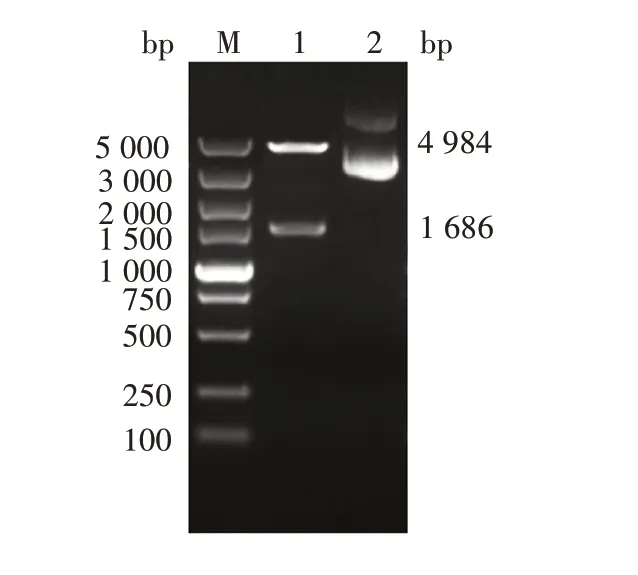
图5 重组表达质粒pGEX-GⅠ.1-VP1的双酶切(BamHⅠ/SalⅠ)鉴定Fig.5 Restriction map of recombinant expression plasmid pGEX-GⅠ.1-VP1(BamHⅠ/SalⅠ)
2.6 表达及纯化产物的鉴定 12%SDS-PAGE分析显示,表达的重组GST-VP1蛋白相对分子质量约86 000,纯化后约60 000(切除GST 标签),经薄层扫描分析,纯化蛋白与重组蛋白约占总蛋白的70%和35%;而诱导的空质粒pGEX-6P-1 可见相对分子质量约26 000的GST条带。见图6。
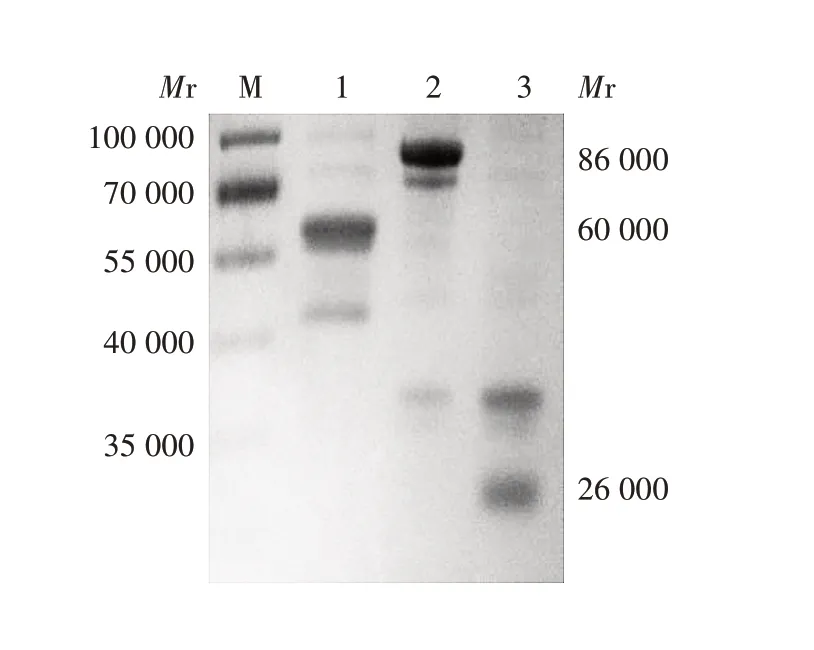
图6 表达及纯化产物的SDS-PAGE分析Fig.6 SDS-PAGE analysis of expressed and purified products
2.7 兔血清效价 ELISA 检测结果显示,制备的抗HuSaV VP1 蛋白多克隆抗体效价可达1∶12 800 以上,见图7。
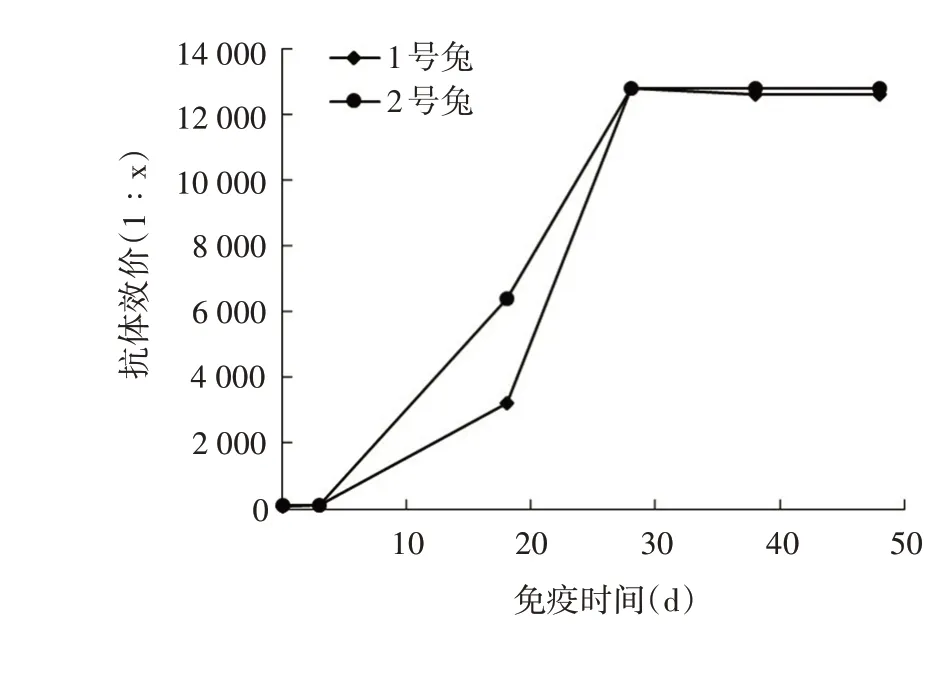
图7 2只兔的抗血清效价测定Fig.7 Determination of antiserum titers of two rabbits
3 讨论
SaV被分为5个基因群(GⅠ~GⅤ),其中GⅠ、GⅡ、GⅣ、GⅤSaV 是引起人群急性胃肠炎散发和暴发的主要原因之一,常在托儿所、护理中心、学校、军事机构、医院等人口密集场所暴发群体性或散发感染,给人类带来一定的疾病负担[1,17-19]。SaV 与诺如病毒一样,进化速率较快,基因重组和氨基酸位点突变的积累均可扩大病毒的多样性,并进化出新的变异毒株。在世界范围内,GⅠ和GⅡ是主要的流行毒株,但近年来从患有严重胃肠炎儿童体内分离出另一种新的重组GⅡ.NA 型HuSaV[6,8,20]。目前全球尚无特异性药物或疫苗用于治疗和预防HuSaV感染。
HuSaV 的体外分离培养是研究其感染及致病机制的前提。研究者一直尝试用多种原代细胞和永生化细胞培养HuSaV,但均未获得成功。近年,HuSaV的体外培养取得了突破性进展,研究显示,HuSaV 可在添加胆酸盐(GCA 或GCDCA)的HuTu-80 细胞中复制及增殖[16]。因此,本研究以GⅠ.1 型HuSaV 为研究对象,将其接种添加GCDCA 或GCA 的HuTu-80细胞,结果显示,GCA 能够有效促进HuSaV 对HuTu-80细胞的感染及增殖,但GCDCA 未如上述文献报道促进HuSaV 的感染,分析原因可能国内GⅠ.1 型HuSaV 与国外毒株对胆酸盐的敏感性存在一定差异。相关研究显示,胆汁或胆酸盐的淤积能引起免疫功能障碍,并干扰内源性干扰素活性[21-22]。干扰素自1956 年发现以来,一直被认为是抵抗病毒天然免疫的关键成分[23-24]。推测这可能是GCA促使HuSaV在HuTu-80 细胞中增殖的原因。此外,本实验结果显示,随着病毒感染代次增加,其增殖能力有衰减趋势,分析可能该毒株对HuTu-80 细胞感染适应性并不十分理想,后续会进一步重复连续传代观察,以确证该毒株在体外是否具有稳定传代能力,为研究其感染及暴发流行机制等提供数据支持。近年来,实验室对SaV 的诊断及流行检测除电镜观察其形态外,最常用的方法是ELISA 和RT-PCR[25-26]。而SaV VP1 蛋白属于衣壳蛋白,是完整病毒的主要组成部分[4]。因此,本研究用VP1 蛋白免疫动物获得多克隆抗体也将为HuSaV的鉴定提供新方法。

