一种新型冠状病毒核酸检测试剂在4个检测体系中的检出限分析
曾艳芬 吴泉明 周 欢 张秋琴 康艳丽 李 瑶 陈喜军 黄建刚 陈发林
(1.福建省立医院福建省临床检验中心,福建 福州 350001;2.福建省立医院检验科,福建 福州 350001)
新型冠状病毒感染是引发新型冠状病毒肺炎的病原体[1],新型冠状病毒核酸检测是确定新型冠状病毒感染的金标准。在实验室进行新型冠状病毒核酸检测的过程中,存在试剂优化不充分、批间差异大,以及结果假阴性等问题[2]。关于结果假阴性问题,除受检测试剂的灵敏度和检测体系的性能影响外,试剂的检出限至关重要。《医疗机构新型冠状病毒核酸检测工作手册(试行第二版)》[3]要求选择国家药品监督管理部门批准的试剂,并在选择标本采样管和核酸提取试剂时,使用试剂盒说明书建议的配套标本采样管和提取试剂;在用于临床标本检测前,实验室应对由提取试剂、提取仪和扩增试剂、扩增仪等组成的检测系统进行性能验证。但在实际工作中,多数实验室的检测体系均为非配套体系。本研究对上海之江生物科技股份有限公司新型冠状病毒核酸检测试剂的检出限(200 拷贝/mL)在不同检测体系中的性能进行验证,以帮助实验室提升新型冠状病毒核酸检测质量。
1 材料和方法
1.1 标准物质和检测体系
标准物质为中国计量科学研究院新型冠状病毒全序列假病毒核糖核酸标准物质(编号为NIM-RM5207,批号2102),具体赋值见表1。选择4个检测体系,均为自动提取仪(磁珠法)提取后进行逆转录荧光定量聚合酶链反应扩增的方法,其中体系1为配套体系,体系2、3、4为非配套体系,4个体系扩增试剂均为同一品牌产品,各体系中的仪器、试剂均取得国家药品监督管理局注册证。

表1 新型冠状病毒全序列假病毒核糖核酸标准物质赋值
1.2 方法
1.2.1 检出限验证
用中国计量科学研究院新型冠状病毒全序列假病毒核糖核酸标准物质对4个检测体系进行检出限的性能验证。由于所用标准物质ORF1ab基因、N基因、E基因的浓度赋值不同,因此对3个基因分别进行验证。验证方法:分别使用各检测体系病毒采样管的保存液梯度稀释标准物质(以标准值计算)到试剂盒说明书标注的检出限(200 拷贝/mL),每批重复测定5次,记录检测结果的阳性数,以100%检出为验证通过。
1.2.2 重新验证
考虑到标准物质赋值存在不确定度,按照标准值与不确定度的差值重新稀释后进行验证,方法和判断标准同检出限的验证。观察2次验证均未通过的体系,修改提取程序,再次验证。第1次和第2次验证实验使用优化的核酸提取试剂,提取程序(提取程序1)见表2;第3次验证实验使用优化前的核酸提取试剂,提取程序(提取程序2)见表3;第4次验证实验将步骤2作用时间改为15 min,其他步骤同提取程序1;第5次验证实验提前预热仪器至70 ℃,确保步骤2的作用时间达4 min,步骤3重复3次,其他步骤同提取程序1。实验方法和判断标准同检出限的验证。

表2 提取程序1步骤
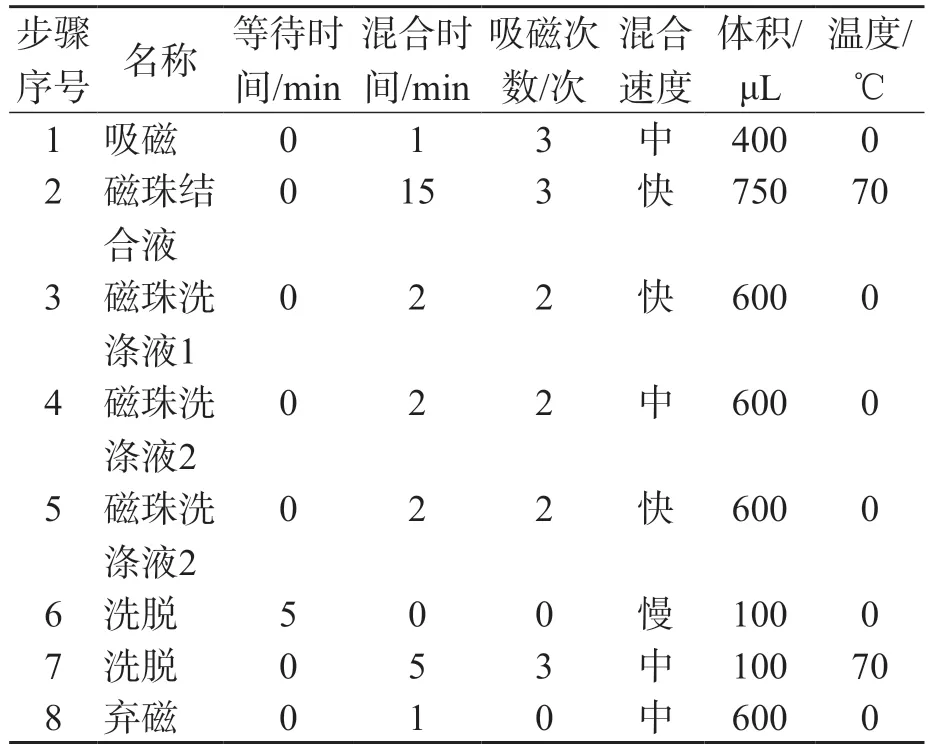
表3 提取程序2步骤
2 结果
2.1 检出限验证结果
4个检测体系检出限验证结果显示,非配套体系1通过验证,配套体系和非配套体系2、3均未通过。见表4、图1。
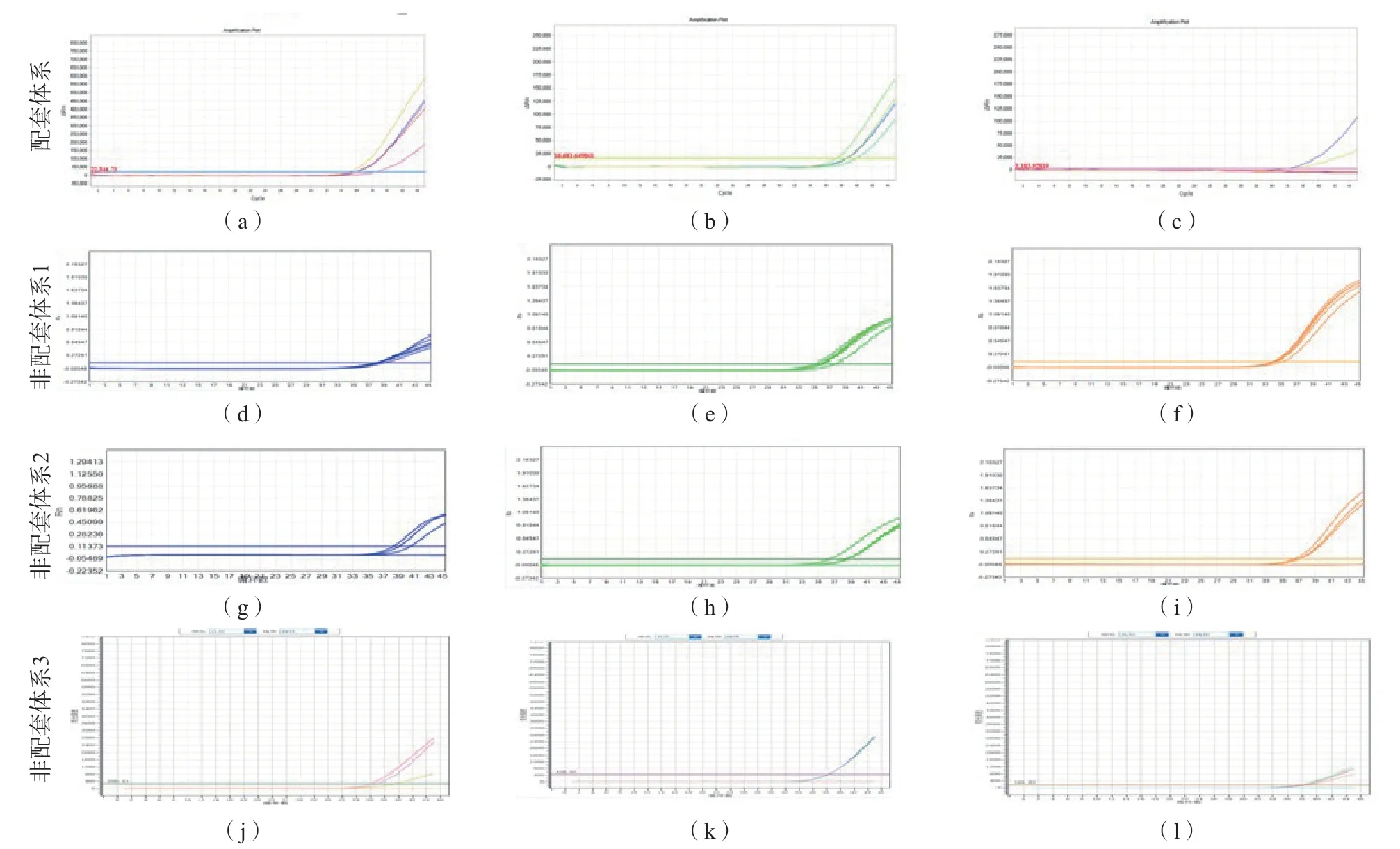
图1 4个检测体系标准值稀释检出限验证结果扩增曲线
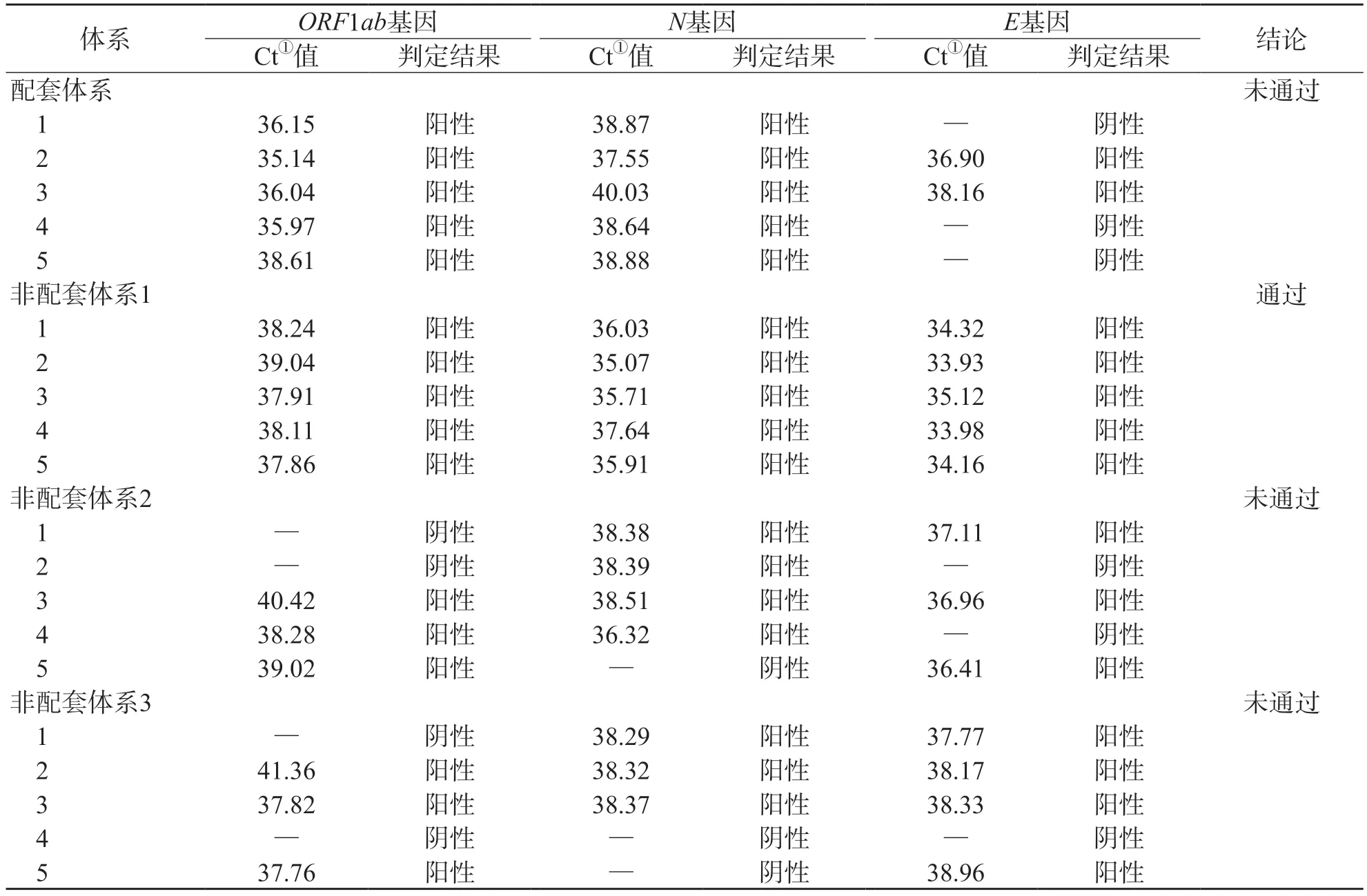
表4 4个检测体系标准值稀释检出限验证结果
2.2 重新验证结果
2.2.1 第2次验证实验结果
未通过验证的3个检测体系以中国计量科学研究院新型冠状病毒全序列假病毒核糖核酸标准物质标准值与不确定度的差值稀释验证检出限,结果显示,配套体系和非配套体系2通过验证,非配套体系3未通过。见表5、图2。

图2 3个检测体系以标准值与不确定度差值稀释检出限验证结果扩增曲线图
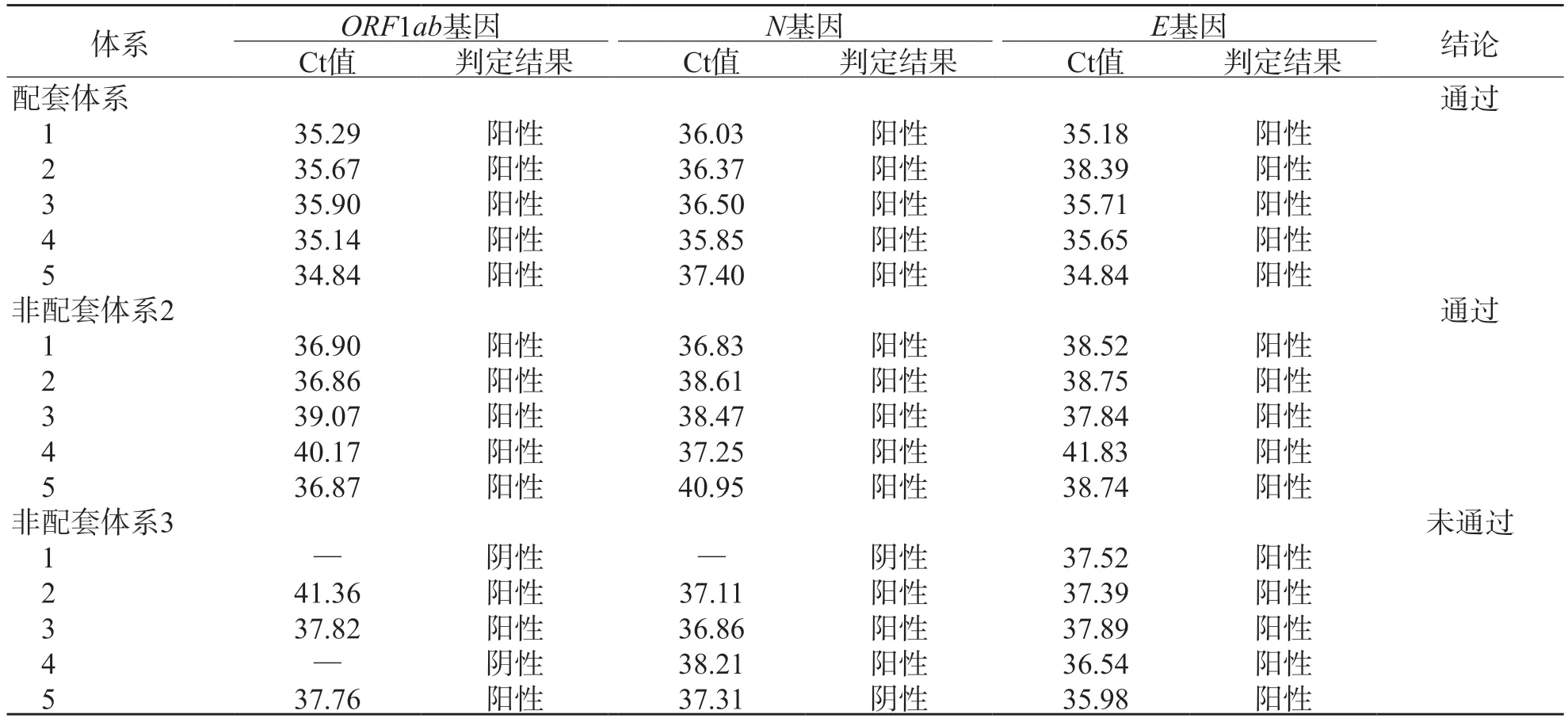
表5 3个检测体系以标准值与不确定度差值稀释检出限验证结果
2.2.2 第3次验证实验结果
以中国计量科学研究院新型冠状病毒全序列假病毒核糖核酸标准物质的标准值与不确定度的差值稀释验证非配套体系3检出限,结果显示,使用提取程序2的第3次验证实验通过;更改提取程序的第4次、第5次实验均未通过。见表6、图3。
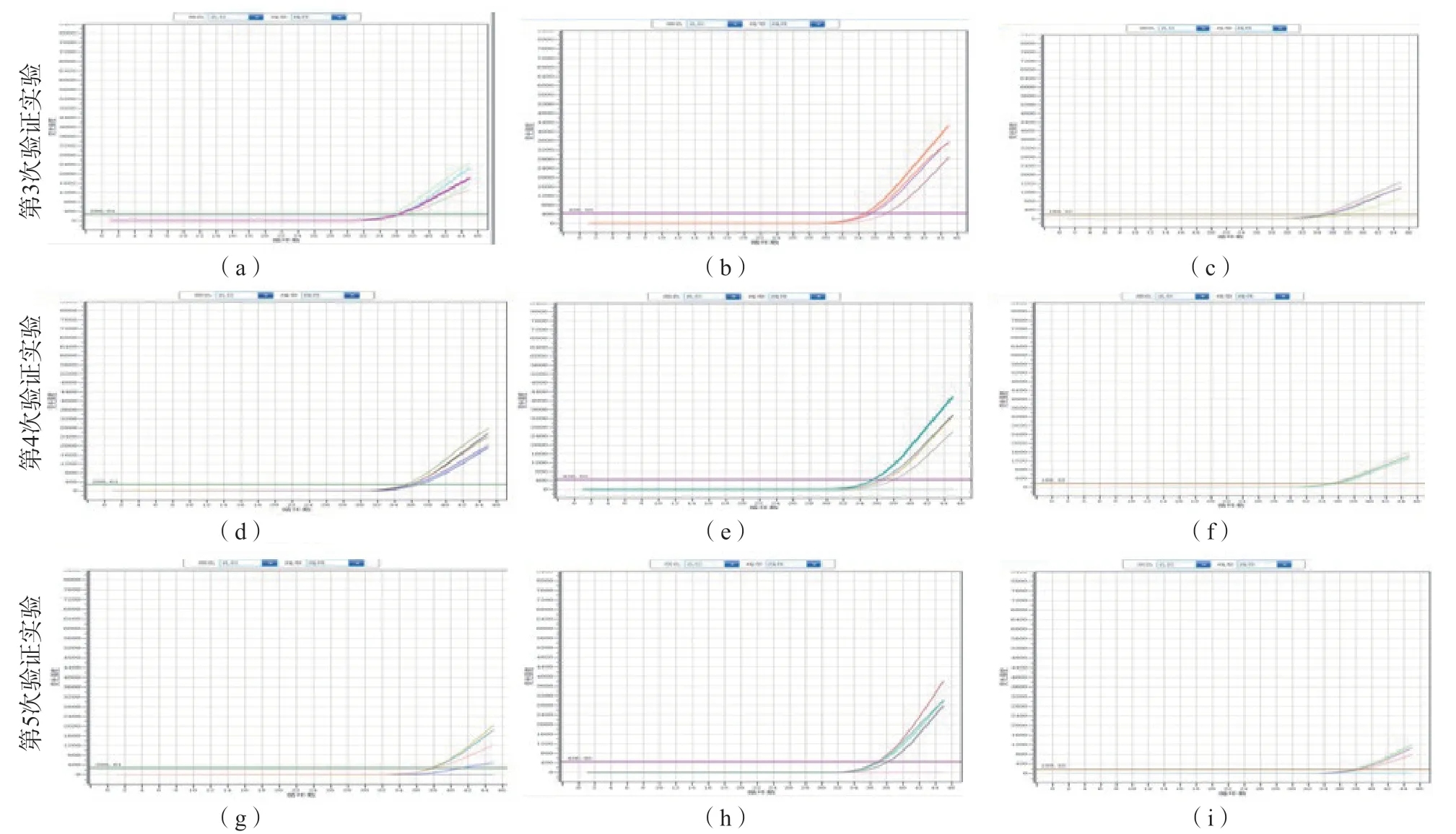
图3 非配套体系3以标准值与不确定度的差值稀释和更改提取程序后检出限验证结果扩增曲线

表6 非配套体系3以标准值与不确定度的差值稀释和更改提取程序后检出限验证结果

表6(续)
3 讨论
新型冠状病毒核酸检测是疫情防控的关键,检测试剂的检出限能否在相应的检测体系复现是控制假阴性结果的重要指标。目前,我国新型冠状病毒核酸检测实验室所用检测体系多为非配套体系,且各实验室均存在多个非配套体系共用的情况。为了解配套与非配套检测体系检测性能的差异及其实际检出能力,本研究选择上海之江生物科技股份有限公司新型冠状病毒核酸检测试剂,依据说明书对1个配套体系和3个非配套体系的检出限进行性能验证。
本研究结果显示,不同检测体系检测性能存在差异,对检测结果,特别是低浓度样本的检测结果影响较大;4个检测体系中,检出能力最强的是非配套体系1,其次为配套体系和非配套体系2。配套体系检出能力较非配套检测体系差的原因可能为:1)新型冠状病毒核酸检测试剂审批的过程中,由于没有充足的临床样本和体系性能确认时间,且早期国家标准物质为纯化后新型冠状病毒核酸体外转录RNA,不能反映核酸提取效率,造成配套体系构建不完整;2)新型冠状病毒核酸检测需求不断加大,可能导致试剂生产所用原料、耗材和工艺发生改变,批间差异大;3)试剂生产厂商在构建体系时无法对所有的仪器设备组合进行性能确认,存在未进行确认的设备组合性能更佳的可能。
比较本研究非配套体系3的2种提取程序,主要区别是步骤2由15 min降至4 min;步骤3由3次减至1次。步骤2主要完成细胞裂解、核酸释放并结合至磁珠的过程,本研究提取程序1从步骤1到步骤2,仪器从室温升至70 ℃需2~3 min,步骤2真正的作用时间只有1~2 min,导致细胞裂解不全、核酸释放及磁珠结合不充分,降低了提取效率。查阅仪器说明书,发现并未对升降温速度进行规定,而本研究发现,作用时间越短,升降温的速率对实际作用时间造成的影响就越大。我们未查阅到核酸提取仪相关参数的生产标准,且2021年实施的《(自动)核酸提取仪校准规范》(JJF 1874—2020)[4]亦仅对温度示值误差、均匀性、稳定性进行规定,未提及升降温的速率,因此迫切需要相关部门出台相关标准,规范核酸提取操作细节,指导实验室和试剂生产厂商日常工作,保证核酸检测的质量。步骤3是洗涤的过程,通常需使用不同的洗涤液洗涤2~4次,分别去除无机盐离子和蛋白、脂类等抑制物,达到纯化的目的[5],仅使用1种洗涤液洗涤1次,存在洗涤不充分、干扰物质残留导致提取效率降低和抑制后续扩增的可能。在疫情暴发流行期间,新型冠状病毒核酸检测样本量大,要求出报告时间短,为加快速度,实验室一般会通过减少裂解时间、洗涤或磁吸次数等方法缩短提取时间,通过减少逆转录和各个循环的时间,或添加加速剂等方法缩短扩增时间,给检测体系的性能造成负面的影响,而检出限本身就处于试剂分析敏感性的极限,任何环节的变化都可能对其产生较大的影响,因此实验室不可为了缩短出报告时间,突破速度与质量的平衡点,以牺牲质量为代价换取速度的提升。
本研究比较了4个体系的加样量,发现配套体系和非配套体系1、2的加样量均为300 μL,非配套体系3的加样量为200 μL,非配套体系3加样量低于其他3个体系也可能是其第1、2次验证未能通过的原因之一,因此实验室在选择提取试剂时应考虑起始加样量对检测性能的影响。非配套检测体系变量多,每个环节都会影响检出限,实验室在应用非配套检测体系之前,必须进行性能验证,如未能通过,建议逐一梳理各个环节,如更换采样管、更换提取试剂或优化提取程序、优化扩增程序,探索最佳检测体系,保证检验质量。另外,本研究性能验证是在对所选检测体系中的仪器设备进行维护保养、校准后进行的,但实际工作中,新型冠状病毒核酸检测实验室日常工作量非常大,可能存在仪器设备长时间疲劳运转而影响检测性能的情况,提示实验室工作越是繁重,越要关注仪器设备的运行状态,加强日常维护保养和校准。
综上所述,本研究选择的新型冠状病毒核酸检测试剂在4个检测体系中的检出限验证均能通过,但存在非配套检测体系性能优于配套体系的情况。缩短细胞裂解和核酸释放与磁珠结合时间,减少核酸洗涤次数会影响试剂检出限,实验室不可为追求速度轻易更换检测体系中的任一环节。相关机构应建立覆盖核酸检测全流程相关仪器设备生产校准标准,规范核酸检测操作,指导实验室和厂商日常工作。同时,实验室应关注加样量、非配套体系的优化和仪器设备的维护、保养、校准,保证检验质量。

