安罗替尼联合白蛋白结合型紫杉醇治疗晚期肺癌的真实世界研究△
丁佩,徐婪,陈州华
湘潭市第二人民医院肿瘤科,湖南湘潭 411100
肺癌是世界范围内最常见的恶性肿瘤。据统计,2020年全球新发恶性肿瘤中肺癌仅次于乳腺癌,居第二位,占比11.4%,死亡人数肺癌居首位,占比18.0%[1]。在中国所有恶性肿瘤中,肺癌发病率和病死率均居首位,严重威胁中国居民的生命健康[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占全部肺癌的80%~85%,小细胞肺癌(small cell lung cancer,SCLC)占全部肺癌的15%~20%,约57%的肺癌患者确诊时已为进展期(ⅢB或Ⅳ期)[3]。大部分肺癌患者经一线治疗后会出现病情进展,此时患者需进行二线及以上治疗。安罗替尼是中国研发的具有自主知识产权的创新药物,是一种新型小分子多靶点酪氨酸激酶抑制剂,可阻断血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)及成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)信号通路,从而发挥抗肿瘤新生血管生成和抑制肿瘤生长的作用[4]。白蛋白结合型紫杉醇是一种与白蛋白结合的新型紫杉醇制剂,与相同剂量的紫杉醇溶液相比,前者在肿瘤组织中的浓度较高,临床实践显示其具有良好的治疗效果和较小的不良反应[5]。本研究通过真实世界回顾性研究分析安罗替尼联合白蛋白结合型紫杉醇治疗晚期肺癌患者的有效性和安全性,旨在为晚期肺癌的治疗提供一定的参考依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年7月至2020年7月湘潭市第二人民医院收治的晚期肺癌患者。纳入标准:经病理学或细胞学检查确诊为肺癌,临床分期为ⅢC~Ⅳ期;至少经过一线治疗后进展;至少有一个可测量病灶;接受安罗替尼联合白蛋白结合型紫杉醇治疗。排除标准:合并其他恶性肿瘤;临床资料不完整。依据纳入和排除标准,本研究共纳入34 例晚期肺癌患者,其中,男18 例,女16 例;年龄48~74岁,平均(64.62±6.84)岁;有吸烟史15 例;合并慢性疾病11 例,包括2 型糖尿病、高血压、冠状动脉硬化性心脏病等;有肝炎病史4 例,包括乙型肝炎、丙型肝炎。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 治疗方法
所有患者均予以盐酸安罗替尼治疗,每次12 mg,每天1 次,晨起空腹口服,连服14 天,休息7 天;将260 mg/m2白蛋白结合型紫杉醇加入100 ml 0.9%生理盐水中,静脉滴注30 min,21 天为1 个周期。持续用药至病情进展或患者不耐受。治疗过程中,若出现3 级及以上不良反应,予以调整剂量、对症治疗等处理。
1.3 观察指标及评价标准
参考实体瘤疗效评价标准(response evaluation criteria in solid tumour,RECIST)1.1 版[6]评估患者的近期疗效。完全缓解(complete response,CR):所有肿瘤病灶均消失,至少维持4 周;部分缓解(partial response,PR):肿瘤病灶长径总和与基线相比缩小≥30%,至少维持4 周;疾病稳定(stable disease,SD):肿瘤病灶长径总和与基线相比缩小<30%或增大<20%;疾病进展(progression disease,PD):肿瘤病灶长径总和与基线相比增大≥20%,或出现新病灶。客观缓解率(objective response rate,ORR)=(CR+PR)例数/可评价病例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/可评价病例数×100%。无进展生存期(progression-free survival,PFS)是指患者从治疗开始至PD 或死亡的时间,总生存期(overall survival,OS)是指患者从治疗开始至死亡的时间或随访截止时间。采用电话及门诊随访的方式对所有患者进行随访,随访时间截至2022年4月30日。记录患者的一般情况、近期疗效、PFS、OS 及不良反应发生情况。
1.4 不良反应评价
采用美国国立癌症研究所不良反应事件通用术语标准(National Cancer Institute common toxicity criteria,NCI-CTC)5.0 版[7]评价患者的不良反应,分为1~4 级。治疗期间每周复查血常规、肝肾功能、尿常规。
1.5 统计学方法
采用SPSS 25.0 软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier 法绘制生存曲线。以P<0.05 为差异有统计学意义。
2 结果
2.1 近期疗效的比较
34 例晚期肺癌患者均可评价疗效,共化疗132个周期,其中10 例患者化疗2 个周期,16 例患者化疗4 个周期,8 例患者化疗6 个周期。CR 0 例(0%),PR 10 例(29.41%),SD 10 例(29.41%),PD 14 例(41.18%),ORR 为29.41%(10/34),DCR 为58.82%(20/34)。不同性别、年龄、吸烟史、病理类型、既往紫杉类药物化疗情况及既往抗血管生成治疗情况的晚期肺癌患者的ORR 比较,差异均无统计学意义(P>0.05);ⅢC 期、安罗替尼二线治疗的晚期肺癌患者的ORR 分别高于Ⅳ期、安罗替尼三线及以上治疗的患者,差异均有统计学意义(χ2=5.480、4.439,P<0.05)。不同性别、年龄、吸烟史、既往紫杉类药物化疗情况及既往抗血管生成治疗情况的晚期肺癌患者的DCR 比较,差异均无统计学意义(P>0.05);腺癌、ⅢC 期、安罗替尼二线治疗的晚期肺癌患者的DCR 分别高于非腺癌、Ⅳ期、安罗替尼三线及以上治疗的患者,差异均有统计学意义(χ2=5.343、3.528、4.648,P<0.05)。(表1)
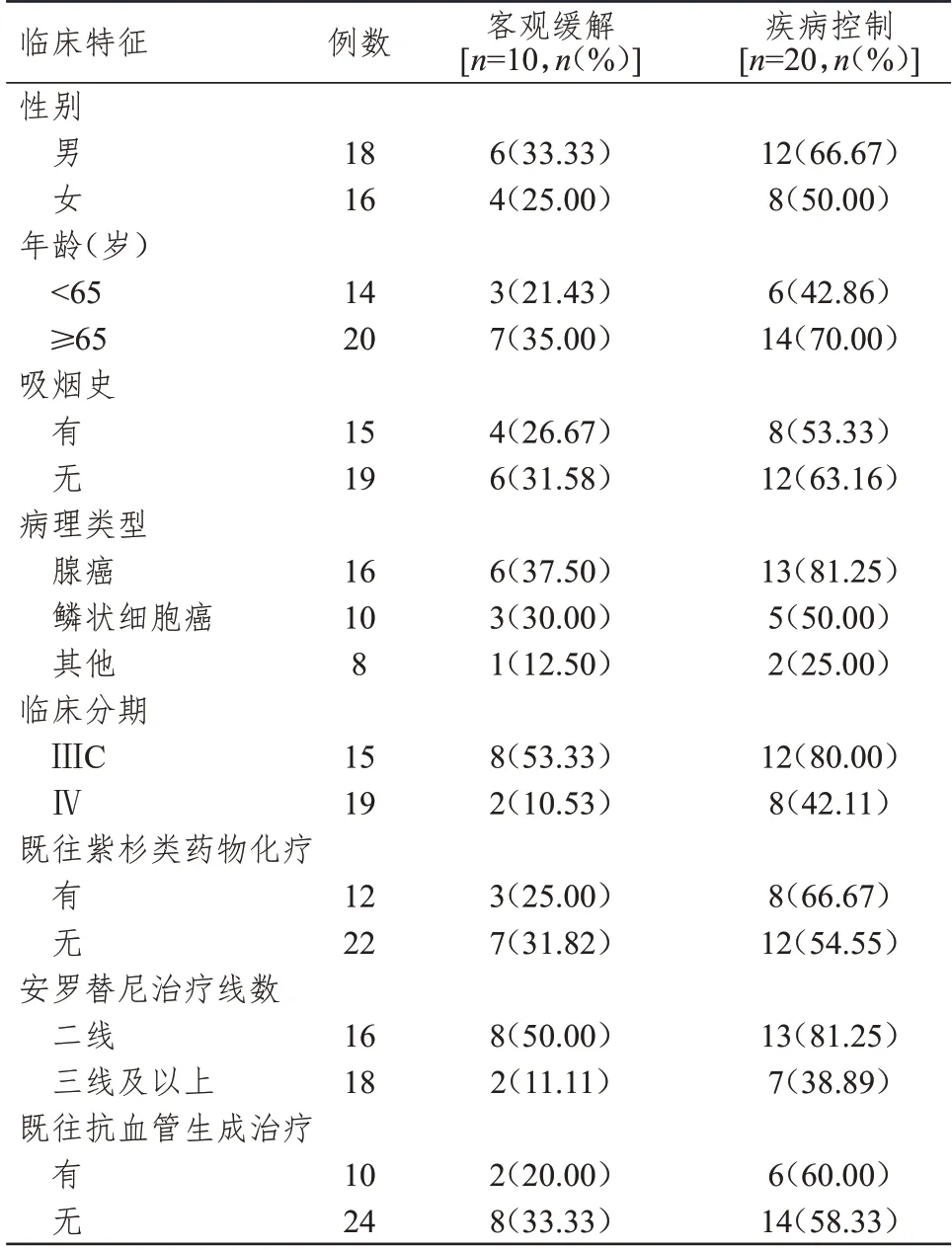
表1 不同临床特征晚期肺癌患者的近期疗效
2.2 生存情况
截至2022年4月30日,2 例患者生存,32 例患者死亡,中位PFS 为6.0 个月(95%CI:5.4~6.6 个月),中位OS 为11.9 个月(95%CI:10.8~12.9 个月)。(图1、图2)
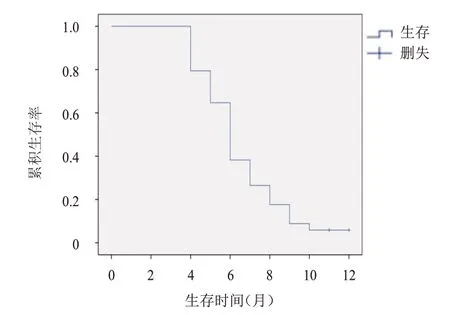
图1 34例晚期肺癌患者的PFS曲线
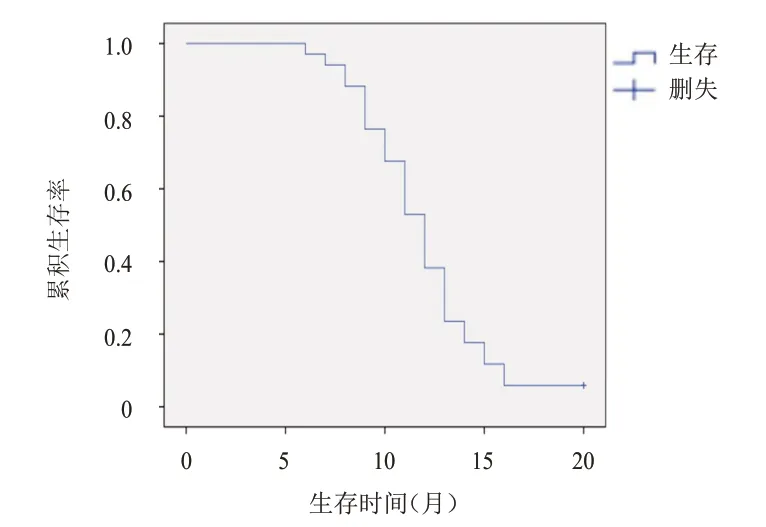
图2 34例晚期肺癌患者的OS曲线
2.3 不良反应
34 例患者治疗过程中的不良反应多为1~2 级,以中性粒细胞减少、乏力、脱发、贫血、周围神经病变和高血压为主,予以对症处理后均缓解,而腹泻、皮疹和蛋白尿发生率较低。3 级不良反应中,中性粒细胞减少4 例,乏力4 例,脱发、贫血、周围神经病变和高血压各2 例,血小板减少、恶心呕吐和肌肉疼痛各1 例。无4 级不良反应发生。(表2)
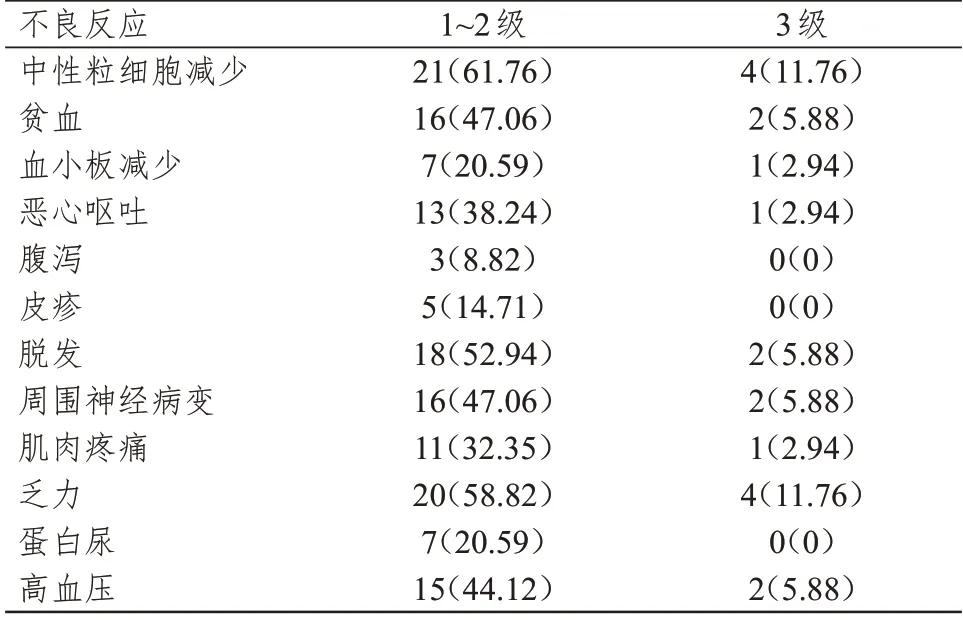
表2 34 例肺癌患者的不良反应发生情况[n(%)]
3 讨论
肺癌已成为全球范围内恶性肿瘤死亡的重要原因,2020年全球肺癌新发病例220 万例,居全部恶性肿瘤第二位,全球肺癌死亡病例180 万例,居全部恶性肿瘤第一位[8]。目前,对于无驱动基因突变或靶向药物治疗继发性耐药的NSCLC,化疗仍是首选治疗方法,一线标准化疗方案为含铂双药方案,如培美曲塞、紫杉醇、吉西他滨联合铂类,二线或以上化疗以多西他赛单药为主。对于广泛期SCLC,化疗是唯一有效的治疗手段,一线化疗以依托泊苷、伊立替康联合铂类为主,二线化疗可采用拓扑替康,也可选择紫杉类,三线及以上化疗优选参加临床试验,无标准治疗方案。
肿瘤生长和转移主要是通过新生血管生成而实现的,因此抑制肿瘤新生血管生成是抑制肿瘤生长和转移的新型治疗方法[9],已经成为目前肿瘤治疗领域的研究热点。盐酸安罗替尼是中国研发的具有自主知识产权的创新药物,是一种新型小分子多靶点酪氨酸激酶抑制剂,可强效抑制VEGFR1、
VEGFR2、VEGFR3、PDGFRα、PDGFRβ、FGFR1、FGFR2、FGFR3、FGFR4 和c-Kit 等多个靶点,阻断其下游信号转导,从而发挥抗肿瘤新生血管生成和抑制肿瘤生长的作用[10]。
ALTER0303 研究纳入439 例晚期复发或转移性NSCLC 患者,发现与服用安慰剂相比,接受安罗替尼治疗可明显延长患者的中位PFS(5.4 个月vs1.4 个月)和中位OS(11.2 个月vs6.3 个月)[11]。在ALTER0303 试验的基础上进行亚组分析,无论既往使用何种表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)和化疗,安罗替尼组均获得更长的PFS;既往接受贝伐珠单抗或内皮细胞抑制素治疗对安罗替尼的疗效没有影响[12],与本研究结果一致。本研究既往使用过抗血管生成治疗的患者应用安罗替尼仍可获益,ORR 为20.00%,DCR 为60.00%。不仅如此,安罗替尼还可克服表皮生长因子受体(epidermal growth factor receptor,EGFR)突变晚期NSCLC患者对EGFR-TKI的获得性耐药[13]。
2018年12月24日,国家药品监督管理局(National Medical Products Administration,NMPA)批准安罗替尼第三个新适应证SCLC。一项随机、双盲、多中心研究纳入合并胸腔积液的SCLC 患者,发现安罗替尼组对比安慰剂组可将PFS 延长0.7 个月[14]。二线或后线治疗的SCLC 患者采用安罗替尼单药治疗或联合治疗,中位PFS 为2.1 个月,中位OS 为7.2 个月,ORR 和DCR 分别为10.3%和48.3%,联合其他疗法增加了疗效而不增加不良反应[15],与本研究结果一致。本研究显示,采用安罗替尼联合白蛋白结合型紫杉醇治疗晚期肺癌的ORR 为29.41%,DCR 为58.82%,且不良反应可控。
对于多数晚期肺癌患者,全身化疗仍是主要的治疗手段之一。新型化疗药物的出现使晚期肺癌的化疗方案有更多的选择。白蛋白结合型紫杉醇是一种与白蛋白结合的新型紫杉醇制剂,与相同剂量的紫杉醇溶液相比,其在肿瘤组织中的浓度较高,是一种无需溶剂的紫杉类化疗药物,无需预处理[5]。一项纳入13 项高质量研究共4613 例NSCLC 患者的Meta 分析显示,白蛋白结合型紫杉醇显著提高了总缓解率,延长了PFS 和OS,不良反应主要表现为血液学毒性、感觉神经病变和关节痛,且不良反应可控[16]。本研究中脱发和周围神经病变考虑为白蛋白结合型紫杉醇的非血液学毒性。即使是使用过紫杉醇或多西他赛化疗的患者,继续使用白蛋白结合型紫杉醇化疗仍能获得较好的疗效,提示对紫杉类化疗失败的肺癌患者,白蛋白结合型紫杉醇仍可获益[17],与本研究结果一致。本研究既往使用过紫杉类药物治疗的患者应用白蛋白结合型紫杉醇仍可获益,ORR 为25.00%,DCR 为66.67%。有研究显示,具有基础疾病的老年不可切除局部晚期NSCLC 患者使用白蛋白结合型紫杉醇未出现严重不良反应,耐受性好,有突出优势[18]。亚组分析显示,对于铂类化疗后出现PD的老年晚期NSCLC 患者,使用白蛋白结合型紫杉醇治疗后缓解率为15.8%,中位PFS 为4.2 个月,中位OS 为13.6 个月[19]。白蛋白结合型紫杉醇不仅在晚期NSCLC 患者中表现出良好的效果,而且在手术完全切除的ⅠB、Ⅱ或Ⅲ期NSCLC 中也表现出相对低毒性及辅助用药的可行性[20]。
2012年10月美国食品药品管理局(FDA)批准白蛋白结合型紫杉醇用于一线治疗局部进展或转移性的无手术及放疗指征的晚期NSCLC。同样,在SCLC 患者中以白蛋白结合型紫杉醇为基础的化疗方案表现出了较好的临床疗效及较轻的不良反应,有研究显示,白蛋白结合型紫杉醇治疗复发性SCLC 患者的ORR 为24%,DCR 为48%,中位PFS 为5.4 个月[21]。
虽然单个药物的应用能够提高总有效率和生活质量,但临床上对于一线二线治疗失败的患者,往往三线治疗的有效率更低。随着国内外化疗药物联合靶向药物、免疫抑制剂、抗血管生成药物的不断研发,结合白蛋白结合型紫杉醇高效低毒的优点,其可应用于晚期肺癌患者的多线治疗,抗血管生成药物联合化疗药物有望提高疗效,是目前研究的热点之一。目前,突破晚期肺癌二线及以上治疗的瓶颈是多国学者的研究热点,联合治疗方案使治疗效果提升成为可能,可成为一种新的标准治疗方法。
有研究显示,对一线治疗不可切除或转移性胰腺癌患者,采用安罗替尼联合白蛋白结合型紫杉醇/吉西他滨对比单纯化疗,可延长患者的中位PFS(5.0 个月vs2.7 个月)和中位OS(9.0 个月vs6.0个月)[22]。有研究应用白蛋白结合型紫杉醇联合贝伐珠单抗治疗至少一种既往全身性治疗方案失败的晚期非鳞NSCLC 患者,ORR 和DCR 分别为26.5%(9/34)和82.4%(28/34),中位PFS 和OS 分别为6.0 个月(95%CI:2.9~7.2 个月)和11.0 个月(95%CI:7.8~18.7 个月)[23]。那么高效、低毒、使用方便的新型抗肿瘤血管生成药物安罗替尼联合白蛋白结合型紫杉醇的化疗效果如何?本研究回顾性分析真实世界中安罗替尼联合白蛋白结合型紫杉醇治疗的晚期肺癌患者的基本特征、治疗方案、临床疗效及不良反应等临床资料,旨在评估真实世界中安罗替尼联合白蛋白结合型紫杉醇在晚期肺癌中的有效性和安全性,并探索近期疗效与临床特征的关系。
本研究纳入34 例一线治疗后的晚期肺癌患者,ORR 和DCR 分别为29.41%(10/34)和58.82%(20/34)。截至末次随访时间2022年4月30日,34例患者的中位PFS 为6.0 个月(95%CI:5.4~6.6 个月),中位OS 为11.9 个月(95%CI:10.8~12.9 个月)。进一步分析显示,不同性别、年龄、吸烟史、病理类型、既往紫杉类药物化疗情况及既往抗血管生成治疗情况的晚期肺癌患者的ORR 比较,差异均无统计学意义(P>0.05);ⅢC 期、安罗替尼二线治疗的晚期肺癌患者的ORR分别高于Ⅳ期、安罗替尼三线及以上治疗的患者,差异均有统计学意义(P<0.05)。不同性别、年龄、吸烟史、既往紫杉类药物化疗情况及既往抗血管生成治疗情况的晚期肺癌患者的DCR 比较,差异均无统计学意义(P>0.05);腺癌、ⅢC 期、安罗替尼二线治疗的晚期肺癌患者的DCR 分别高于非腺癌、Ⅳ期、安罗替尼三线及以上治疗的患者,差异均有统计学意义(P<0.05)。说明晚期肺癌患者的DCR 与病理类型、临床分期及安罗替尼使用线数有关。
安罗替尼的临床试验尚未发现治疗相关死亡事件,不良反应以厌食、乏力、疲劳、高血压、皮肤毒性反应等为主,程度较轻[24]。以ALTER0303 研究的经验,可以通过患者教育、预防措施、早期积极干预以及剂量调整来控制安罗替尼相关不良事件[25]。白蛋白结合型紫杉醇的不良反应主要为脱发、血液学毒性、乏力、周围神经毒性、关节肌肉疼痛和肝肾功能异常,多为1~2 级。德国的一项研究显示,白蛋白结合型紫杉醇常见的不良反应为白细胞减少(10.2%)、贫血(8.6%)和肺炎(5.1%)[26]。本研究中,不良反应以中性粒细胞减少、乏力、脱发、贫血、周围神经病变和高血压为主,通过对症治疗可有效控制。3 级不良反应中,中性粒细胞减少(11.76%)、贫血(5.88%)和血小板减少(2.94%)考虑为白蛋白结合型紫杉醇的血液学毒性,脱发(5.88%)和周围神经病变(5.88%)是白蛋白结合型紫杉醇的非血液学毒性,高血压(5.88%)考虑与安罗替尼相关。本研究样本量较少,结果可能会存在一定的偏倚,未来需扩大样本量开展前瞻性随机对照试验。
综上所述,安罗替尼联合白蛋白结合型紫杉醇可改善晚期肺癌患者的预后,延长生存期,且不良反应可耐受。

