ICU患者耐碳青霉烯类肠杆菌目细菌感染特征及危险因素分析
陈祥凤,张振华,吴贻乐,胡小骞,刘周,杨旻,孙昀,李景荣,郑凌,杨锡瑶,杨利琦
安徽医科大学第二附属医院,安徽 合肥 230601
近年来重症监护病房(intensive care units,ICU)内耐碳青霉烯类肠杆菌目细菌(carbapenemresistantEnterobacteriaceae,CRE)的感染率逐年攀升,加之其耐药性增加、治疗药物选择受限、患者死亡率高,CRE 已成为医院获得性感染最难控制的细菌类型之一[1-2]。我国细菌耐药性监测网(CHI‐NET)数据显示,CRE 菌株呈现多样化趋势,除常见的克雷伯菌属、肠杆菌属、埃希菌属外,沙门菌属、沙雷菌属和枸橼酸杆菌属也逐渐增多,其中肺炎克雷伯菌的耐药问题尤为突出,该菌对美罗培南和亚胺培南的耐药率均超23.0%[3]。
研究显示,ICU 患者由于病情更危重、免疫力更低、有创操作更频繁,其医院感染的发生更为普遍[1-2,4]。部分研究发现感染前使用各类抗生素、进行有创操作等因素与ICU 患者CRE 医院感染有关[2,4],但结论并不完全一致。因此,为了解ICU 患者CRE 医院感染的菌种分布、耐药情况以及危险因素,笔者开展了本次研究,现将结果报告如下。
1 资料与方法
1.1 研究对象 收集2018 年1 月1 日-2020 年12月31 日安徽医科大学第二附属医院4 个ICU(重症医学科一病区、重症医学科二病区、急诊内科重症监护病房、呼吸与危重症医学科重症监护病房)内CRE 医院感染患者和同时期碳青霉烯类药物敏感的肠杆菌目细菌(carbapenem-susceptibleEnterobacteriaceae,CSE)医院感染患者的临床资料,进行病例对照研究。ICU 患者医院感染CRE 或CSE 诊断标准参照《医院感染诊断标准(试行)》[5]要求。纳入标准:≥18 岁,在入住ICU 48 h 后至转出ICU 48 h 内发生医院感染且相关部位的临床标本行细菌培养鉴定出CRE 或CSE 者。排除标准:定植、疑似污染、入住ICU 前或入住ICU 不足48 h 已存在CRE 或CSE 感染的患者。当患者在ICU 内多次感染CRE 或CSE 时,仅纳入第一次;单次检出多种细菌,凡检出新发CRE 则纳入CRE 组,如存在两种以上新发CRE 或CSE,则仅将优势菌种纳入相应分组。
1.2 研究方法
1.2.1 菌种鉴定和药敏 细菌培养和鉴定由该院检验科微生物实验室完成,严格遵守《全国临床检验操作规程》的相关流程采集标本。2019 年前使用VITEK2 Compact 全自动微生物分析仪(法国生物梅里埃公司)及其配套系统进行菌种鉴定,2019年后应用基质辅助激光解析电离飞行时间质谱进行菌种鉴定;应用VITEK-2 药敏分析仪及配套药敏卡进行药敏检测,药敏标准参照美国临床和实验室标准协会发布的抗菌药物敏感试验执行标准[6]。
1.2.2 数据收集 利用医院病历质量控制系统查询病历并收集以下信息:①基本人口学特征;②临床特征,包括入住ICU 方式、基础疾病、前1 年内疾病相关情况、住院前3 个月是否使用抗菌药物、ICU入住和转出日期、感染前进行的特殊诊疗(留置导尿、血流置管、无创呼吸机、有创呼吸机、手术、内镜、营养支持、穿刺术、输注血液制品、免疫抑制剂、糖皮质激素、心肺复苏)和抗感染药物使用情况、感染前检出的病原体数、感染后30 d 转归、CRE及CSE 标本来源、菌种类型和药敏结果。
1.4 伦理学声明 该研究已经过安徽医科大学第二附属医院伦理委员会批准(审批号:YX2020-063)。
2 结 果
2.1 菌种分布与药敏结果
2.1.1 CRE 标本及菌种分布 本研究共纳入CRE组133 例,CSE 组220 例,两组的年龄中位数分别为66.0(49.0,76.0)和65.0(51.0,75.8),男性、女性人数分别为91 人(占68.4%)、42 人(占31.6%)和156人(占70.9%)、64 人(占29.1%),两组年龄和性别差异均无统计学意义(Z=-0.025,χ2=0.244,P均>0.05)。CRE 组标本以呼吸道分泌物为主(占69.9%),其次是血液(占7.5%)、腹腔分泌物(占6.8%),与CSE 组相比差异无统计学意义(χ2=6.444,P>0.05),见表1。
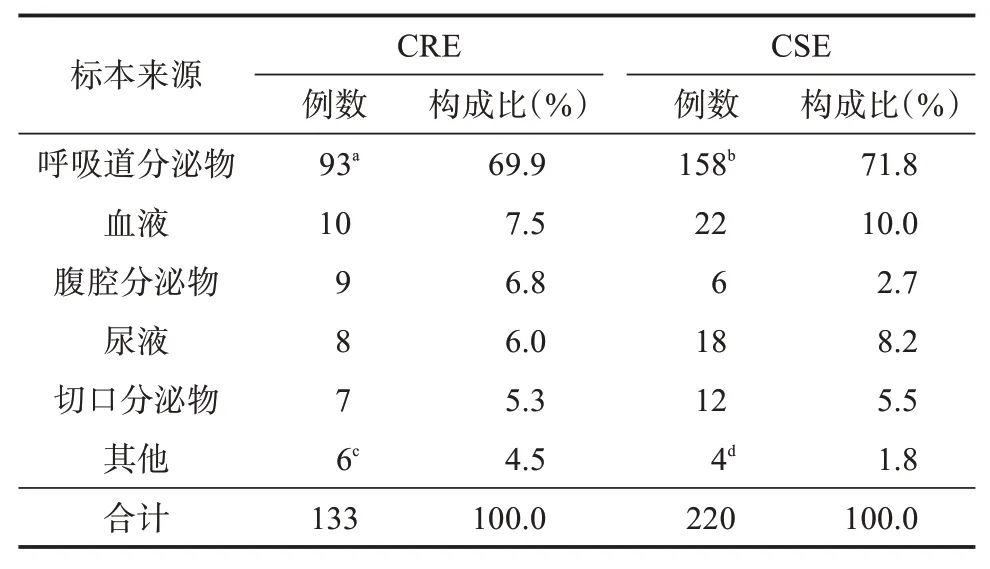
表1 CRE 与CSE 的标本来源分布情况Table 1 The distribution of nosocomial specimen sources
两组中最常见的菌种均为肺炎克雷伯菌,CRE组中次常见菌是阴沟肠杆菌,CSE 组中次常见菌是大肠埃希菌,见表2。CRE 组中有39 例(占29.3%)为混合感染,其中除1 例是肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌三种细菌混合感染外,其余38 例均为两种细菌的混合感染,菌种组成前三位主要是肺炎克雷伯菌与鲍曼不动杆菌(11 例),肺炎克雷伯菌与铜绿假单胞菌(6 例),阴沟肠杆菌与嗜麦芽窄食单胞菌(4 例)。CSE 组中有68 例(占30.9%)为混合感染,其中除1 例是阴沟肠杆菌、金黄色葡萄球菌和奇异变形杆菌三种细菌混合感染外,其余67 例均为两种细菌的混合感染,菌种组成前三位主要是肺炎克雷伯菌与鲍曼不动杆菌(12例),肺炎克雷伯菌与嗜麦芽窄食单胞菌(7 例),肺炎克雷伯菌与金黄色葡萄球菌(4 例)、阴沟肠杆菌与鲍曼不动杆菌(4 例)。CRE 组与CSE 组中的混合感染检出差异无统计学意义(χ2=0.099,P>0.05)。
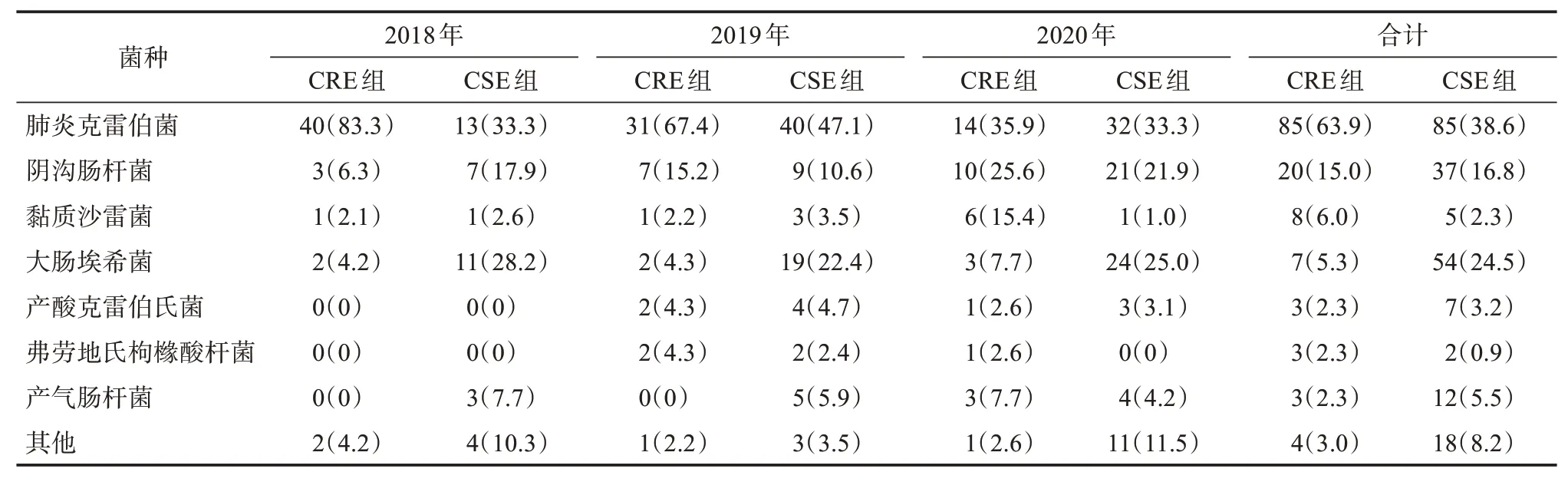
表2 2018—2020 年CRE 和CSE 各菌种分布情况[n(%)]Table 2 Proportion of CRE and CSE strains,from 2018 to 2020[n(%)]
2.1.2 CRE 药敏结果 CRE 菌株除对头孢他啶阿维巴坦、替加环素、多粘菌素B敏感性高外,对其余所有常用抗感染药物均呈现出较高耐药性(≥51.5%),特别是对碳青霉烯类药物,其耐药率均不低于97.0%。见表3。
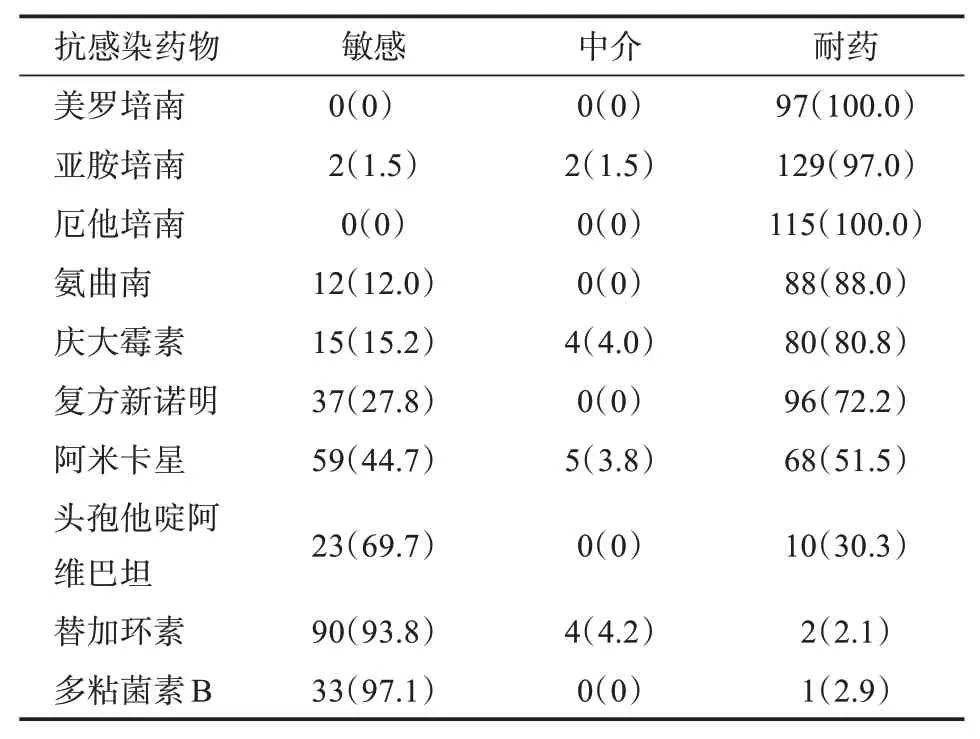
表3 CRE 对常用抗感染药物的敏感性[n(%)]Table 3 Susceptibility of CRE to common anti-infective drugs[n(%)]
2.1.3 确诊医院感染CRE 与CSE 30 d 预后 CRE组第30 天的随访率为94.0%(125/133),有52 人在感染CRE 后30 d 内死亡,死亡率为41.6%;CSE 组第30 天的随访率为92.3%(203/220),有56 人在感染CSE 后30 d 内死亡,死亡率为27.6%。两组死亡率差异有统计学意义(χ2=6.879,P<0.01)。
2.2 CRE 组与CSE 组临床特征比较 单因素分析结果显示,CRE 组有18 项临床特征的出现率或中位数高于CSE 组,差异有统计学意义(P均<0.05)。进一步对单因素分析中差异有统计学意义的因素进行多因素logistic 回归分析,最终外院转入ICU,感染前使用糖皮质激素、碳青霉烯类药物、糖肽类药物等4 项临床特征进入回归方程。见表4。
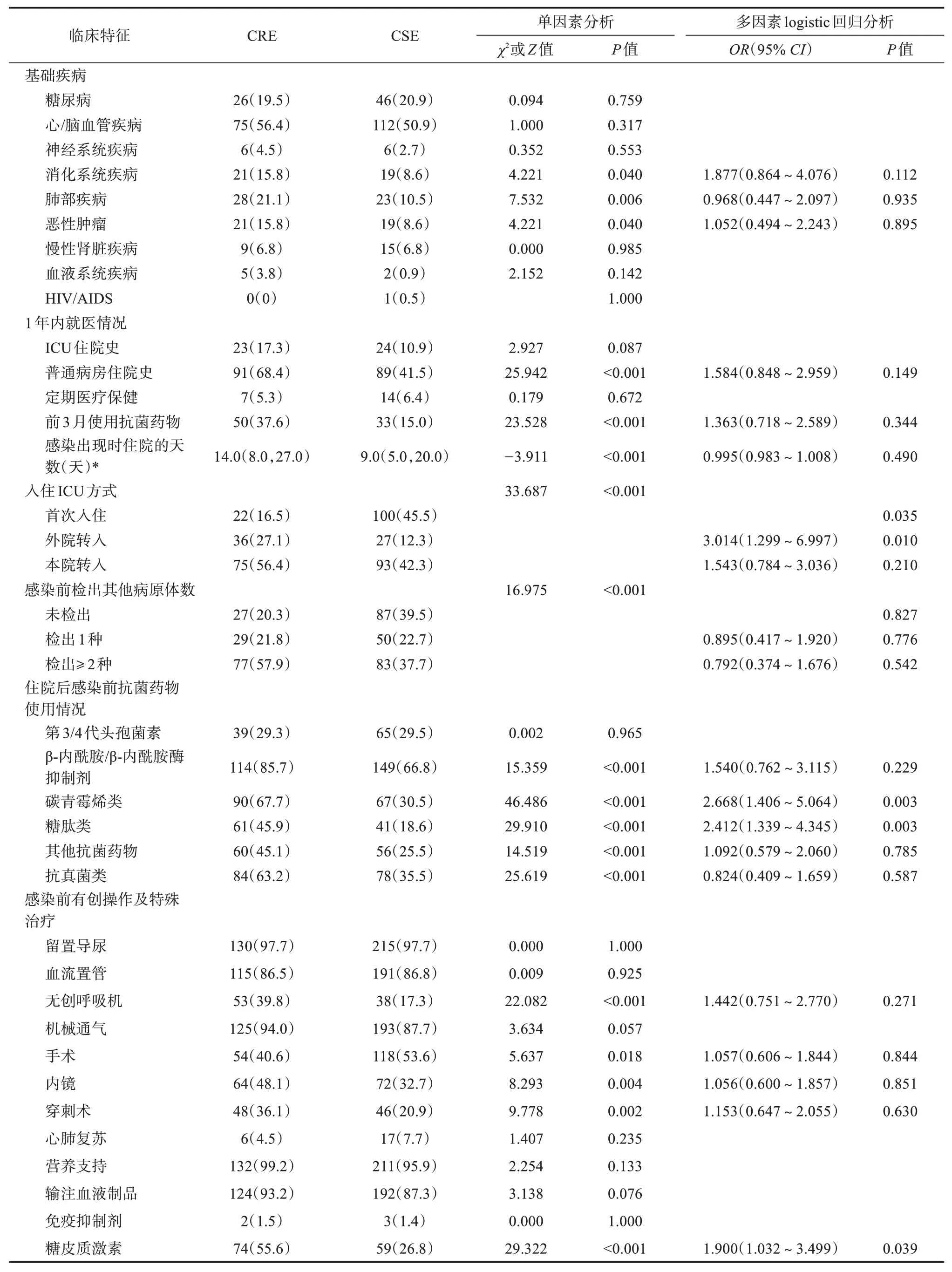
表4 与ICU 内感染CRE 相关的临床特征单因素和多因素logistic 回归分析[n(%)]Table 4 Univariate and multivariate logistic regression analysis results of clinical characteristics related to CRE infection in ICU[n(%)]
3 讨 论
目前国内外关于医院感染CRE 的危险因素研究已很多,但因结论并不完全一致,故类似研究仍在进行[2,4]。本研究将ICU 患者作为研究对象,通过比较医院感染CRE 和CSE 临床特征的差异,对部分危险因素做出了较为明确的判定。
本研究CRE 组的标本来源以呼吸道分泌物最为常见,其次是血液,与吴静等[7]关于CRE 流行病学特点的多中心研究结果基本一致,其原因可能是患者年龄偏高(中位数为66 岁),多数合并肺部疾病,感染时常表现为发热,呼吸道标本及血液标本相对容易获得且送检量较大。CRE 组中最常见的感染菌种是肺炎克雷伯菌(占63.9%),其次是阴沟肠杆菌(占15.0%),而多数研究中大肠埃希菌是第二常见菌[7]。本研究中阴沟肠杆菌的检出率存在升高趋势,肺炎克雷伯菌存在下降趋势,这种菌种变化趋势提示随着耐碳青霉烯类肺炎克雷伯菌的控制,阴沟肠杆菌可能成为未来CRE 院内防控中的潜在威胁,院内感染防控应加强对该菌的关注。
本研究中,CRE 对多粘菌素B 和替加环素的敏感性维持在高水平,但对阿米卡星和头孢他啶阿维巴坦的敏感性与其他研究相比有所差异。其中对阿米卡星的敏感率为44.7%,比国内其他研究更高[1,7],但低于van Duin[8]等研究中的72%,这可能与地域间CRE 耐药机制不同有关;对头孢他啶阿维巴坦的敏感率为69.7%,低于其他研究中的86%[8],该药是产肺炎克雷伯菌碳青霉烯酶(Klebsiella Pneumoniaecarbapenemase,KPC)型CRE 的最佳治疗药物,其耐药机制主要是产金属β-内酰胺酶,其次是KPC 基因突变[9]。本研究因未对CRE 菌株进行碳青霉烯酶表型或基因型检测而无法明确其对头孢他啶阿维巴坦耐药的机制,提示开展CRE 菌株耐药机制检测对耐药菌管理和防控至关重要。
本研究发现外院转入ICU、糖皮质激素使用史、碳青霉烯类药物和糖肽类药物使用史可能是ICU 患者医院感染CRE 的危险因素,已有研究证实感染前使用碳青霉烯类、糖肽类药物是其危险因素[2,4,10],而外院转入、感染前使用糖皮质激素等因素尚未被证明。
Salomão 等[11]研究显示从其他医疗机构转院是入住ICU 时CRE 定植的危险因素;也有研究认为在不同医疗机构就诊的患者属于CRE 携带的高危人群[12]。本研究显示由外院直接转入ICU 是患者发生CRE 医院感染的危险因素,考虑有以下原因:由其他医疗机构转入该院ICU 的患者病情可能更重,且该类患者在外院住院过程中可能接受了一定的医疗护理,甚至可能有耐药菌接触史。本研究揭示了患者在其他医疗机构停留可能增加耐药菌感染风险,对该类人群采取防控措施可能有助于控制CRE 的发生和传播。
本研究首次发现糖皮质激素的使用可能与ICU 患者医院感染CRE 相关。糖皮质激素在临床治疗上占有重要地位,但因该药对人体免疫功能有抑制作用[13],可以诱发和加重感染,其机制可能与抑制DNA、RNA 及蛋白质的合成导致白细胞与单核细胞不能正常发挥吞噬细菌作用、抑制细胞对葡萄糖摄取和利用导致血糖升高、促进淋巴细胞内的酯解过程从而削弱细胞免疫功能等有关。在使用糖皮质激素时若发生感染,发热、咳嗽等症状可以被抑制而延误治疗,故许多类似研究将糖皮质激素纳入影响因素[14],但仅在检测出CRE 菌株的新冠肺炎患者[15]或CRE 定植患者[16]中被证实为独立危险因素,上述研究并未对该因素进行深入讨论。本研究发现使用糖皮质激素是ICU 患者医院感染CRE的危险因素,提示在临床实践中,对将要使用该类药的患者严格把握用药指征,对既往或正在使用的患者进行定期评估和感染监测,可能有助于降低患者医院感染CRE 的风险。
综上,了解CRE 流行病学变化、进行耐药机制检测对CRE 精准防控有重要意义。由外院直接转入ICU 的患者发生CRE 医院感染的可能性大,对该类人群重点防控可能利于减少CRE 院内感染的发生。抗感染治疗中,碳青霉烯类和糖肽类药物的使用需谨慎;对既往或正在使用糖皮质治疗的患者建议做定期评估和感染监测。
利益冲突声明全部作者声明无利益冲突
作者贡献声明陈祥凤负责论文撰写;张振华负责论文撰写指导;胡小骞负责ICU 患者发生医院感染的判定及样本收集;吴贻乐负责数据分析;刘周负责样本检测;杨旻、孙昀、李景荣、郑凌、杨锡瑶负责患者的临床数据收集;杨利琦负责项目设计和论文修改。

