LncRNA RP11-490M8.1 在乳腺癌中的表达及其对乳腺癌细胞增殖的影响
杨 莹,王子璇,陈 狄,陈 䶮,方亚群,金玉翠,马长艳*,陈 翔
1南京医科大学基础医学院医学遗传学系,江苏 南京 211166;2江苏大学附属宜兴市人民医院甲乳外科,江苏 宜兴 214221
乳腺癌(breast cancer,BCa)是全球范围内女性最常见的恶性肿瘤,复发和转移是导致乳腺癌患者治疗失败的主要原因[1-2]。尽管近年来乳腺癌的诊断和治疗手段已经取得了巨大进步,但乳腺癌的发病率仍高居不下,其发病机制尚未完全阐明。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个核苷酸的非编码RNA。大量研究表明,lncRNA 在多种肿瘤中异常表达,并通过多种机制参与包括乳腺癌在内的肿瘤发生发展过程[3-5]。例如,lncRNA TTN-AS1 通过调控miR-139-5p/ZEB1轴促进乳腺癌细胞的增殖、侵袭和上皮-间质转化(epithelial-mesenchymal transformation,EMT)[6];lncROPM 通过调控PLA2G16 的mRNA 稳定性上调其表达,激活PI3K/AKT、Wnt/β-catenin 和Hippo/YAP信号通路,进而维持乳腺癌干细胞的干性[7];lncRNA AY343892 通过与BRCA1 结合促进PTEN 的转录,进而抑制乳腺癌的进展[8]。然而,lncRNA的数目众多、作用机制复杂,其在乳腺癌发生发展中的作用和机制有待进一步深入挖掘。
RP11-490M8.1 是本课题组在Gene Expression Omnibus(GEO)数据库中筛查发现的在乳腺癌组织中显著下调的一条lncRNA,目前尚未有关于RP11-490M8.1 在乳腺癌发生发展中的作用及机制的报道。本研究检测RP11-490M8.1 在乳腺癌组织和癌旁组织中的表达情况,并初步研究其对乳腺癌细胞增殖的影响。
1 材料和方法
1.1 材料
乳腺癌组织及癌旁组织取自南京医科大学第一附属医院乳腺外科,患者未接受过局部或全身治疗且经病理学诊断为乳腺癌。本研究经南京医科大学伦理委员会批准[南医大伦理(2022)492 号],标本的获取征得患者知情同意。
人乳腺癌细胞系MCF-7和MDA-MB-231来源于美国ATCC。所有细胞均使用含有10%胎牛血清(FBS)、100 U/mL 青霉素和100 μg/μL 链霉素的DMEM(Gibco 公司,美国)培养基,并在含有5%CO2的37 ℃细胞培养箱中进行培养。
1.2 方法
1.2.1 qRT-PCR
用TRIzol 试剂(大连宝生物)提取乳腺癌组织、癌旁组织以及乳腺癌细胞的总RNA,将RNA按照试剂商提供的说明书(Reverse Transcription Kit,南京诺唯赞)逆转录为cDNA,然后对目的基因进行qRTPCR扩增(SYBR Green Ⅰ,上海翊圣)。所用引物序列 为:β-actin 上游引物5′-AGATGTGATCAGCAAGCAG-3′,下游引物5′-GCGCAAGTTAGGTTTTGTCA-3′;人RP11-490M8.1 上游引物5′-CTCTGCTTTCTGTGCCAAGG-3′,下游引物5′-AAACCCACCACT-TTTGTCCG-3′。
1.2.2 细胞转染及稳转细胞构建
RP11-490M8.1 表达质粒为本实验室构建,RP11-490M8.1 ASO 及其对照(广州锐博),按照Lipofectamine 2000(Thermo Scientific 公司,美国)说明书进行质粒或ASO 转染。RP11-490M8.1 表达质粒及其对照质粒转染MDA-MB-231 和MCF-7细胞后,用嘌呤霉素进行稳转细胞的筛选并用qRT-PCR 进行过表达效率的验证。
1.2.3 CCK8实验
将细胞接种于96孔细胞培养板,用Opti-DMEM配制10%CCK8试剂(上海翊圣),在细胞贴壁后的0、24、48、72 和96 h 分别加入0.1 mL CCK8 试剂,放入37 ℃细胞培养箱中避光孵育1~2 h,然后用酶标仪于450 nm 处检测吸光度值,用GraphPad 软件进行分析并作图。
1.2.4 克隆形成实验
将细胞按100 个/孔接种于6 孔板中,培养14 d左右加入5 mL 4%多聚甲醛,在4 ℃冰箱中固定15 min 后弃去多聚甲醛,使用结晶紫染色10~30 min,将染色液用PBS洗净后室温干燥、拍照,然后进行计数统计。
1.3 统计学方法
用GraphPad Prism 5.0 软件和One-way ANOVA检验进行实验结果分析,所有数据以均数±标准差()。RP11-490M8.1表达水平与临床病理参数的关系采用χ2检验,生存分析采用Kaplan-Meier 检验,Cox多因素回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 RP11-490M8.1在乳腺癌组织中表达下调
通过GEO 数据库(GSE29431)分析了人乳腺癌及癌旁组织中差异表达的lncRNA。对这些差异表达的lncRNA进一步筛选发现,RP11-490M8.1在乳腺癌组织中表达显著下调(图1A)。利用Web server for Coding Potential Assessing Tool 预测了RP11-490M8.1的蛋白编码能力,结果显示RP11-490M8.1不具有蛋白编码能力(图1B)。用qRT-PCR检测了36对乳腺癌及癌旁组织中RP11-490M8.1的表达水平,结果显示,RP11-490M8.1在33例乳腺癌患者中表达下调,在3例乳腺癌患者中表达上调(图1C)。

图1 RP11-490M8.1在乳腺癌组织中表达下调Figure 1 Expression of RP11-490M8.1 was downregulated in breast cancer
2.2 RP11-490M8.1 表达水平与乳腺癌患者的临床分期呈负相关,与总生存期正相关
分析RP11-490M8.1 表达水平与乳腺癌患者的临床分期和预后的关系,结果表明,RP11-490M8.1表达水平与乳腺癌患者的临床分期呈负相关(表1,图2A),而与雌激素受体、孕激素受体、年龄和人表皮生长因子受体-2 的表达均无相关性。Kaplan-Meier plotter数据库分析显示,RP11-490M8.1低表达和较差的总生存期(overall survival,OS)相关(P=0.034,图2B)。以上结果提示,RP11-490M8.1可能是乳腺癌预后不良的生物标志物。
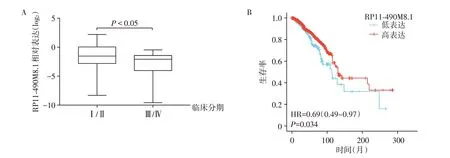
图2 RP11-490M8.1表达水平与乳腺癌患者的临床分期(A)与预后的关系(B)Figure 2 Correlation of RP11-490M8.1 expression with the clinical stage(A)and prognosis(B)of breast cancer patients
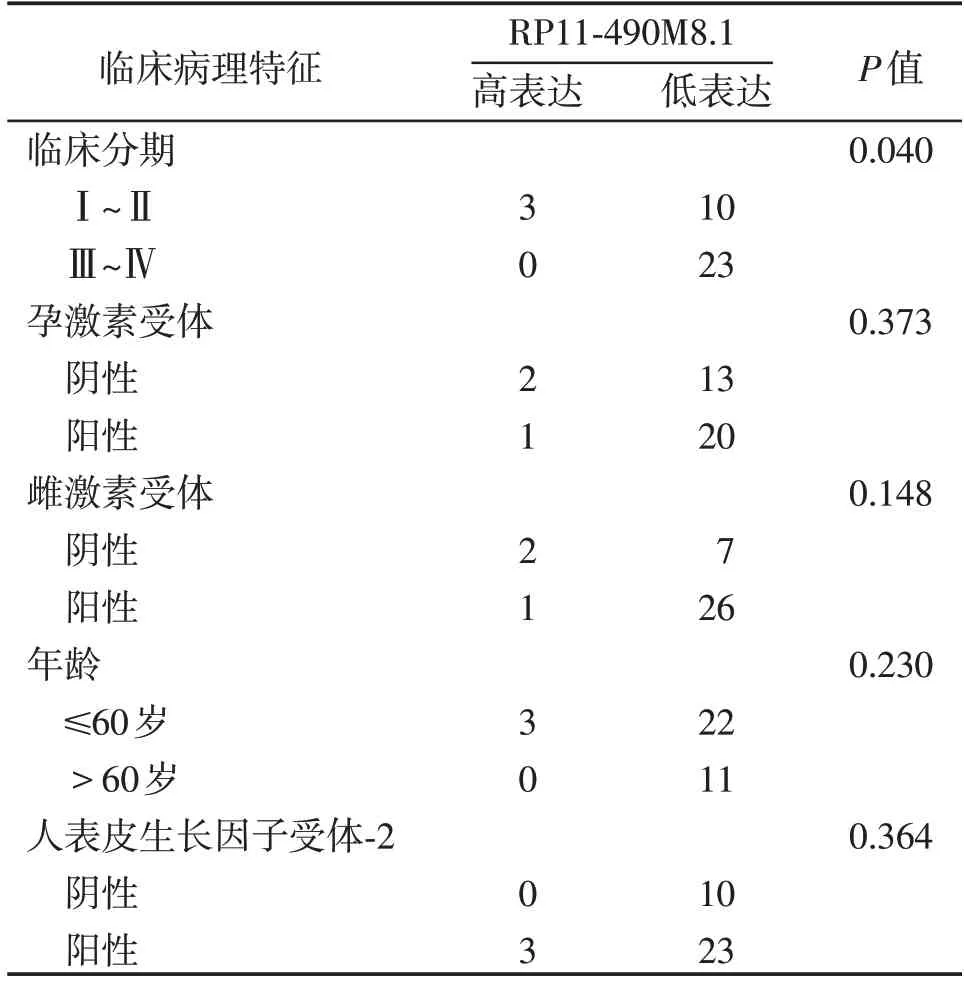
表1 RP11-490M8.1与乳腺癌患者临床病理特征相关性的分析Table 1 Correlation of RP11-490M8.1 expression with clinicopathological characteristics of breast cancer patients(n)
2.3 过表达RP11-490M8.1显著抑制乳腺癌细胞的增殖
为了确定RP11-490M8.1 在乳腺癌细胞中的功能,首先在MCF-7 和MDA-MB-231 乳腺癌细胞中转染RP11-490M8.1 表达质粒,构建RP11-490M8.1 过表达稳转细胞系(图3A)。CCK8和细胞平板克隆形成实验结果表明,过表达RP11-490M8.1显著抑制了乳腺癌细胞的增殖(图3B、C)。

图3 过表达RP11-490M8.1抑制乳腺癌细胞的增殖Figure 3 Overexpression of RP11-490M8.1 suppressed the proliferation of breast cancer cells
2.4 敲低RP11-490M8.1促进乳腺癌细胞的增殖
为了进一步证明RP11-490M8.1 在乳腺癌细胞增殖中的作用,在MDA-MB-231 细胞中转染ASO-RP11-490M8.1 以敲低RP11-490M8.1 的表达,qRTPCR 实验结果显示,MDA-MB-231 细胞中RP11-490M8.1 的表达显著下降(图4A)。CCK8 实验结果表明:敲低RP11-490M8.1表达显著促进了乳腺癌细胞的增殖(图4B)。
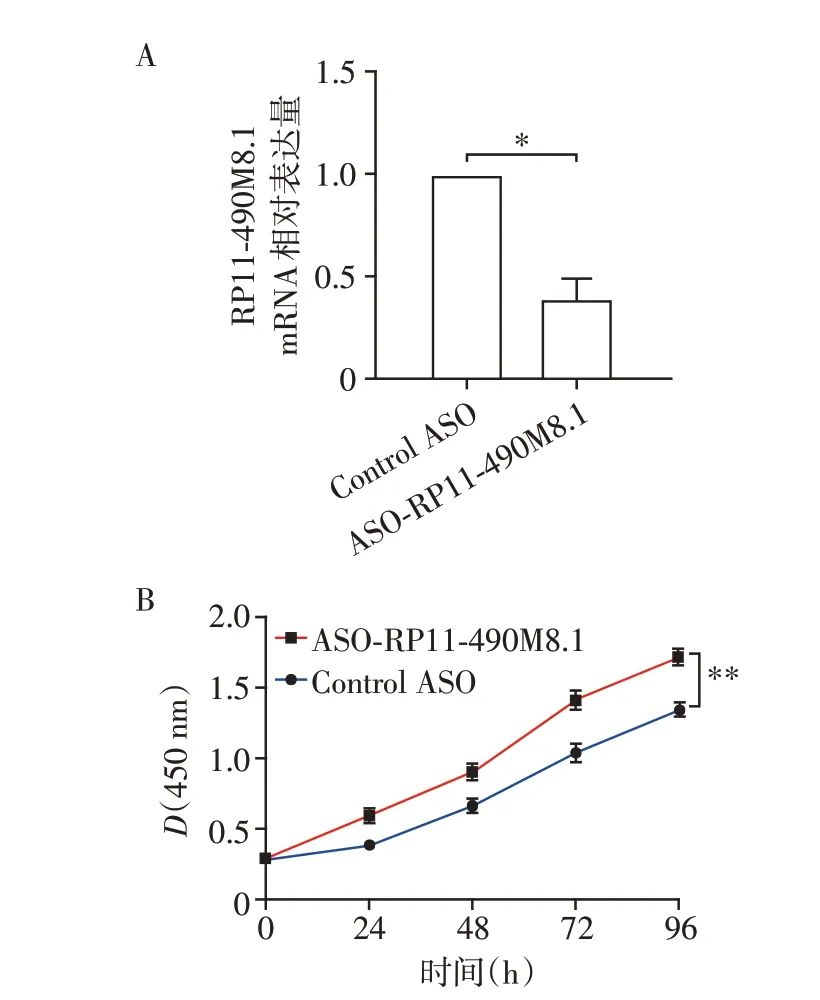
图4 敲低RP11-490M8.1表达促进乳腺癌细胞的增殖Figure 4 Knockdown of RP11-490M8.1 promoted the proliferation of breast cancer cells
3 讨论
乳腺癌已超过肺癌成为全球最常见的癌症和第5 大癌症死亡原因,2020 年新发病例约230 万,2070年新发病例预计将达到440万[9-10]。因此,深入探讨乳腺癌发病的分子机制,寻找新的干预/治疗靶点和诊断、预后生物标志物十分必要。本研究发现:RP11-490M8.1在乳腺癌组织中表达水平显著下降,RP11-490M8.1低表达与乳腺癌患者较差的预后相关;在乳腺癌细胞中过表达RP11-490M8.1显著抑制乳腺癌细胞增殖,敲低RP11-490M8.1表达则显著促进了乳腺癌细胞的增殖。
近年来lncRNA 在肿瘤发生、发展和耐药等过程中的作用引起了极大关注。越来越多的研究表明,lncRNA是非常有潜力的肿瘤诊断、治疗、预后的生物标志物和有效靶点[11-13]。在乳腺癌中,SGMS1-AS1、AC015908.2、LINC01014、AC083967.1、TTC39AAS1 和AL353708.3 这6 个铁死亡相关的lncRNA 可以较好地预测三阴性乳腺癌患者的预后[14];lncRNA UCA1高表达预示乳腺癌患者预后不良,靶向UCA1可逆转乳腺癌细胞对化疗和内分泌治疗的耐药性,抑制乳腺癌进展[15];lncRNA SNHG3 在乳腺癌患者血清中水平升高,核磁共振弥散加权成像(diffusion weighted imaging,DWI)联合血清SNHG3水平对乳腺癌有较好的诊断价值[16]。本研究通过GEO数据库分析和临床标本检测,发现RP11-490M8.1在乳腺癌组织中表达显著下调,且RP11-490M8.1低表达与乳腺癌患者较差的预后相关。以上结果提示,RP11-490M8.1可能是乳腺癌患者新的预后生物标志物。
lncRNA 通过多种途径参与肿瘤的发生发展。如lncRNA CASC11 通过调节miRNA-150 的表达而促进膀胱癌细胞的增殖[17];HOX 基因簇相关的lncRNA 通过调节EMT 参与肿瘤转移过程[18];lncRNA ZNF561-AS1通过调节miR-302a-3p/PDGFD轴而参与肝细胞癌细胞的增殖和血管发生[19];lncRNA TDRG1通过调节Sox2 mRNA的稳定性而参与肺癌细胞干性的调节[20];TUBA1C 是lncRNA RP11-480I12.5 的亲本基因,而后者通过上调AKT3和CDK6 而促进乳腺癌的恶性进展[21]。本研究发现,过表达RP11-490M8.1显著抑制了乳腺癌细胞的增殖,而敲低RP11-490M8.1表达则促进了乳腺癌细胞的增殖。以上结果初步提示:RP11-490M8.1在乳腺癌中可能发挥抑癌基因的作用。RP11-490M8.1抑制乳腺癌细胞增殖的机制以及对乳腺癌细胞其他生物学行为如迁移、侵袭和EMT等的影响有待于后续实验进一步深入探讨。

