基于转录组的番荔枝ARF基因家族鉴定及其在花发育中的表达分析
周艳 莫雨杏 刘淑艺 李卫锦 黎海利 刘锴栋

关键词:番荔枝;生长素响应因子;生物信息学分析;花发育;表达分析
中图分类号:S667.9 文献标识码:A
番荔枝(Annona squamosa L.),也称为释迦果,属番荔枝科植物,是热带、亚热带地区的著名水果,分布于福建、广西、广东、海南、云南等地[1]。由于番荔枝的叶柄抱嵌着叶芽,所以叶片不脱落,叶芽则无法萌发[2-3]。番荔枝的花具有雌雄异熟且雌蕊先熟的特点,常常出现花发育异常和畸形花现象,导致“花而不实”、结果率低等问题,从而限制了番荔枝产业的发展[4-6]。
生长素响应因子(auxin response factor, ARF)位于生长素信号传递途径中的核心位置,能够通过调控生长素信号,以调控生长素相应基因的表达,从而影响植物的生长发育[7-8]。ARF 基因一般以基因家族的形式存在,通常有3 个经典的蛋白保守结构域:DNA 结合结构域(DBD),中间结构域(MR)和C 末端二聚化结构(CTD)[8]。ARF 通过识别并且结合位于生长素响应基因启动子中的生长素响应元件AuxREs(TGTCTC),抑制或激活下游响应基因的表达[9],并且ARF 能够通过与AUX/IAA 形成二聚体,影响ARF 蛋白质间的相互作用[8]。近年来,越来越多的ARF 被报道可能参与了植物花的发育。番茄SlARF1、SlARF9、SlARF11、SlARF15 和SlARF16 参与调控花的发育,均在花发育过程中表达,且SlARF16在花芽中表达量最高[10]。番茄SlARF2 在花蕾中具有最高的表达量,但是不影响花的形成[11]。果梅中PmARF11 基因在转基因烟草的花瓣中具有高表达水平,且显著影响花瓣颜色、边缘深裂和萼片变化,由此可以预测PmARF11 基因在花瓣发育过程发挥重要作用[12]。黄瓜CsARF10b 和CsARF10c 在雌花中不显著表达,在雄花中表达水平较高,预测CsARF10b 和CsARF10c 基因能够调控雄花发育[13]。在番木瓜中,CpARF1、CpARF2、CpARF4、CpARF5 和CpARF10 基因在花發育的早期高表达,随后则呈现下降趋势,而CpARF6的表达则随着花发育的进程不断上升[8]。虽然番荔枝的全基因组测序尚无报道,但是由于转录组测序技术的快速发展为研究番荔枝ARF 基因家族提供了良好的平台。
本课题组前期对番荔枝花发育4 个时期进行了转录组测序,获得71 948 条unigenes 序列信息,平均长度为825.4 bp,将获得的unigenes 序列与已知数据库进行比对,共有24 911 条unigenes 被注释到[14]。本研究基于此数据库,在转录组层面利用生物信息学方法对番荔枝ARF 家族基因成员进行鉴定,分析番荔枝ARF 家族蛋白的系统进化、理化性质、亚细胞定位、二级三级结构等,并通过qRT-PCR 分析番荔枝ARF 家族基因在花发育不同阶段和畸形花中的表达,为今后番荔枝ARF 家族基因的克隆和功能研究,深入探索番荔枝ARF 家族基因调控花发育的机制奠定基础,有助于解决番荔枝产业上出现的“花而不实”、结果率低等问题。
1 材料与方法
1.1 材料
番荔枝(Annona squamosa L.)种植于岭南师范学院热带果树试验地,常规栽培管理。于2018年7 — 8 月分别采摘花芽期( I , 1 mm<花芽<2 mm)、花蕾期(II,5 mm<花蕾<6 mm)、开花前期(III,花瓣轻微张开)、开花期(IV,花瓣张开)4 个阶段的花。于2019 年7—8 月分别采摘正常的花蕾(NF)和畸形的花蕾(MF)。不同花的材料重复3 次,取样后立即用液氮速冻后保存于–80 ℃冰箱储存备用。
1.2 方法
1.2.1 RNA 提取与转录组测序 把1.5 mL 离心管放置冰上预冷,分别加入1 mL TRNzol 液,摇匀后加入氯仿/异戊醇混合液200 μL、巯基乙醇8 μL,将研磨得到的(花芽期、花蕾期、开花前期、开花期)花样品各100 mg 加入上述离心管中。
将样品震荡混合, 在4 ℃下, 12 000×g 离心10 min。取上清液750 μL,加入等体积的水饱和酚/氯仿/异戊醇,震荡混匀,在4 ℃下,12 000×g离心10 min。重复上述步骤2 遍。取上清液650 μL,加入等体积异丙醇,65 μL 醋酸钠溶液,置于–20 ℃,沉淀30 min。冰浴后的样本,在4 ℃下,12 000×g 离心20 min,弃上清液,加入500 μL75%乙醇,洗涤沉淀,离心10 min,并重复2 遍。洗涤后的样本,吸干乙醇,自然晾干后备用。
建库用的RNA 需除去污染DNA。方法如下:加入42 μL RNA-free 的DNA 酶,直至全部溶解。在37 ℃水浴消化30 min 后,再加入550 μL 的RNA-free 水至600 μL,在加入水饱和酚/氯仿/异戊醇沉淀,离心弃上清液。重复上述洗涤步骤。RNA 充分溶解后,稀释10 倍,进行1%琼脂糖凝胶电泳,检测RNA 质量。
番荔枝花发育不同阶段(花芽、花蕾、开花前期、开花期)转录组数据由基迪奥生物公司进行测序获得,后续分析基于此测序结果数据。
1.2.2 番荔枝ARF 的系统进化分析 利用GeneStructure Display Server ( http://gsds.cbi.pku.edu.cn/index. Php)在线软件对基因结构进行分析。拟南芥ARF 基因序列从生物信息资源网站TAIR( https://www. arabidopsis.org/ ) 直接下载。使用MEGA7.0(https://www.megasoftware.net/mega5)、TreeView1.6(http://www.brc.dcs.gla.ac.uk/ser-vices/)在线软件预测蛋白结构域,并通过邻接法,校验参数(bootstrap)设置为1000,构建系统进化树。使用ClustalW(http://www.ebi.ac.uk/Tools/msa/clustalw2/)对ARF 蛋白氨基酸进行多重序列比对。
1.2.3 番荔枝ARF 基因家族理化性质及蛋白结构分析 利用在线软件Prot Param(http://web.expasy.org/protparam/)分析预测番荔枝ARF 蛋白序列的分子量、等电点、不稳定系数、脂肪指数和疏水性等基本的理化性质。利用在线软件Prabi(NPS@:SOPMA secondary structure prediction,https://npsa- prabi.ibcp.fr/cgi-bin /npsa_automat.pl?page=npsa_sopma.html)对ARF 蛋白质序列进行二级结构α-螺旋、延伸链、β-转角、无规则卷曲进行预测。利用在线软件SWISS-MODEL(https://swissmodel. expasy.org/)对ARF 蛋白質序列进行三级结构分析。利用在线软件NCBI 的CD-search( https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析番荔ARF 家族蛋白的保守结构域。利用MEGA 7.0 软件分析ARF 中间结构域(MR)的氨基酸组成。
1.2.4 番荔枝ARF 蛋白的亚细胞定位分析 利用在线软件SoftBerry ( http://linux1.softberry.com/berry.phtml?topic=protcomppl&group=prgrams&subgroup=proloc)对ARF 蛋白进行亚细胞定位分析。同时将得到的AsARF2 、AsARF3a 和AsARF6a 全长序列编码区CDS 序列克隆到pCAMBIA1302-35S-GFP 载体中。使用pCAMBIA1302- 35S-GFP 空载体为阴性对照。将构建完毕的载体和GFP 空载体转化农杆菌GV3101 感受态细胞,挑取单克隆菌落,进行PCR验证,并通过摇床大量培养。以阳性克隆扩增后的菌液注射本氏烟烟草叶片。以培养48 h 后的烟草叶片制作临时装片,在激发光波长为488 nm 和发射光波长为625~725 nm 的条件下用激光共聚焦显微镜下进行荧光信号检测。观察产生的绿色荧光在烟草表皮细胞内的分布情况。
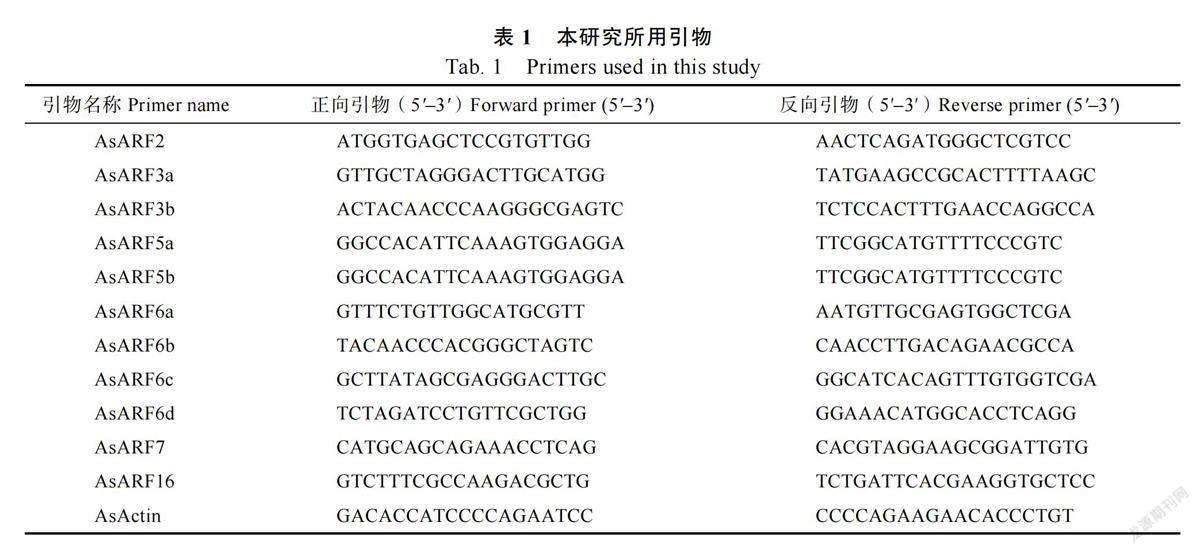
1.2.5 番荔枝ARF 家族基因在花发育中的表达分析 分别提取番荔枝花发育4 个阶段花器官、正常花以及畸形花的总RNA,逆转录成cDNA,以实时荧光定量PCR 技术检测AsARF 家族基因的表达。按照SYBR?Premix Ex TaqTM操作,以AsActin 为内参基因,在荧光定量PCR 仪上进行PCR 扩增,检测基因的表达量。反应条件:96 ℃1 min,95 ℃ 15 s,55 ℃ 30 s,72 ℃ 45 s,共40次循环。每个样品重复3 次。反应结束后分析荧光值变化曲线和熔解曲线。相对定量分析采用比较Ct 法,目的基因的相对表达水平为2–ΔΔCT。具体引物信息见表1。
1.3 数据处理
使用SPSS 17.0 软件对数据进行单因素方差分析(ANOVA)和差异显著性检验(Duncans 法)。
2 结果与分析
2.1 番荔枝ARF 家族基因的鉴定及系统进化分析
基于番荔枝花发育不同阶段转录组测序数据,在NR、NT、Swiss-Prot 和PFAM 4 个数据库进行注释,初步注释到18 个ARF 转录因子相关基因,通过NCBI Blast 和SMART 软件预测,去除重复序列及冗余转录本后,最终得到11 个ARF转录因子。
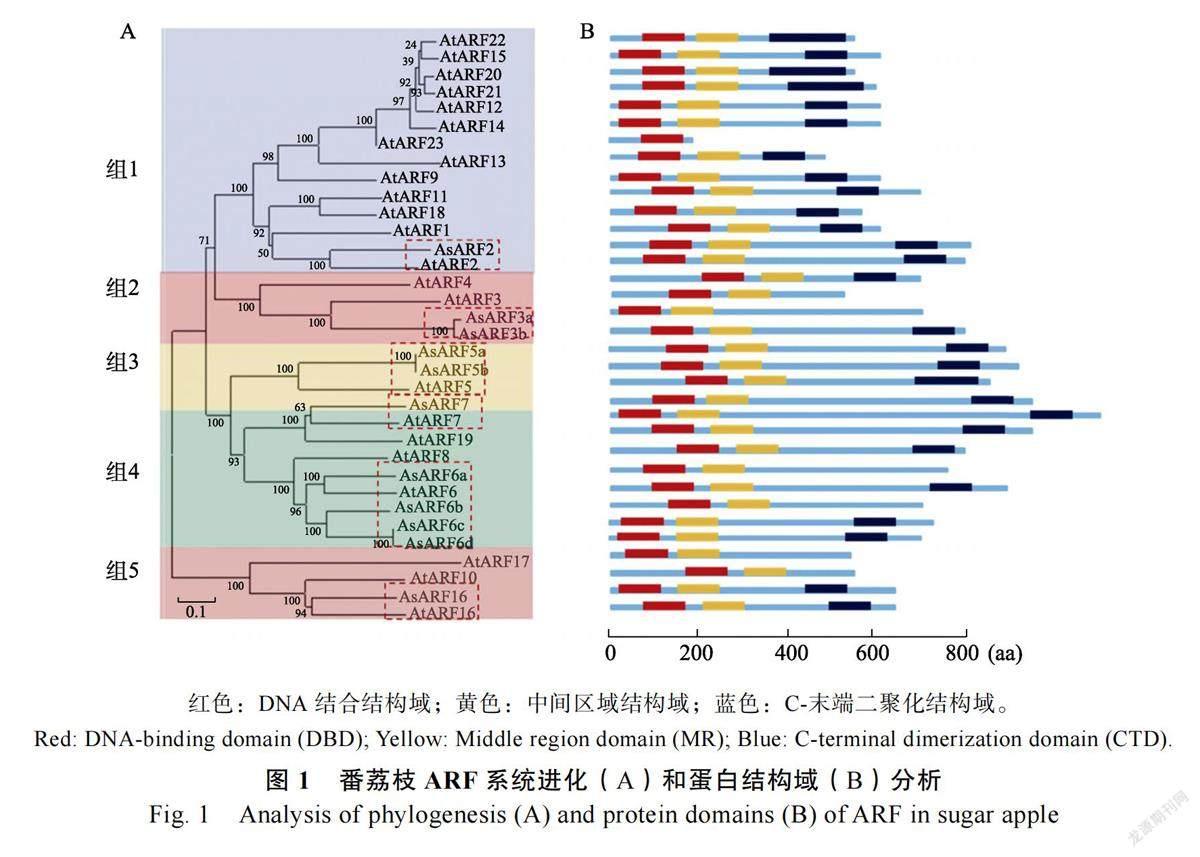
为了研究番荔枝11 个ARF 蛋白家族的进化关系与功能,利用MEGA7.0 软件构建番荔枝和拟南芥ARF 蛋白家族的系统进化树,根据进化树将2 个物种的ARF 家族蛋白进行聚类分析,共分为5 组(图1A)。对于番荔枝来说,第1 组包括1 个AsARF 基因家族成员(AsARF2),占基因家族成员总数的9.09%;第2 组包括2 个AsARF 基因家族成员(AsARF3a、AsARF3b),占基因家族成员总数的18.18%;第3 组包括3 个AsARF 基因家族成员(AsARF5a、AsARF5b、AsARF7),占基因家族成员总数的27.27%;第4 组包括4 个AsARF 基因家族成员(AsARF6a、AsARF6b、AsARF6c、AsARF6d),占基因家族成员总数的36.36%;第5 组包括1 个AsARF 基因家族成员(AsARF7),占基因家族成员总数的9.09%。
进一步分析表明,大部分AsARF 包含3 个经典的结构域,分别是DNA 结合结构域(DBD)、中间区域结构域(MR)和C-末端二聚化结构域(CTD)。AsARF3a、AsARF6a 和AsARF6b 只含有DNA 结合结构域和中间区域结构域,不含有C-末端二聚化结构域,其他AsARF 均含有3 个完整的结构域(图1B)。
通过ClustalW 软件进行比对,如图2 所示,可以得出大部分ARF 蛋白家族包含3 个特有的保守结构域,即DNA 结合结构域(DBD)、中间区域结构域(MR)、C-末端二聚化结构域(CTD),证实上述蛋白序列具有极高的序列相似度。
2.2 番荔枝ARF基因家族理化性质分析
如表2 所示,番荔枝ARF 家族成员理论分子量在73.85~112.51 kDa 之间, 氨基酸数量在677~1007 aa 之间,等电点分布在5.42~7.63 之间,11 个ARF 蛋白的平均等电点为6.28。有8 个番荔枝ARF 蛋白呈酸性,3 个番荔枝ARF 蛋白呈碱性,预测在酸性亚细胞环境中,大部分番荔枝ARF蛋白才会发挥作用。11 个番荔枝ARF 蛋白的脂肪系数大小在62.66~77.1 之间;番荔枝ARF 蛋白亲水系数大小在–0.648~0.351 之间,属于亲水性蛋白;所有ARF 的不稳定系数均大于40,预测番荔枝ARF 蛋白为不稳定蛋白。
番荔枝ARF 家族蛋白二级结构中,-螺旋和无规则卷曲所占比例比较大,所占比例从大到小排序:无规则卷曲>-螺旋>延伸链>-转角。采用SWISS-MODEL对番荔枝ARF 蛋白三级结构进行分析,结果表明番荔枝ARF 蛋白主要由无规则卷曲、-螺旋、-转角等构成三级结构(图3)。
2.3 番荔枝ARF 蛋白的氨基酸组成及分类
番荔枝AsARF 蛋白的氨基酸组成如图4A 所示,丝氨酸、谷氨酰胺、脯氨酸、亮氨酸、甘氨酸等在AsARF 蛋白中的含量较高。根据中间区域结构域(MR)的氨基酸组成和是否存在C-末端二聚化结构域(CTD),可以把11 个AsARF 分为三类(图4B)。第1 类包括DNA结合结构域(DBD)和CTD 结构域,MR 结构域为激活域(AD)的AsARF 蛋白, 包括AsARF5a 、AsARF5b 、AsARF6c、AsARF6d、AsARF7 和AsARF16;第2 类包括DBD 结构域和CTD 结构域,MR 结构域为抑制域(RD)的AsARF 蛋白,包括AsARF2和AsARF3b;第3 类包括DBD 结构域,MR 结构域为RD 抑制域,且缺乏CTD 结构域的AsARF蛋白,包括AsARF3a、AsARF6a 和AsARF6b。
2.4 亚细胞定位分析
转录因子通过与靶基因的启动子元件相结合,调节靶基因的转录表达,通常定位于细胞核中。通过在线软件SoftBerry 分析亚细胞定位,结果如表3 所示,11 个番荔枝ARF 蛋白都为潜在的细胞核定位蛋白。随机选取AsARF2、AsARF3a和AsARF6a 构建亚细胞定位载体,利用农杆菌介导的转化技术浸润本氏烟烟草叶片,在激光共聚焦显微镜下对绿色荧光信号(GFP)进行观察。结果显示,AsARF2、AsARF3a 和AsARF6a 蛋白都定位在细胞核中(图5)。这一结果表明,转录因子AsARF 蛋白具有细胞核定位的特征。
2.5 番荔枝ARF 基因家族在花发育不同阶段的表达分析
通过qRT-PCR技术分析了AsARF 基因在花发育4 个阶段的基因表达模式,结果表明AsARF3a、AsARF3b 、AsARF5a 、AsARF5b 、AsARF6a 和AsARF7 在花芽期表达量高,在花蕾期、开花期、开花前期的表达量呈下降趋势。AsARF2 和AsARF6b 的表达量在花蕾期比较高,在开花前期和开花期呈下降趋势。此外,AsARF6c 和AsARF6d在整个开花前期表现出较高的表达水平。而AsARF16 在花芽期和开花期呈现高表达(图6)。
2.6 番荔枝ARF 基因家族在正常花和畸形花中的表达分析
利用qRT-PCR分析AsARF 基因在番荔枝正常花和畸形花中的表达, 结果发现, AsARF2、AsARF3a、AsARF5a、AsARF5b、AsARF6b、AsARF6c和AsARF16 基因在正常花中呈现高表达,而AsARF3b、AsARF6a、AsARF6d、AsARF7 则在畸形花中表达量更高(图7)。
3 讨论
生长素作为一类植物生长发育相关的重要激素,而其中生长素响应因子ARF 是为植物生长素响应的关键调节因子之一,也是核心的正负调控因子[9, 15]。通过对植物的ARF 家族进行鉴定分析,有助于深入研究ARF 在植物生长发育各个环节的调控机制。近年来,随着基因组测序技术的不断推进,为基因家族分析提供了很大的便利性。但是番荔枝作为热带亚热带地区著名果树[1-2, 14],其基因组序列还未得到测序解析,这在很大程度上限制了控制其重要性状基因的研究。因此从转录组测序数据获得相关基因家族成员成为研究的热点之一。
目前在番茄中发现了17 个ARF 家族成员[11]、黄瓜中18 个[16]、苹果中29 个[17]、番木瓜中11个[8]。本研究基于番荔枝花发育不同阶段转录组测序数据,筛选并鉴定出番荔枝ARF 转录因子家族成员11 个。系统进化分析显示番荔枝和拟南芥的ARF 形成6 对旁系同源基因对,这为研究番荔枝ARF 基因功能提供了有价值的信息。生物信息学分析显示番荔枝ARF 蛋白的蛋白特性、氨基酸长度有较大差异,说明番荔枝ARF 家族蛋白的特性不一,可能具有多样化的生物学功能。本研究鉴定的番荔枝AFR 蛋白大部分含有3 个保守结构域,分别是DNA 结合结构域(DBD)、中间区域结构域(MR)和C-末端二聚化结构域(CTD),但AsARF3a、AsARF6a 和AsARF6b 等3 个成员仅有2 个保守结构域,CTD 结构域缺失,上述特性与前人研究的番木瓜、荔枝等[8, 18-19]ARF 家族蛋白的性质一致。研究表明,DBD 结构域具有DNA 结合活性,可以与生长素反应基因启动子上的作用元件结合,进而通过与MR 结构域激活或抑制相关基因的表达。CTD 结构域是一个介导蛋白质–蛋白质互作的结构域,另一个在生长素信号途径中起抑制作用的AUX/IAA 蛋白中也具有类似结构域,2 个蛋白可以通过该结构域的互作而形成ARF-ARF、ARF-Aux/IAA 和 Aux/IAA-Aux/IAA同源或異源寡聚体[8-9]。但番荔枝中AsARF3a、AsARF6a 和AsARF6b 的CTD 结构域缺失的ARF功能如何还有待进一步研究。
对番荔枝ARF 编码蛋白二级结构进行预测后发现,该基因编码的蛋白质中无规则卷曲所占比例最大,其次是-螺旋;在蛋白质三级结构中,发现番荔枝ARF 编码蛋白为多链折叠蛋白,以无规则卷曲为主,这与石榴和水仙[18-19]ARF 编码蛋白的二级、三级结构预测结果基本一致。根据ARF蛋白MR 的氨基酸组成,可以预测ARF 为转录抑制子或转录激活子。前人研究发现AtARF1、AtARF2、AtARF3、AtARF4 和AtARF9 蛋白非保守的中间区域富含甘氨酸(G)、丝氨酸(S)、亮氨酸(L)和脯氨酸(P)残基,能够发挥转录抑制作用,为转录抑制子,而AtARF5-8 和AtARF19中间区域富含谷氨酰胺(Q)、丝氨酸(S)和亮氨酸(L)残基,发挥转录激活作用,为转录激活子[20-22] 。本研究中, AsARF5a 、AsARF5b 、AsARF6c、AsARF6d、AsARF7 和AsARF16 蛋白的中间区域富含Q、S、L,推测这6 个蛋白可能为转录激活子。而AsARF2、AsARF3a、AsARF3b、AsARF6a 和AsARF6b 这5 个蛋白推测为转录抑制子。但是番荔枝ARF 家族基因中是促进或抑制生长素响应基因表达的具体功能分析还有待进一步探究。
亚细胞定位预测结果显示,番荔枝ARF 蛋白主要定位在细胞核中,具有转录因子的定位特征。对AsARF2、AsARF3a 和AsARF6a 蛋白的亚细胞定位试验结果也显示,AsARF2、AsARF3a 和AsARF6a 蛋白定位于细胞核,这与其他物种ARF蛋白定位[23-24]基本一致。
ARF 家族基因在花发育的过程中也发挥着重要的作用,拟南芥的AtARF2、AtARF5 可以调节雌性和雄性配子体发育[25],AtARF2 突变体表现出延迟开花的表型[26]。本研究中AtARF2 的同源基因AsARF2 主要在花蕾期表达,AtARF5 同源基因AsARF5a 、AsARF5b 主要在花芽期表达, 且AsARF2、AsARF5a 和AsARF5b 三个基因在正常花中的表达显著高于畸形花, 推测番荔枝AsARF2、AsARF5a 和AsARF5b 具有调控早期花发育和花器官的正常发育的功能。此外,有研究报道拟南芥中AtARF3 在花发育早期起到显著的作用[27]。番荔枝中AsARF3a 和AsARF3b 兩个基因的表达主要集中在花芽期,这说明AsARF3a 和AsARF3b 很可能也参与了早期花发育。在拟南芥中AtARF6 还被证实能够促进雄蕊花丝伸长、花药开裂和雌核成熟[28]。在其他物种中, 多个AtARF6 的同源基因得到了鉴定, 如辣椒CaARF6A、CaARF6B、CaARF6C,它们被证明参与了调控花发育与成熟过程[29]。在本研究中,AsARF6a 主要在花芽期高度表达,AsARF6b、AsARF6c 和AsARF6d 则多集中于花蕾期和开花前期表达,这在客观上证实了番荔枝这几个同源基因在维持花器官发育中起到一定的作用。同时AsARF6b、AsARF6c 在正常花中表达量高,而AsARF6a、AsARF6d 在畸形花中表达量更高,说明它们在花的正常发育中的具体功能可能不同。
4 结论
ARF 家族在植物生长和发育的整个过程中都发挥着重要的作用,本研究基于番荔枝花发育不同阶段转录组研究为背景,对ARF 家族基因进行筛选、生物信息学和表达模式分析。但由于番荔枝基因组数据缺乏和转录组测序的局限性,更多番荔枝ARF 家族基因还有待进一步挖掘鉴定,同时将来需要进行转基因试验等进行深入的功能验证分析,以揭示ARF 家族基因在花的正常发育中的具体功能。本研究结果为进一步了解番荔枝中ARF 转录因子家族成员调控花发育的相关机制奠定基础,并为解决番荔枝产业上出现的“花而不实”、结果率低等问题提供研究思路。

