聚酰胺微塑料对双酚A在地下水中迁移的影响
林宣浩,吴鸣*,卢国平,程洲,谢林君,吴宇恒,曾拥军,郝艳茹,莫测辉
(1.广东省环境污染与修复材料工程技术研究中心,暨南大学生命科学技术学院,广州 510632;2.广东省环境科学研究院,广州 510045)
全球每年使用塑料超过2.4亿t,随着塑料使用量的持续增长,微塑料引起的环境问题引起广泛的重视[1]。微塑料是指粒径小于5 mm的塑料颗粒,其中经过自然作用风干破碎后形成的粒径小于1 μm 的塑料颗粒被称为纳米塑料[23]。微塑料污染物的主要来源是个人护理用品中的细小塑料颗粒、大型塑料的降解和生活污水的排放,其中个人护理用品中的细小塑料颗粒称为初级微塑料,降解形成的微塑料称为次级微塑料[25]。这些细小的微塑料颗粒有很大一部分进入海洋、河流、土壤和地下水等环境,相关研究对海洋生物(如鱼类、贝类和海鸟)摄入微塑料早有报道[6-9]。目前对于微塑料污染的研究大部分集中在海洋领域,但近年来土壤-地下水中不断有微塑料被检出[1012]。微塑料按化学组成可分为聚乙烯(PE),聚氯乙烯(PVC),聚苯乙烯(PS),聚丙烯(PP),聚酰胺(PA),ABS 树脂等[8]。其中,PA 是在土壤-地下水系统中被大量检出的一种主要微塑料[13],其在土壤中的丰度可达14.7~158.5 个·kg-1,而在地下水环境中也可达15.2个·L-1,且检出微塑料颗粒一般具有较小的粒径(50~100 μm)[3,5]。微塑料颗粒进入地下水后,不仅可吸附重金属与有机污染物,而且可以作为污染物的载体增强污染物的扩散迁移能力,从而造成更严重的地下水污染,甚至污染地下饮用水源[13-18]。
双酚类化合物一般指具有两个羟苯基结构的化合物,其中双酚A(二酚基丙烷,2,2-双对酚丙烷,BPA)是其中世界上产量最高、用量最大、开始使用时间最早的一种双酚类化合物[19-20]。BPA 广泛应用于众多领域,如制造工程塑料、牙科复合材料、密封剂等[21-22]。BPA 已经被证实是一种内分泌干扰物[23-24],其在浓度为1 μg·m-3时仍然保持着雌性激素活性[25]。BPA能干扰机体的内分泌系统和生殖系统,破坏生物体内的激素平衡[22]。此外,BPA 可经过母体通过胎盘进入胎儿体内,对胎儿生长造成严重影响[25-27]。目前,全球每年BPA 产量高达700万t,导致大量BPA 进入到环境中造成严重的污染,并通过食物和饮用水对人类健康造成危害[21,23]。垃圾填埋场渗出液、河流、饮用水中检出的BPA 的最高检出浓度分别达17.2 mg·L-1、12 μg·L-1和0.1 μg·L-1[24]。BPA 对地下水资源和环境也造成了较大的影响,如美国地下水BPA平均检出浓度为0.004 1~1.9 mg·m-3;英国地下水中BPA 的检出浓度甚至高达20 mg·m-3[28]。目前对BPA在多孔介质中的迁移规律已展开部分研究,如BPA和BPS 在石英砂和石灰石多孔介质中的运移规律的研究[29-32]。这些研究结果表明,二甲苯对BPA 在石英砂中的迁移有着强烈的抑制作用,并且BPA 在石灰石多孔介质中的运移能力小于在石英砂中的运移能力。然而微塑料和BPA 在饱和多孔介质环境下的相互作用仍然不清楚,考察环境中的微塑料对BPA 在地下水中迁移的影响仍十分缺乏。
本研究针对微塑料对双酚类物质在地下水中运移的影响,选取PA 和BPA 作为典型微塑料和双酚类污染物,通过室内批实验和石英砂柱运移实验系统研究PA 对BPA 在饱和多孔介质中迁移的作用影响因素。本研究主要内容是:①PA对BPA吸附能力大小;②BPA 在含有PA 的饱和多孔介质中的运移规律;③微塑料含量、pH、流速、初始浓度和离子强度对BPA在含有PA的多孔介质中运移的影响。本研究结果将为阐明BPA 在PA 微塑料存在的多孔介质中的迁移提供理论和技术依据。
1 材料与方法
1.1 实验材料
实验所用微塑料聚酰胺-66(PA66,CAS 32131-17-2)购自中国杰诚塑化,粒径0.1 mm。BPA(CAS 80-05-7,>99%)购自上海阿拉丁生化科技股份有限公司。PA66 和BPA 分子结构见图1,分子式分别为(C12H22N2O2)n和C15H16O2。BPA溶液的配制方法是:准确称量100 mg BPA 溶于甲醇溶液中,并用超纯水稀释至1 L,稀释过程中保持甲醇溶液质量分数小于0.1%,得到100 mg·L-1BPA 溶液,置于4 ℃避光条件下保存。BPA在不同pH条件下的存在形式见图2。
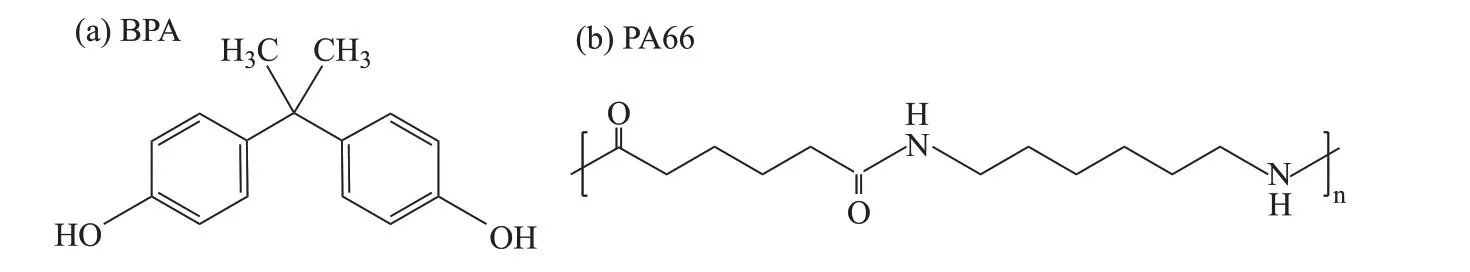
图1 BPA及PA66分子结构式Figure 1 Molecular structure of BPA and PA66
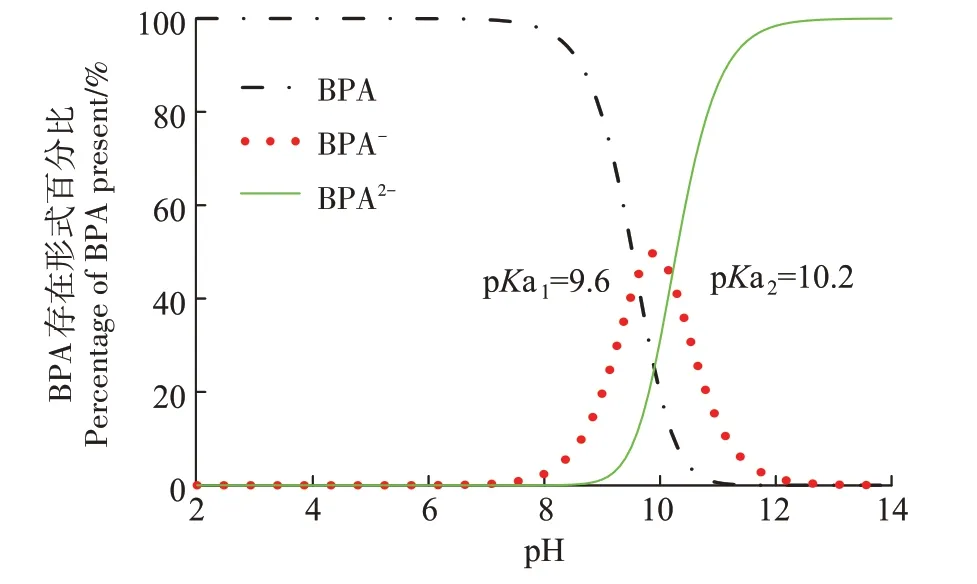
图2 不同pH条件下BPA的存在形式Figure 2 Species distribution of BPA at various pH values
通过柱实验研究BPA 在典型多孔介质中的迁移规律,其中使用石英砂作为典型多孔介质,粒径0.35~0.45 mm。在实验开始之前用自来水对石英砂进行冲洗,去除石英砂中大颗粒杂质,再用10%的硝酸浸泡24 h 去除石英砂表面的金属氧化物、有机物和其他杂质,最后用超纯水清洗至中性后在105 ℃下烘干备用。
1.2 材料的表征
将PA 微塑料颗粒干燥处理后,与溴化钾(KBr)按1∶100 比例混合后研磨成粉末,放入压片机制片后使用FTIR(Nicolet iS50,Thermo Fisher Nicolet,美国)测定其结构。
用导电胶带将未进行和进行过吸附实验的石英砂与PA 微塑料颗粒粘在样品台上,并进行喷金处理以提高材料导电性。使用SEM(Ultra-55,Zeiss,德国)观察其表面形态。
1.3 等温吸附实验
等温吸附实验使用50 mL 比色管作为反应容器,在比色管中加入25 mL 不同浓度的BPA 溶液(0、20、40、60、80、100 mg·L-1),准确称量0.1 g 的PA 微塑料颗粒或石英砂颗粒分别加入每种浓度的比色管中,在25 ℃、220 r·min-1的条件下振荡24 h 达到吸附平衡。使用带有0.22 μm 针头式过滤器的一次性注射器取样,通过紫外分光光度计测定(Lambda 365,PerkinElmer,美国)BPA浓度。每一个浓度重复实验3次。
PA微塑料颗粒对BPA的吸附量p0为:
式中:p0为PA对BPA的吸附量,mg·g-1;C0为BPA溶液的初始浓度,mg·L-1;C为吸附结束时BPA 浓度,mg·L-1;V为BPA溶液体积,mL;m为吸附质PA质量,g。
采用Langmuir 和Freundlich 等温吸附模型对测得样品数据进行分析。
Langmuir等温吸附模型:
式中:pm为PA 吸附BPA 的最大吸附量,mg·g-1;KL是Langmuir模型等温吸附常数。
Freundlich等温吸附模型:
式中:KF和n为Freundlich等温吸附模型常数。
1.4 动力学吸附实验
与等温吸附实验相同,动力学吸附实验使用50 mL 比色管作为反应容器。在比色管中加入25 mL 60 mg·L-1BPA 溶液,准确称量0.1 g 的PA 微塑料颗粒或石英砂颗粒,分别加入比色管,置于25 ℃、220 r·min-1条件下振荡吸附。在1、5、10、30、60、120、300、600 min 和1 440 min 时依照等温吸附实验中取样方法取样,并使用紫外分光光度计测定样品中BPA浓度。采用准一阶、准二阶动力学方程对动力学吸附过程进行模拟。
准一阶动力学方程:
准二阶动力学方程:
式中:p为PA 对BPA 的吸附 量,mg·g-1;pm是PA 对BPA 最大吸附量,mg·g-1;k1、k2分别是准一阶、准二阶动力学吸附方程的吸附常数。
1.5 柱实验
为了研究BPA 在PA 存在条件下的多孔介质中的迁移规律以及各种因素对其迁移效率的影响,进行BPA 迁移柱实验。BPA 的迁移实验在内径2.5 cm、长20 cm的玻璃柱内进行。采用湿法填柱将石英砂填满玻璃柱,先在玻璃柱中加入一定体积超纯水,再加入一定量石英砂(保持石英砂始终低于水位),重复装填至填满玻璃柱,装填过程中不断使用玻璃棒搅动石英砂以去除空气,并用小锤压实。石英砂柱孔隙度为0.45。在砂柱两端放置50 μm 滤网,从而使得石英砂柱中水流均匀。首先通入超纯水约10 h,以去除石英砂柱中杂质。实验开始后,通过精密蠕动泵依次注入10 孔隙体积(Pore volume,PV)背景溶液,1 PV 的BPA溶液和8 PV 的背景溶液,并在实验全程使用自动集样器对流出液进行自动取样收集,测定流出液样品中的BPA浓度。实验装置图如图3所示。
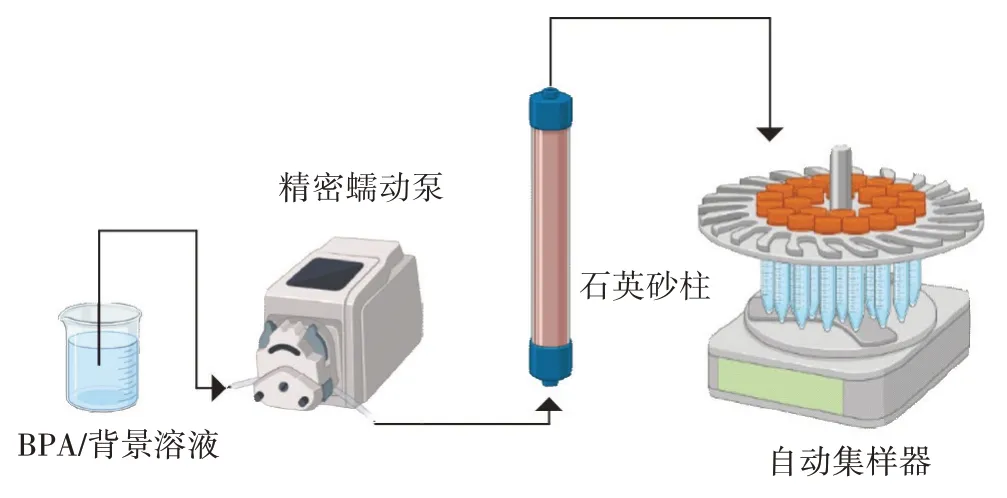
图3 柱实验装置图Figure 3 Device diagram of column experiment
2 结果与讨论
2.1 材料的表征
通过FTIR 对PA 吸附BPA 前后的表面官能团进行分析比较(图4),可见在3 435、1 541.5 cm-1和683.5 cm-1处分别是N--H 的伸缩振动与弯曲振动吸收峰;3 089、1 202 cm-1处分别为C--N 的耦合振动和伸缩振动吸收峰。在这几个特征峰处,可以发现吸附实验后的PA 吸收峰轻微向低波数方向偏移,且吸收峰强度降低,这是因为PA 表面酰胺键与BPA 上的羟基结合形成氢键。氢键的形成使得成键电子云密度降低,化学键力常数减少,伸缩振动吸收向低波数偏移,且吸收峰强度减弱。
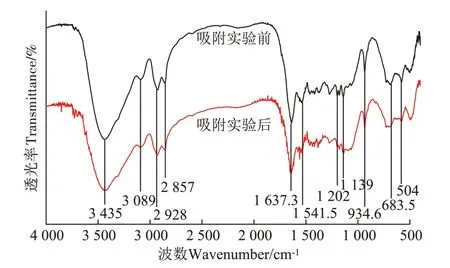
图4 吸附实验前后的PA微塑料颗粒的傅里叶变换红外光谱图Figure 4 FTIR spectra of PA before and after adsorption experiment
吸附实验前后的石英砂与PA微塑料颗粒的SEM图像如图5 所示。图中可见石英砂表面较为光滑平坦(图5a),不具备对BPA 的吸附条件,且在吸附实验后并没有发现BPA 粒子吸附在其表面。而PA 微塑料颗粒表面有较多褶皱、凸起与颗粒,为吸附BPA 提供了较好的条件。由图5d 可见,有较多BPA 吸附在PA微塑料表面,表明PA对BPA具有较好的吸附作用。

图5 (a)石英砂和PA微塑料的扫描电镜图像,(b)吸附实验前的石英砂与PA颗粒;(c),(d)吸附实验后的石英砂与PA颗粒Figure 5 (a)SEM Image of quartz sand and PA,(b)before adsorption experiment,(c)(d)after adsorption experiment
图6a 是PA 和石英砂对BPA 的等温吸附结果。从图6a 可看出,PA 颗粒对BPA 的吸附作用明显,且吸附量随着BPA 浓度的升高持续变大。在BPA 浓度较小时,吸附量较小,这是因为在低BPA 浓度下,PA吸附位点不足以被占满,未被充分利用。在BPA 浓度升高后,吸附位点逐渐被利用,吸附量增大。图中未出现明显极大值,表明PA 对BPA 的吸附能力尚未达到极大值。然而石英砂对BPA 的吸附几乎为0,表明石英砂对BPA 并无显著吸附作用。PA 对BPA 较强的吸附作用主要是由于PA 表面存在酰胺键[--C(O)NH--]可以作为氢键的受体,而BPA 中含有羟基(--OH)可以作为氢键的供体。而氢键作用(2~40 kJ·mol-1)远大于疏水作用(5 kJ·mol-1),所以PA对BPA有着较强的吸附能力[33]。
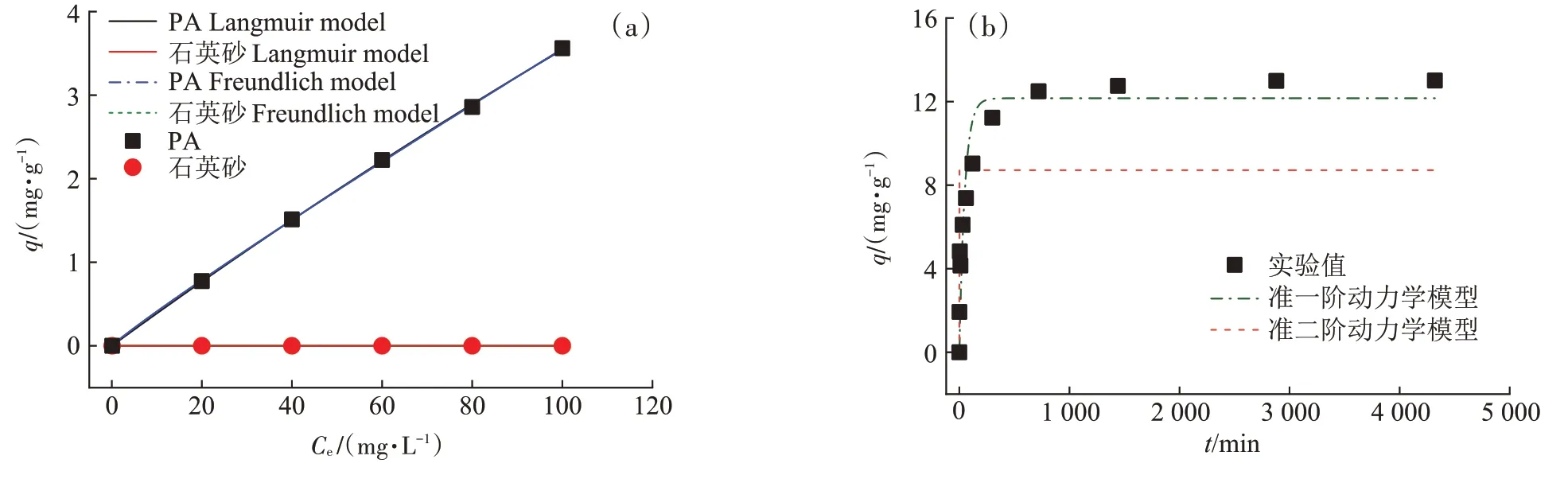
图6 (a)BPA在PA和石英砂颗粒的等温吸附模型(b)BPA在PA颗粒上的准一阶和准二阶动力学吸附模型Figure 6 (a)Sorption isotherms model of BPA on PA and quartz sand(b)Pseudo-first-order and pseudo-second-order model of BPA on PA
由图6a 可知,BPA 在PA 微塑料以及石英砂上的等温吸附可以被Langmuir 模型和Freundlich 模型很好地模拟,由表1 可见,Langmuir 模型和Freundlich 模型的相关系数R2均在0.99 以上。Langmuir 模型拟合结果良好,这表明BPA 在PA 上的吸附为单层化学吸附,这与二者通过氢键作用吸附的结果相符合。图6b 是BPA 在PA 上的动力学吸附曲线。从图中可以看出,BPA 在PA 微塑料颗粒上被迅速吸附,在720 min 时接近吸附平衡,最大吸附量为13 mg·g-1。在反应时间t=300 min 时,BPA 在PA 上的吸附量已经超过吸附总量的90%。采用准一阶、准二阶动力学方程对吸附过程进行模拟,其拟合曲线与相关拟合参数见图6b 和表2。由表2 中数据可知,准一阶动力学模型的相关系数R2(0.826)远大于准二阶动力学模型(0.299),可见BPA 在PA 塑料颗粒上的吸附更适合由准一阶动力学模型描述。
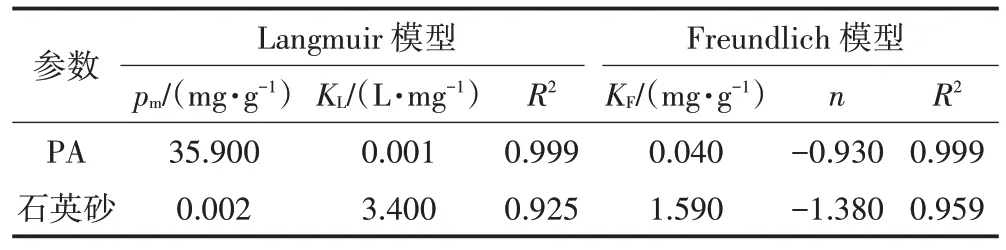
表1 BPA在PA微塑料和石英砂上的吸附热力学参数拟合Table 1 Parameters of isotherm models for the adsorption of BPA on PA and quartz sand

表2 BPA在PA微塑料上的动力学吸附参数拟合Table 2 Paraments of kinetics models for the adsorption of BPA on PA microplastics
2.2 PA在石英砂柱中含量对BPA运移的影响
当石英砂柱中PA 的质量分数从0% 增大到0.3%,所得BPA 在石英砂柱中的穿透曲线(BTCs)如图7a 所示。由图可知,随着石英砂柱中PA 含量的增大,BPA 穿透率明显降低。PA 含量为0%时,BPA 穿透率最大可达90%。当PA 含量增至0.3%时,穿透率降低至21%。此外,随着PA含量的增加,穿透曲线拖尾现象更加明显,在通入8 PV 溶液时,含有0.3% PA组的出流液中BPA 浓度是不含PA 组的10 倍。以上实验结果表明,PA 对于BPA 在饱和多孔介质中的迁移有着明显的吸附与截留作用。且PA 的含量越大,对BPA的吸附与截留作用越明显。
2.3 pH对BPA运移的影响
通过改变实验初始pH(3、5、7、9、11),得到不同pH 下的BPA 穿透曲线如图7b 所示。当背景溶液从弱酸性逐渐增大到中性、弱碱性时,BPA 穿透率基本没有改变,维持在40%左右。当背景溶液pH 为3时,BPA 穿透率略微提高,达到49%。这可能是由于低pH条件下,背景溶液中含有的大量H+抢占了PA颗粒表面的吸附位点,导致部分BPA 无法被吸附。当背景溶液pH 增大至11 时,BPA 穿透率大幅上升,达到94%,根据图2 可知,BPA 存在2 个pKa,BPA 在不同pH 条件下有3 种不同的存在形式。pH 较低时,溶液中BPA 以分子态BPA 为主;当pH 增大,溶液中离子态BPA 含量增多。当背景溶液pH 逐渐增大时,BPA分子上的两个羟基电离出H+,当pH>10.2 时,溶液以Bis(OH)O-和BisO22-为主,PA 表面的酰胺键无法与BPA 表面羟基形成氢键,导致BPA 无法吸附在PA 表面[33-35]。
2.4 BPA浓度对其运移的影响
不同浓度的BPA 在含有PA 微塑料的饱和多孔介质的穿透曲线如图7c所示。可见当溶液中BPA 浓度改变时,石英砂柱流出液穿透率并不随之改变,其穿透率范围在43.7%~49.9%。这与等温吸附实验结果相符,即吸附量p0与BPA 浓度C0几乎呈线性关系。所以改变BPA 浓度,穿透率并没有改变。此外,随着BPA 浓度的增大,穿透曲线的拖尾现象逐渐减弱,这是因为在更高的BPA 浓度下,PA 表面的吸附位点会被BPA 更快速地占满[22,36],从而导致更高浓度的BPA溶液会更快地流出,并降低后续拖尾程度。
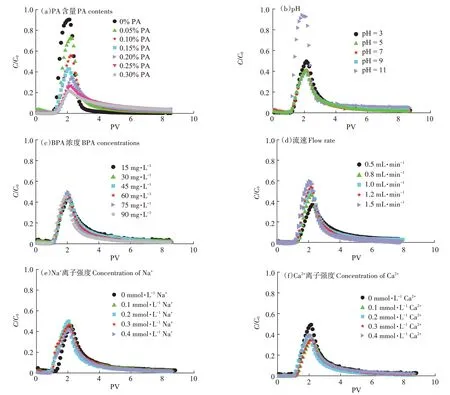
图7 BPA在不同条件下的穿透曲线Figure 7 BTCs of BPA under different conditions
2.5 流速对BPA运移的影响
改变通入BPA 溶液和背景溶液流速(0.5、0.8、1.0、1.2、1.5 mL·min-1)得到穿透曲线如图7d 所示。由图可以看出,流速对BPA 运移有明显影响。在不同流速条件下,BPA 在石英砂柱中穿透率有较大变化。当流速在0.5 mL·min-1时,穿透率较小,仅36%。流速逐渐增大时,穿透率也逐渐增大。当流速达到1.5 mL·min-1,穿透率增至59%。这些结果表明,高流速能明显增大BPA 在多孔介质中的穿透率。这是由于在流速较慢的条件下,BPA 与多孔介质中的PA 颗粒有更多接触时间。BPA 在PA 表面的吸附更充分、更完全。另外,流速增大会加大水流的剪切作用力,使部分已附着在介质表面的BPA 重新回到溶液中,使得穿透率增大[36-37]。
2.6 离子类型以及离子强度对BPA运移的影响
在不同离子种类以及离子强度(IS)条件下的穿透曲线如图7e、图7f 所示。由图可见,在相同离子强度下(0.3 mmol·L-1),Ca2+对BPA在饱和多孔介质中的穿透率(36%)的影响明显大于Na+对BPA 穿透率(46%)的影响。此外,当背景溶液Ca2+浓度从0 增大到0.1 mmol·L-1时,BPA穿透率从49%降低到36%,以上结果表明Ca2+能明显抑制BPA 在含有PA 颗粒的饱和多孔介质中的运移,这是由于二价阳离子会在BPA与介质之间形成阳离子桥,降低两者之间静电力,增大BPA 在介质表面沉积,降低迁移率。背景溶液Na+、Ca2+离子强度从0.1 mmol·L-1增加到0.4 mmol·L-1时,穿透率区间分别为42%~50%和31%~38%,这表明离子类型对BPA 运移的影响比离子强度对其影响更加明显。这是由于BPA 主要以不带电或部分带电的形式存在于溶液中,所以改变离子强度对其在饱和多孔介质中的运移或保留影响较小[32,38]。
3 结论
(1)聚酰胺微塑料(PA)对双酚A(BPA)的吸附能力远大于石英砂,Langmuir 模型和Freundlich 模型对BPA 在PA 和石英砂上的等温吸附模拟结果均较好,准一阶动力学吸附模型模拟结果优于准二阶动力学吸附模型。
(2)增大石英砂柱内PA含量,BPA的穿透率明显降低。改变BPA 原始浓度则对其穿透率无明显影响;当pH<10.2 时,改变pH,BPA 在石英砂柱中穿透率无明显变化;当pH>10.2 时,由于BPA 发生水解作用,BPA 分子上两个羟基电离出H+导致无法与PA 形成氢键吸附在PA 上,BPA 在石英砂柱中的穿透率大幅增大。提高溶液注入流速,由于BPA 与多孔介质和PA 接触时间降低而导致其穿透率大幅增大;改变背景溶液离子种类与强度,Ca2+明显增强PA 对BPA的吸附作用,Na+则基本没有影响。改变离子强度对其吸附作用影响较小。

