玉米幼苗根系对Cr(Ⅲ)的吸收动力学特征及途径探讨
居静,王欣,陈永林,盛海君,汪晓丽,赵海涛*
(1.农业农村部耕地质量监测与评价重点实验室,扬州大学,江苏 扬州 225127;2.句容市农业技术推广中心,江苏 镇江 212499)
土壤重金属污染涉及食品安全和人类健康,已成为全人类近年来共同关心和亟待解决的世界性重大环境问题。铬(Cr)位于元素周期表第四周期第六副族,是硬度最大的金属。Cr 由于其广泛的工业应用,已成为地下水、土壤及沉积物中第二常见的重金属污染物[1],也是我国实行重点防控的五种主要重金属污染物之一[2]。据统计我国严重Cr 污染的土壤已超过1 250 万t[3]。在自然界中Cr 拥有不同的价态(-2~+6),其中三价[Cr(Ⅲ)]和六价[Cr(Ⅵ)]是最稳定和最常见的形态。因土壤对Cr(Ⅵ)吸附力较弱,其具有较高的生物活性,无论对动物还是植物都具有毒性;而Cr(Ⅲ)进入土壤后一般会以沉淀形式存在,或被土壤黏粒吸附,在土壤中溶解度小、移动性差,所以能稳定存在,是一种对人类和动物健康至关重要的微量元素[4],却不是植物必需营养元素[5]。前人对Cr(Ⅵ)的研究较多[6-7],而对Cr(Ⅲ)研究甚少。低浓度的Cr(Ⅲ)能促进植株的生长[8],但高浓度时对植物有剧毒[9-10],会抑制植物发芽、根系生长、幼苗生长和发育,诱导叶片失绿等。因此,为了采取针对性的措施减轻土壤中Cr(Ⅲ)污染对植物生长发育造成的危害,有必要充分研究Cr(Ⅲ)对植物的影响。吸收是重金属元素在植物体内富集的第一步骤,然而,目前关于植物吸收Cr(Ⅲ)的生理机制仍不清楚[1]。Skeffington等[11]认为,Cr(Ⅲ)只是在细胞壁的阳离子交换位点被简单地被动吸收。Barros 等[12]发现植物对Cr(Ⅲ)的吸收是通过渗透进行的。Shahid 等[13]指出Cr(Ⅲ)的吸收是不消耗能量的,但张学洪等[14]认为Cr超富集植株李氏禾对Cr(Ⅲ)的吸收可能存在需要能量的主动吸收过程。因此,目前对Cr(Ⅲ)进入植物根细胞内的方式还存在争议。根的细胞质膜是与重金属接触的第一个功能结构[15],并在金属吸收中发挥着至关重要的作用[16]。目前人们对金属通过何种通道进入细胞质膜内部有了一定的认识。一般认为,植物对非必需有毒元素的吸收是通过必需元素的吸收途径进行的。Lindberg 等[17]对Cd2+进入小麦细胞质膜的机制进行研究后发现,Cd2+的吸收受到加入的氯化钙和氯化钾的抑制,也受到钙离子通道抑制剂和钾离子通道抑制剂的抑制,说明Cd2+通过Ca2+和K+的通道被吸收。Ivashikina 等[18]利用从拟南芥根分离出的原生质体对重金属阳离子是否影响向内钾通道的活性和电流及电压等进行研究,发现重金属阳离子可以阻止向内钾电流的20%~70%,其阻止能力排序为:Cu2+>Zn2+>Sr2+>Cd2+,由此推测,以上这些重金属离子至少是部分通过K+通道进行吸收的。唐晓勇等[19]验证了Fe 元素对Cr 元素的荧光有增强效应,并发现该增强效应还与Fe、Cr 元素的相互作用有关。Bonet 等[20]研究发现,Fe 的营养状况可影响Cr 在植物根和地上部分的积累。Ramana等[21]认为Cr(Ⅲ)和Fe(Ⅲ)竞争根细胞膜上的吸收位点,从而使两种离子的吸收存在拮抗效应。Liu 等[22]在Cr 超富集植物李氏禾上观察到,Cr(Ⅲ)对Fe(Ⅲ)的吸收存在抑制作用。因此,对Cr(Ⅲ)进入细胞质膜的途径需要进一步论证。
鉴于此,本研究通过水培实验,探究不同Cr(Ⅲ)浓度对玉米幼苗Cr(Ⅲ)吸收的影响,以及ATP 酶抑制剂、Ca2+通道和K+通道抑制剂、Fe(Ⅲ)是否抑制玉米幼苗根系对Cr(Ⅲ)的吸收,旨在探讨玉米幼苗根系对Cr(Ⅲ)的吸收动力学特征及途径。
1 材料与方法
1.1 材料与培养
试验在扬州大学环境科学与工程学院养苗室进行,供试材料为玉米苏玉20。玉米种子经浸泡、催芽、发芽、生长至一叶一心时,移栽至50% Hoagland营养液中培养7 d,保持间隙通气20 min·h-1,每3 d更新一次营养液。营养液组成:Ca(NO3)2·4H2O 2.0 mmol·L-1、KNO30.5 mmol·L-1、KH2PO40.5 mmol·L-1、MgSO4·7H2O 1.0 mmol·L-1、H3BO34.6×10-2mmol·L-1、CuSO4·5H2O 3.0×10-4mmol·L-1、MnSO4·4H2O 9.1×10-3mmol · L-1、ZnSO4· 7H2O 7.7 × 10-4mmol · L-1、(NH4)6Mo7O24·4H2O 7.1×10-5mmol·L-1、EDTA-Fe 7.0×10-2mmol·L-1,用0.1 mol·L-1的NaOH 或0.1 mol·L-1的HCl调节pH至5.5左右。
1.2 试验设计与测定内容
1.2.1 玉米幼苗对Cr(Ⅲ)的吸收
将在50% Hoagland 营养液培养7 d 后的玉米幼苗移栽到水培容器中,水培容器为直径20 cm、高48 cm 的塑料圆桶,桶上有带7 个孔的同质塑料圆盖,根据文献[14,22]及前期试验结果[23],本研究对玉米幼苗进行5 个浓度水平的Cr(Ⅲ)处理:0、2、5、10、20 mg·L-1(以Cr 计),Cr(Ⅲ)以CrCl3形式添加,每处理7 株,重复3 次,每3 d 换一次营养液,营养液pH 值调节为5.0~5.5。处理10 d 后取出玉米幼苗,用10 mmol·L-1EDTA 浸洗3 次,以去除玉米根系表面吸附的Cr 离子,再将植株分为根系和地上部分,并对各部分的鲜质量进行称量,采用原子吸收分光光度法测定玉米根系和地上部鲜样中Cr的含量。
1.2.2 ATP酶抑制剂对玉米幼苗根系Cr(Ⅲ)吸收的影响
将在50% Hoagland 营养液培养7 d 后的玉米幼苗移栽到装有20%Hoagland 营养液的容器中预培养12 h,根据文献[14,22]及前期试验对玉米幼苗进行如下处理:①15.6 mg·L-1CrCl3(对照);②15.6 mg·L-1CrCl3+25 μmol·L-1ATP 酶抑制剂(Na3VO4);③15.6 mg L-1CrCl3+50 μmol·L-1ATP 酶抑制剂(Na3VO4)。24 h 后收获玉米幼苗的根,用10 mmol·L-1EDTA 浸洗3 次,以去除玉米根系表面吸附的Cr 离子,采用原子吸收分光光度法测定根系Cr的含量。
1.2.3 离子通道抑制剂对玉米幼苗根系Cr(Ⅲ)吸收的影响
将在50% Hoagland 营养液培养7 d 后的玉米幼苗移栽到装有20%Hoagland 营养液的容器中预培养12 h。根据文献[14,22]及前期试验对玉米幼苗进行如下处理:①15.6 mg·L-1CrCl3(对照);②15.6 mg·L-1CrCl3+Ca2+通道抑制剂(1 mmol·L-1LaCl3);③15.6 mg·L-1CrCl3+K+通道抑制剂(1 mmol·L-1C8H20CIN)。分别与4 h 和8 h 收获玉米幼苗的根,用10 mmol·L-1EDTA 浸洗3 次,以去除玉米根系表面吸附的Cr 离子,采用原子吸收分光光度法测定根系Cr、Ca 的含量,采用火焰光度法测定K的含量。
1.2.4 Fe(Ⅲ)对玉米幼苗根系Cr(Ⅲ)吸收的影响
将在50% Hoagland 营养液培养7 d 的玉米幼苗分成3组放入不同营养液中进行处理:①完全缺Fe的20% Hoagland 营养液(-Fe);②正常的20% Hoagland营养液(Normal);③在正常的20%Hoagland营养液中加入15 mg·L-1的FeCl3(+Fe),预培养48 h 后,分别将0、10、20、40、80、160 mg·L-1的CrCl3加入这3 组处理中,4 h后收获玉米幼苗的根,用10 mmol·L-1EDTA 浸洗3 次,以去除玉米幼苗根系表面吸附的Cr 离子,采用原子吸收分光光度法测定根系中Cr的含量。
1.3 数据分析与统计方法
本文数据为3 个独立重复的平均值±标准差(STDEV)。采用Excel 2016 进行数据处理。用SPSS 23.0软件进行方差分析,处理间的多重比较采用Duncan 法。玉米幼苗对Cr(Ⅲ)吸收的动力学曲线采用Origin Pro2021 软件模拟Michaelis-Menten 方程f=Vmax×abs(x)/[Km+abs(x)],abs(x)为底物浓度,Vmax为玉米幼苗对Cr(Ⅲ)的最大吸收速率,Km为米氏常数。
2 结果与分析
2.1 玉米幼苗对Cr(Ⅲ)吸收的动力学特征
玉米幼苗各部位对Cr(Ⅲ)吸收的动力学曲线见图1。结果表明,玉米幼苗各部位对Cr的吸收动态均符合Michaelis-Menten 模拟曲线方程f=Vmax×abs(x)/[Km+abs(x)]特征。玉米幼苗各部位对Cr(Ⅲ)的吸收速率均随着Cr(Ⅲ)处理浓度的增加而增加(图1),对Cr(Ⅲ)吸收速率表现为:根系>全株>地上部。
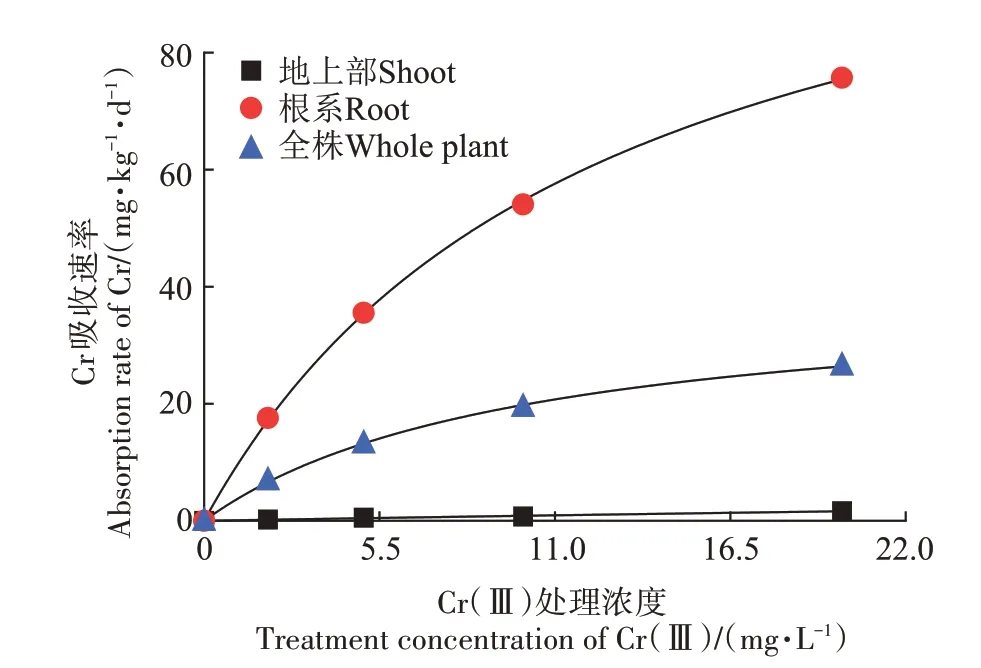
图1 玉米幼苗对Cr(Ⅲ)吸收的动力学曲线Figure 1 Kinetic curves of Cr(Ⅲ)uptake by maize seedlings
表1 为玉米幼苗对Cr(Ⅲ)吸收的动力学方程参数。Km表征离子载体与离子的亲和力,Km值越大,亲和力越小。结果表明,根系吸收Cr(Ⅲ)的Vmax为121.4 mg·kg-1·d-1,明显高于地上部的16.3 mg·kg-1·d-1(P<0.05),前者是后者的7.4倍;而根系吸收Cr(Ⅲ)的Km为12.2 mg·L-1,显著(P<0.05)低于地上部的180.8 mg·L-1,表明Cr(Ⅲ)与根系的亲和力大于地上部。此结果说明,玉米幼苗吸收的Cr(Ⅲ)绝大部分累积在根系,只有很少的Cr(Ⅲ)被转移到地上部。
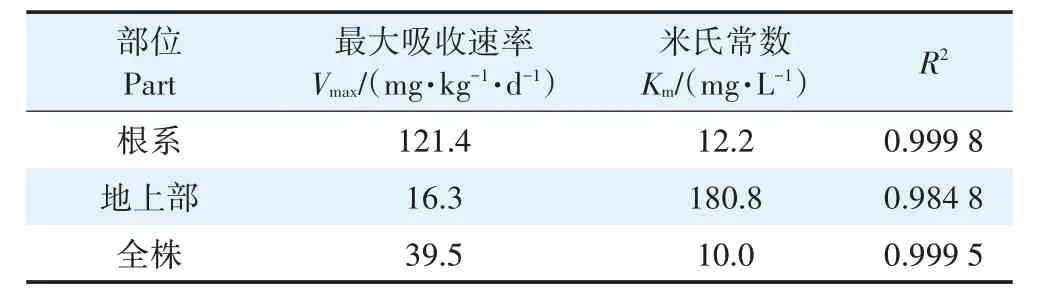
表1 玉米幼苗对Cr(Ⅲ)吸收的动力学方程参数Table 1 Kinetic parameters of Cr(Ⅲ)uptake by maize seedlings
2.2 ATP酶抑制剂对玉米幼苗根系Cr(Ⅲ)吸收的影响
由图2 可知,与对照相比,添加不同浓度的ATP酶抑制剂处理均显著(P<0.05)抑制了玉米幼苗根系对Cr 的吸收。25 μmol·L-1和50 μmol·L-1ATP 酶抑制剂处理后,玉米根系中Cr 的含量较对照分别降低了29.4%和50.6%。50 μmol·L-1ATP酶抑制剂的对玉米根系吸收Cr 的抑制作用大于25 μmol·L-1ATP 酶抑制。此结果说明,玉米幼苗根系对Cr(Ⅲ)的吸收存在主动吸收的过程。
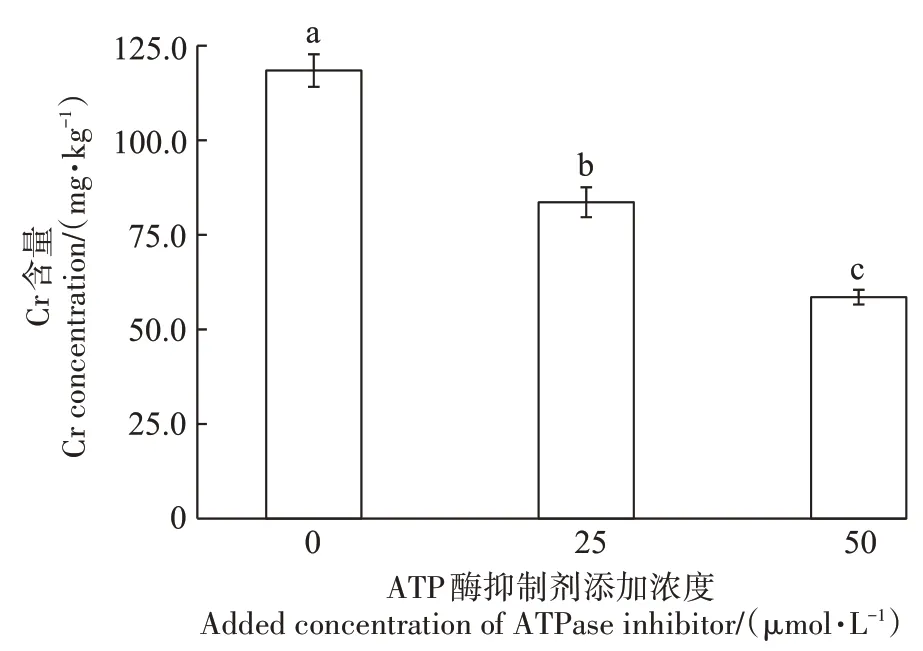
图2 不同ATP酶抑制剂添加浓度对玉米幼苗根系Cr吸收的影响Figure 2 Effects of ATPase inhibitor on uptake of Cr(Ⅲ)by maize seedling root
2.3 离子通道抑制剂对玉米幼苗根系Cr(Ⅲ)吸收的影响
由图3 可知,4 h 和8 h 抑制处理下,Ca2+通道抑制剂(LaCl3)和K+通道抑制剂(C8H20CIN)均没有显著(P>0.05)抑制玉米幼苗根系对Cr(Ⅲ)的吸收。Ca2+通道抑制剂显著(P<0.05)抑制了玉米幼苗根系对Ca2+的吸收,同样K+通道抑制剂显著(P<0.05)抑制了玉米幼苗根系对K+的吸收(表2)。此结果表明,玉米幼苗根系对Cr(Ⅲ)的吸收与Ca2+、K+通道无关。
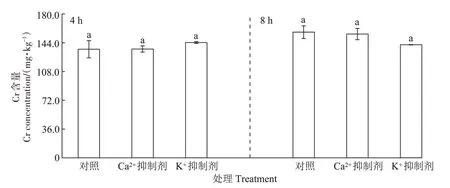
图3 离子通道抑制剂对玉米幼苗根系Cr(Ⅲ)吸收的影响Figure 3 Effects of ion channel blockers on the uptake of Cr(Ⅲ)by maize seedling root
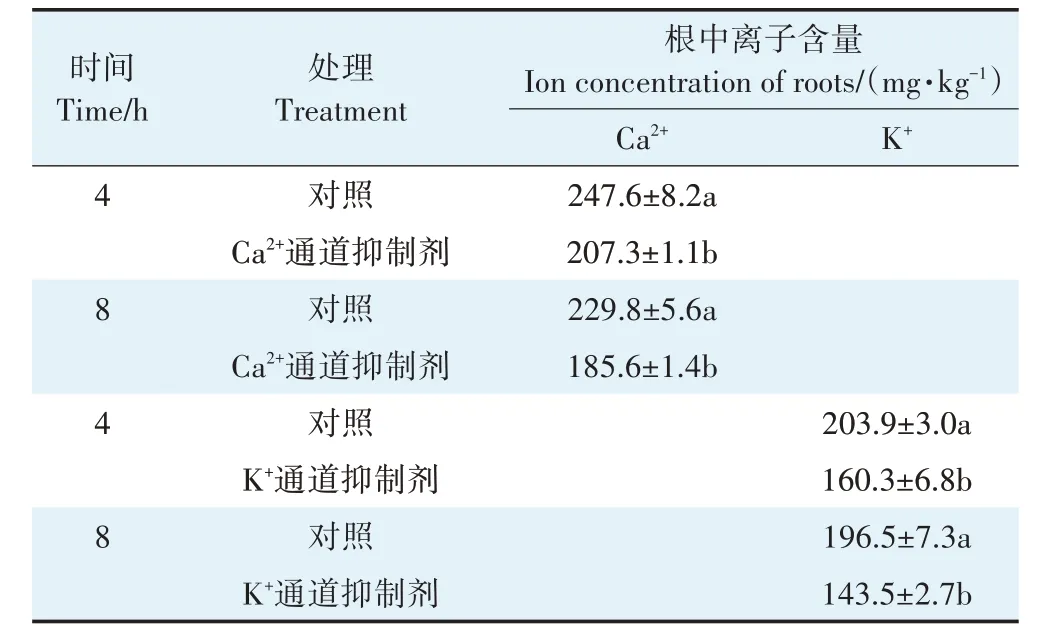
表2 离子通道抑制剂对玉米幼苗根系吸收Ca2+和K+的影响Table 2 Effects of ion channel blockers on the uptake of Ca2+and K+by maize seedling root
2.4 Fe(Ⅲ)对玉米幼苗根系吸收Cr(Ⅲ)的影响
图4 结果表明,在-Fe、Normal、+Fe 各处理下,玉米幼苗根系对Cr(Ⅲ)的吸收速率均随着Cr(Ⅲ)处理浓度的增加而增加,其吸收动态均符合Michaelis-Menten 方程。Cr(Ⅲ)处理浓度为40~160 mg·L-1时,与Normal 处理相比,-Fe 处理下Cr(Ⅲ)吸收速率增加了4.0%~26.3%,但+Fe 处理下Cr(Ⅲ)吸收速率降低了15.6%~33.7%。
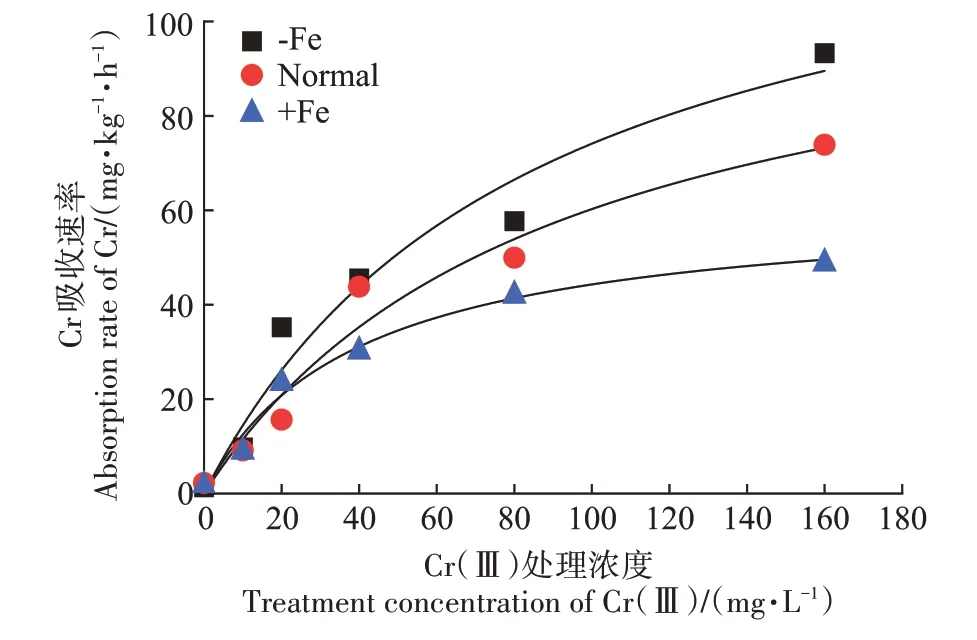
图4 不同Fe处理对玉米幼苗根系吸收Cr(Ⅲ)动力学曲线Figure 4 Kinetic curves of Cr(Ⅲ)uptake by maize seedling root under different Fe treatments
表3 结果表明,与Normal 处理相比,-Fe 处理下,玉米幼苗根系对Cr(Ⅲ)的Vmax增加了20.0%,Km数值仅减少了5%,-Fe 处理促进了玉米幼苗根系对Cr(Ⅲ)的吸收速率,略微增加了Cr(Ⅲ)与玉米幼苗根系吸收位点的亲和力,而+Fe 处理下的玉米幼苗根系对Cr(Ⅲ)的Vmax减少了46.0%,Km数值减少了56.0%,-Fe 和+Fe处理下Vmax/Km数值基本不变。以上结果表明,Fe(Ⅲ)抑制了玉米幼苗根系对Cr(Ⅲ)的吸收速率,Fe(Ⅲ)与Cr(Ⅲ)之间存在反竞争性的抑制关系。
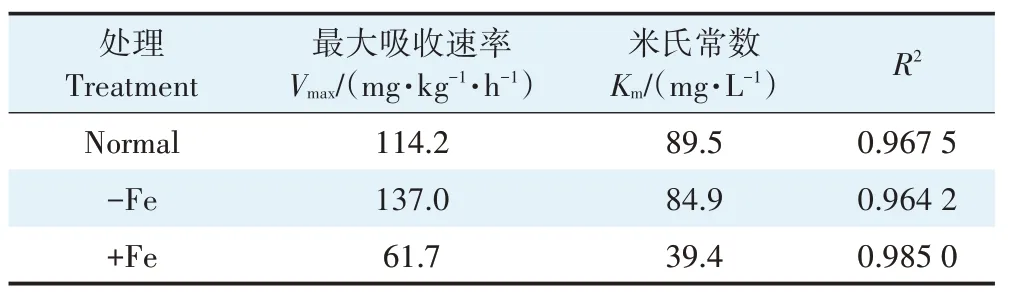
表3 不同Fe处理下玉米幼苗根系对Cr吸收的动力学方程参数Table 3 Michaelis-Menten equation constants of Cr uptake by maize seedling roots under different Fe treatments
3 讨论
3.1 玉米幼苗对Cr(Ⅲ)吸收的动力学特征
目前,植株对Cr(Ⅲ)的吸收和分布机制仍未被完全了解[16]。Wu 等[24]研究了不同CrCl3处理浓度(0、2.5、5、10 mg·L-1)对白菜不同部位Cr 含量的影响,发现与白菜茎秆相比,根系Cr 含量增加了两倍。另有研究将一些大型植物(水花生、空心莲子草、疏螺旋体、铁蓼和凤眼莲)暴露于25 mg·L-1和50 mg·L-1的CrCl3中,同样观察到根系中Cr 含量远高于茎秆和叶片的现象,且在叶片中发现的Cr 含量几乎可以忽略不计[25]。但张学洪等[14]研究发现,李氏禾中大约有一半的Cr 被转移到地上部分,表明Cr 在李氏禾根部的移动性比较好,这可能与李氏禾是Cr 超富集植株有关。本研究发现,经不同浓度Cr(Ⅲ)(0、2、5、10、20 mg·L-1)处理10 d 后,玉米幼苗对Cr(Ⅲ)的吸收速率随溶液中Cr(Ⅲ)浓度的变化趋势符合Michaelis-Menten 方程,各部位对Cr(Ⅲ)的吸收速率均随着Cr(Ⅲ)处理浓度的增加而增加,玉米幼苗根系对Cr(Ⅲ)的吸收速率显著高于地上部(图1),且Cr(Ⅲ)与根系的亲和力显著高于地上部(表1),表明玉米幼苗吸收的Cr(Ⅲ)绝大部分都分布在根系,从根系转移到地上部的非常有限,这可能是因为非Cr 富集植物缺乏对Cr的转运机制。
3.2 玉米幼苗根系对Cr(Ⅲ)的吸收途径
本研究发现玉米幼苗吸收的Cr(Ⅲ)主要富集在根部,很少往地上部运输,因此重点研究玉米幼苗根系对Cr(Ⅲ)的吸收途径,但目前植物对Cr(Ⅲ)的吸收是主动吸收还是被动吸收,一直存在争议。ATP酶包括P 型和V 型,其中P 型ATP 酶易被Na3VO3抑制,在植物体内广泛存在[14],本试验中,在15.6 mg·L-1CrCl3处理下,不同浓度ATP 酶抑制剂均对玉米幼苗根系吸收Cr(Ⅲ)有明显的抑制作用,表明玉米幼苗根系对Cr(Ⅲ)的吸收与能量有关,存在着主动吸收的过程,这与Skeffington 等[11]以大麦为研究对象开展的试验结果相反,但与Liu 等[22]以李氏禾为研究对象开展的试验结果一致。玉米植株对Cr(Ⅲ)主动吸收的方式让其从土壤中吸收更多的Cr(Ⅲ),并在玉米根系中累积,产生毒害作用,从而影响玉米植株的生长发育。
由于Cr(Ⅲ)不是植物的必需营养元素,因此,植物对Cr(Ⅲ)的吸收可能是通过必需营养元素的途径(如某些阳离子通道)进入细胞质膜[14]。前人研究发现,Ca2+和K+通道是细胞质膜上最重要的两个离子通道[14,26],可以分别被Ca2+通道抑制剂与K+通道抑制剂抑制。本研究发现,两种抑制剂均没有抑制玉米幼苗根系对Cr的吸收,但明显抑制了玉米幼苗根系对Ca2+和K+的吸收,说明玉米幼苗根系对Cr(Ⅲ)的吸收不是通过Ca2+通道或者K+通道实现的。离子通道是细胞膜上的特殊蛋白质大分子,在脂质双层膜上构成具有高度选择性的亲水孔道,从而允许适当大小和适当电荷的离子通过,其对通过的离子具有一定的选择性。玉米对Cr(Ⅲ)的吸收没有通过Ca2+和K+通道实现,表明其可能是通过其他的离子通道实现的。Cr(Ⅲ)和Fe(Ⅲ)有着相同的价态和相似的离子半径(分别为64 Å 和69 Å)。Bonet 等[20]研究发现,Fe的营养状况可影响Cr 在植物根和地上部分的积累;Pandey 等[27]研究发现Cr 胁迫下植株叶片的Fe 含量减少约50%。Liu 等[28]发现,在不同浓度Cr 处理中,Fe、Cu、Mg 和Zn 含量均有所下降。Park[29]发现,Cr(Ⅲ)处理降低了生菜对Fe 的吸收。本课题组前期研究发现,当Cr(Ⅲ)浓度>5 mg·L-1时,玉米幼苗叶绿素含量随着处理浓度的升高而降低,叶片表现出“失绿”症状[23],且随着Cr(Ⅲ)处理浓度的增加,玉米幼苗根系、叶片和全株的Fe 含量和累积量呈现下降的趋势,这个结果说明Cr(Ⅲ)抑制了玉米幼苗对Fe 的吸收,推测玉米幼苗根系对Cr(Ⅲ)的吸收途径可能与Fe(Ⅲ)有关。因此,本研究中采用-Fe 营养液、正常营养液、+Fe 营养液处理玉米植株,发现与正常营养液处理相比,-Fe处理下,玉米幼苗根系对Cr(Ⅲ)的Vmax增加了20.0%,Km数值仅减少了5%,-Fe 处理促进了玉米幼苗根系对Cr(Ⅲ)的吸收速率,略微增加了Cr(Ⅲ)与玉米幼苗根系吸收位点的亲和力,而Fe(Ⅲ)处理下的玉米幼苗根系对Cr(Ⅲ)的Vmax减少了46.0%,Km数值减少了56.0%,这表明Fe(Ⅲ)抑制了玉米幼苗根系对Cr(Ⅲ)的吸收速率,两者之间存在反竞争性的抑制关系(图4、表3)。Fe(Ⅲ)究竟通过哪些关键因素影响了Cr(Ⅲ)的吸收速率尚不明确。因此,下一步的研究中,需明确Fe(Ⅲ)和Cr(Ⅲ)之间相互影响的深层次的生理机制,以期能为减轻Cr(Ⅲ)对植物危害的营养吸收的调节、对逆境环境的适应性等方面的改造提供科学参考。
4 结论
(1)玉米幼苗对Cr(Ⅲ)的吸收动态符合Michaelis-Menten 方程。根系对Cr(Ⅲ)的吸收速率显著高于地上部,Cr(Ⅲ)与根系的亲合力大于地上部。
(2)玉米幼苗根系对Cr(Ⅲ)的吸收存在主动吸收的过程。
(3)玉米幼苗根系对Cr(Ⅲ)的吸收与Ca2+和K+通道无关。
(4)Fe(Ⅲ)抑制了玉米幼苗根系对Cr(Ⅲ)的吸收,Fe(Ⅲ)与Cr(Ⅲ)之间存在反竞争性的抑制关系。

