叶面喷施硒对紫色小麦镉积累的影响
余林科,杨昕玥,徐小逊,2*,王贵胤,2,杨占彪,张世熔,2
(1.四川农业大学环境学院,成都 611130;2.四川省土壤环境保护重点实验室,成都 611130)
镉(Cd)是土壤重金属污染元素之一,随着工农业加速发展,大量含Cd废物通过工业废气沉降、废水排放、化肥施用等方式进入农业土壤[1]。土壤中过量的Cd 会破坏植物细胞结构,抑制植物的光合作用以及对养分的吸收和运输,进而影响植物的正常生长[2]。此外,Cd 的流动性很强,极易通过植物富集作用进入食物链,对人体健康构成威胁[3]。小麦作为最主要的粮食作物之一,在世界范围内被广泛种植,因此,开发降低小麦Cd污染风险的技术措施很有必要。
减少作物Cd 积累的途径主要包括种植低Cd 积累品种[4-5],采取改良灌溉方式、施用功能性肥料、叶面喷施阻控剂等农艺措施[6-7],以及施行土壤改良措施[8-9]等。叶面喷施阻控技术具有操作方便、效率高、环境友好等特点,是一种具有良好应用前景的减Cd措施,已成为当下研究的热点[10]。其中,叶面喷施硒(Se)被认为是缓解作物中Cd 污染毒性效应的有效农艺措施[11]。Se 能够通过与Cd 形成复合物、促进Cd 的螯合作用以及区室化分布等方式,减少植物对Cd 的吸收和转运[12]。研究发现,施Se 可以改变Cd 在植物亚细胞组分中的分布,通过增加Cd 在小白菜和水稻幼苗可溶性组分中的分布比例来降低Cd 的流动性[13-14]。然而庞晓辰等[15]发现施Se 增加了Cd 在水稻K优818细胞壁中的分布,通过细胞壁对Cd的固定作用减少Cd 向地上部转移。由此可见,Se对Cd 的阻控机制受作物类型和品种差异的影响。
紫色小麦与传统小麦相比,具有对重金属低积累的特性[16]。本课题组在前期大田试验研究中发现,紫色小麦比传统普通小麦有更低的Cd积累能力,但其籽粒中Cd含量仍未达到《食品安全国家标准 食品中污染物限量》(GB 2762—2017)对Cd的要求。因此,本研究拟对紫色小麦叶面喷施亚硒酸钠(Na2SeO3),通过分析不同器官中Cd富集、转运和亚细胞分布特征,探讨施Se 对紫色小麦籽粒Cd 积累的影响,以期为今后利用该技术减少紫色小麦Cd积累提供理论支撑。
1 材料与方法
1.1 供试材料
大田试验位于四川省成都市金堂县某安全利用耕地。该试验地土壤类型为中性紫色土,其耕层(0~20 cm)pH 为7.42,有机质含量为12.44 g·kg-1,碱解氮、有效磷、速效钾的含量分别为97.23、17.56、95.83 mg·kg-1,Cd 含量为0.35 mg·kg-1。供试的4 份小麦材料分别为蜀紫麦1702、蜀紫麦1705、蜀紫麦1706和紫糯麦168。采用Gao 等[17]的方法进行Na2SeO3溶液的配制:将2 767 mg的Na2SeO3固体溶解于1 L去离子水中,得到16 mmol·L-1的Na2SeO3溶液。使用前将Na2SeO3溶液分别稀释到0.2、0.4、0.8 mmol·L-1(分别记作Se1、Se2、Se3),喷施等量去离子水作为空白对照(CK)。
1.2 试验设计
小麦于2020 年10 月29 日播种,播种方式为撒播,播种量为150 kg·hm-2。4 种小麦均设置CK、Se1、Se2、Se3 4个处理,小区面积2 m×2 m,随机区组设计,每个处理重复3 次,共48 个试验小区,在小区周围设置1 m 的缓冲区。在小麦孕穗期至灌浆期每间隔7 d进行1 次叶面喷施,每个小区每次的喷施量为1.5 L,共喷施3 次(4 月1 日、8 日、15 日)。于第3 次喷施后第14 天(4 月29 日)采集植物鲜样测定根、叶亚细胞中的Cd 含量,小麦成熟后(5 月16 日)采集样品分别测定根、茎、叶、籽粒中的Cd含量。
1.3 样品采集与处理
试验小区所在田块地形起伏小、土壤理化特征均匀。于小麦播种前采用梅花法设置7 个混样点,采集1 份耕层混合土样用于土壤Cd 含量及其他基础理化性质分析。为进行小麦各器官中亚细胞组分Cd含量分析,于第3 次叶面喷施后第14 天(4 月29 日),分别在每个处理小区距离边界0.3 m 的区域内,按五点取样法采集5株生长状况良好的小麦混合成1份小麦鲜样,共采集48 份。鲜样用去离子水洗净后将根、叶分别研磨,根据Jiang 等[18]的方法通过差速离心分离得到亚细胞内细胞壁、细胞器、可溶性组分,之后测定各组分中的Cd 含量。具体操作:样品采集洗净后擦干表面水分,收集到离心管并放入液氮中带回实验室,然后快速转移到-80 ℃冰箱保存;称取新鲜根系、叶片各0.2 g,然后加入组成为250 mmol·L-1蔗糖、50 mmol·L-1Tris-HCl(pH=7.5)与1 mmol·L-1二硫赤鲜糖醇(Dithioerythritol,DTE)的预冷提取液,充分研磨成匀浆液,将匀浆液转移至离心管中在4 000 r·min-1条件下离心15 min,沉淀即为细胞壁组分,再将上清液在10 000 r·min-1条件下离心40 min,沉淀为细胞器组分,上清液为可溶性组分,试验操作均在4 ℃下进行;细胞壁和细胞器组分经10 mL 混酸(VHNO3∶VHClO4=4∶1)消解后,稀释至25 mL,可溶性组分直接稀释至25 mL,采用电感耦合等离子体发射光谱仪(Varian 720ES ICPOES,检出限为1 μg·L-1)测定稀释液中的Cd含量。
为进行成熟期小麦各器官Cd 含量分析,于小麦成熟后(5 月16 日),以相同的方法采集48 份小麦混合样品,用去离子水洗净后分为根、茎、叶和籽粒4个部分,在烘箱中105 ℃杀青30 min后,70 ℃烘干至质量恒定。将小麦各器官的样品经粉碎机粉碎,然后分别称取各样品0.3 g于锥形瓶中,加入10 mL混酸(VHNO3∶VHClO4=4∶1)消解,稀释至25 mL后测定Cd含量。
1.4 数据分析
采用生物富集系数(Bioconcentration Factor,BCF)和转运系数(Translocation Factor,TF)来评价重金属在小麦各部位中的积累转运能力[19]。BCF 为小麦各器官Cd 含量(mg·kg-1)与土壤中Cd 含量(mg·kg-1)的比值;TFA-B为B 器官Cd 含量(mg·kg-1)与A 器官Cd 含量(mg·kg-1)的比值;小麦A 器官Cd 的分配比例为A 器官Cd 含量(mg·kg-1)与根、茎、叶、籽粒Cd 含量总和(mg·kg-1)的比值。
数据采用Excel 2019 进行处理并制作表格。利用SPSS Statistics 20.0 软件进行单因素方差分析(One-way ANOVA),用Duncan 法进行处理间多重比较(P<0.05),使用Origin 2021制图。根据假设的因果关系,使用Rstudio 2021,应用结构方程模型(SEM)来探究Se 浓度和小麦各器官Cd 含量对籽粒Cd 含量的直接和间接影响,使用PowerPoint 2019制图。
2 结果与分析
2.1 叶面喷施Se对小麦各器官Cd含量的影响
4 种小麦根、茎、叶、籽粒中的Cd 含量随Na2SeO3喷施浓度升高呈下降趋势(图1)。Se3处理时,4种小麦的籽粒Cd 含量下降最明显,降幅为47%~63%,其中紫糯麦168 降幅最大。根、茎、叶中Cd 含量也呈现显著下降趋势,降幅范围分别为25%~39%、27%~42%和18%~33%。
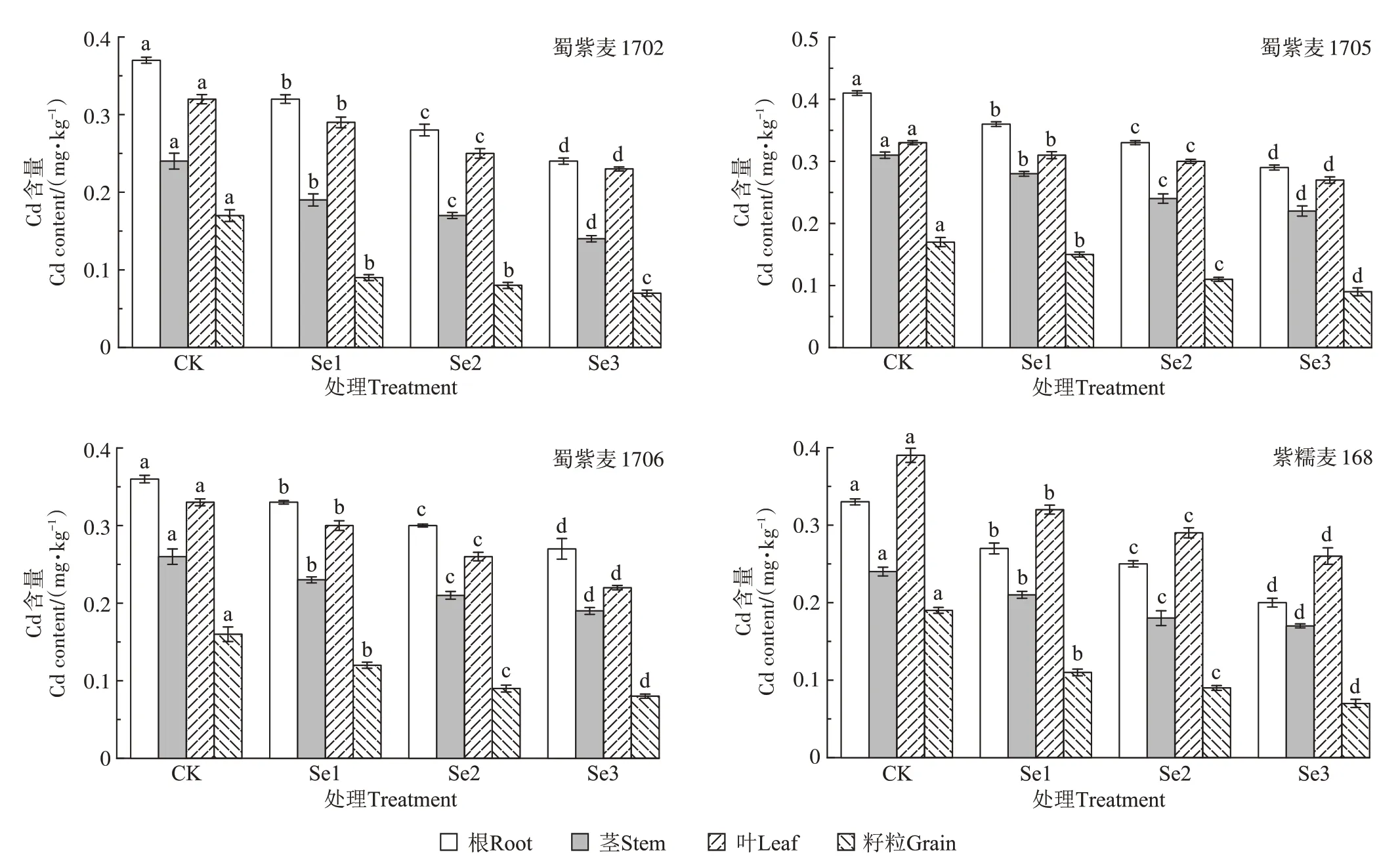
图1 叶面施Se对小麦各器官Cd含量的影响Figure 1 Effects of foliar Se application on Cd content in wheat organs
2.2 喷施Se对小麦Cd富集及转运的影响
在小麦各器官中Cd分布较高的器官为根和叶,占比分别为28%~36%和27%~38%,其次为茎,占比为21%~25%,籽粒对Cd 的积累能力最弱,仅占比10%~16%(图2)。喷施Se 后,籽粒中Cd 分布占比下降1~7个百分点,其中紫糯麦168 下降最多。从作用显著性和降幅来看,喷施Se对紫糯麦168籽粒Cd含量及分布比例的降低效果最好。
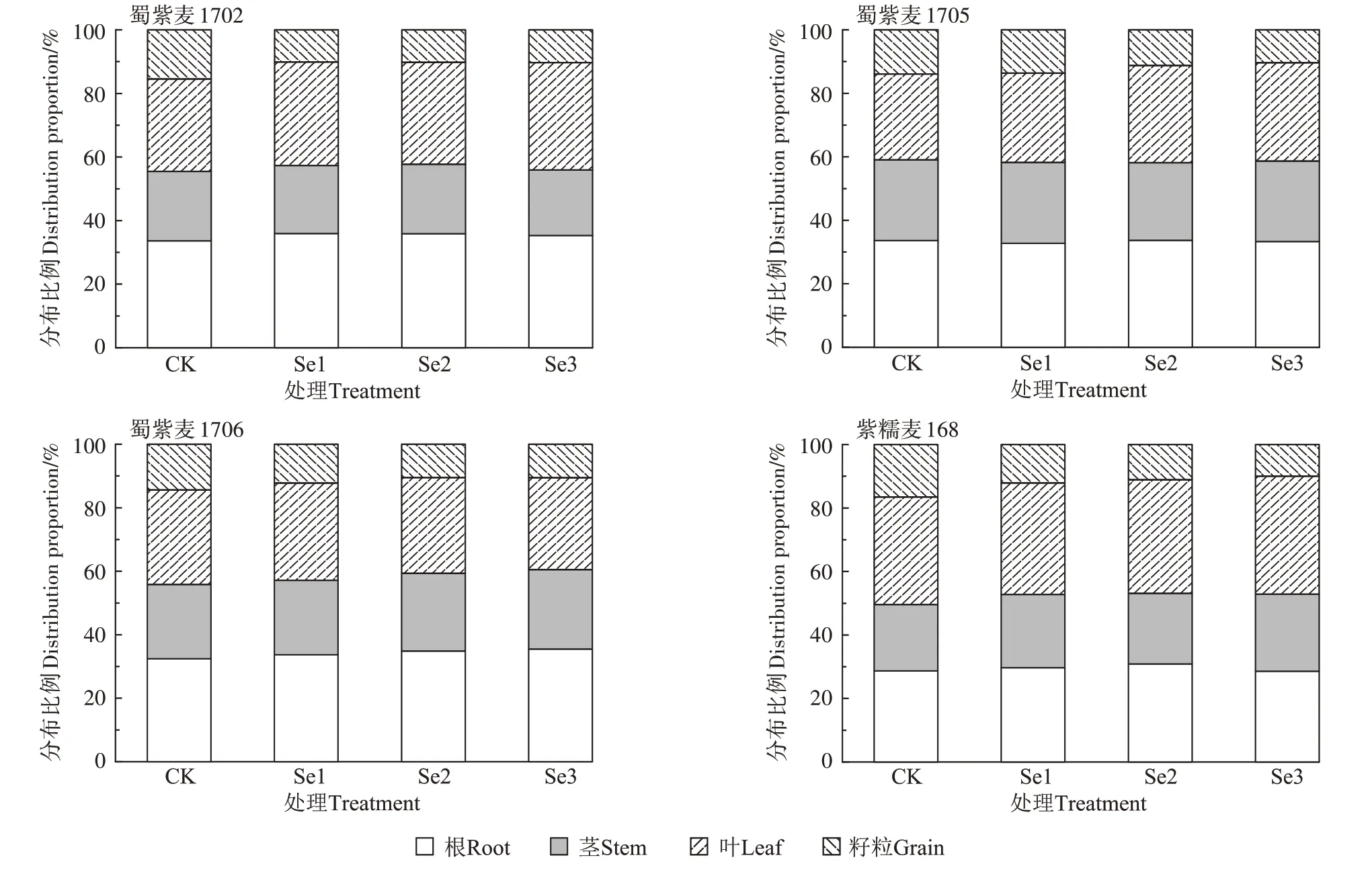
图2 叶面施Se对小麦各器官Cd分布比例的影响Figure 2 Effects of foliar Se application on Cd distribution proportion in wheat organs
叶面喷施Se 后,4 种小麦各器官Cd 富集系数均显著降低(P<0.05),且随着Na2SeO3浓度升高降幅增大(表1)。其中籽粒富集系数的减小程度最大,Se3处理时,4种小麦籽粒Cd富集系数降低45%~75%。
小麦Cd转运系数表现为TF(茎-叶)>TF(根-茎)>TF(茎-籽粒)>TF(叶-籽粒)(表2)。叶面喷施Se 后,TF(茎-籽粒)和TF(叶-籽粒)显著减小(P<0.05),且随Na2SeO3浓度升高,下降程度逐渐增大,Se3处理时,降幅分别为22%~46%和34%~61%,其中紫糯麦168 降幅最大。TF(茎-叶)和TF(根-茎)整体变化不显著。
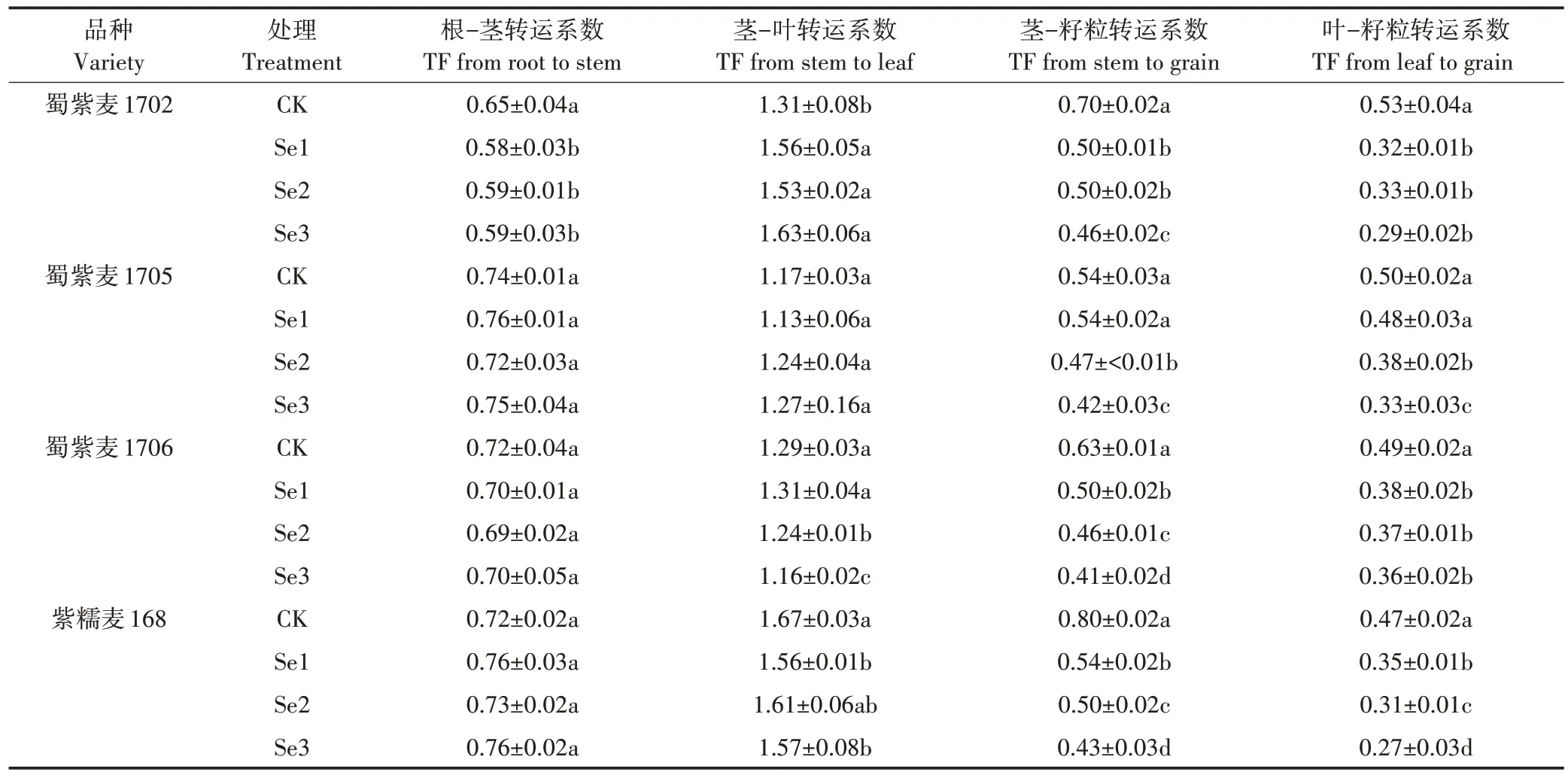
表2 叶面施Se对小麦Cd转运系数的影响Table 2 Effects of foliar Se application on Cd translocation factor in wheat
2.3 叶面喷施Se对小麦根和叶亚细胞中Cd分布的影响
2.3.1 根亚细胞Cd分布
4 种紫色小麦根亚细胞Cd 含量顺序为可溶性组分>细胞壁>细胞器,根亚细胞各组分中Cd 含量随Na2SeO3喷施浓度的升高呈下降趋势(表3)。其中,Se3 处理与CK 相比,4 种小麦的Cd 含量在细胞壁中降低47%~67%,在细胞器中降低57%~72%,在可溶性组分中降低26%~52%。就Cd 的分配比例来看,小麦根部的Cd 主要积累于可溶性组分中,占小麦根部Cd 总量的53%~73%,其次于细胞壁中,占比为18%~33%(图3)。Se1、Se2 处理后,4 种小麦根亚细胞各组分Cd 分布占比变化较小,随着Na2SeO3浓度的进一步提升(Se3 处理),细胞壁的Cd 分布占比较CK 下降了3~12 个百分点,细胞器的Cd 分布占比下降了4~7 个百分点,而可溶性组分的Cd 分布占比上升了8~16 个百分点。
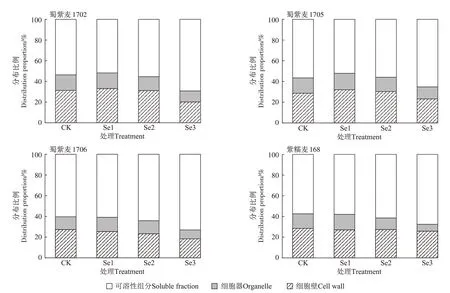
图3 叶面施Se对小麦根亚细胞中Cd分布比例的影响Figure 3 Effects of foliar Se application on proportion of subcellular distribution of Cd in the roots of wheat
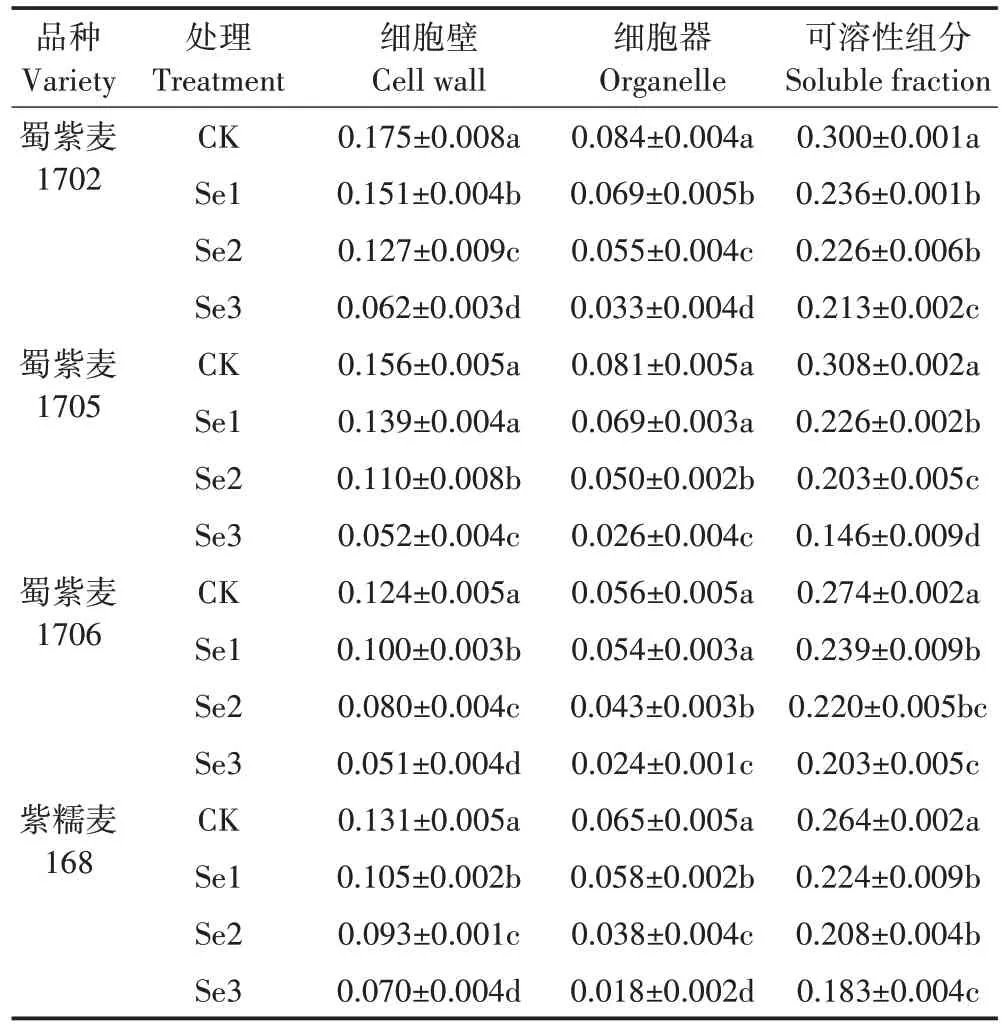
表3 叶面施Se对小麦根亚细胞中Cd含量(以鲜质量计)的影响Table 3 Effects of foliar Se application on subcellular distribution of Cd conten(tcalculated by fresh weight)in the roots of wheat单位:mg·kg-1
2.3.2 叶亚细胞Cd分布
由表4 可知,小麦叶部Cd 含量顺序为可溶性组分>细胞壁>细胞器。叶亚细胞各组分中Cd 含量随Na2SeO3喷施浓度的升高呈下降趋势,与根亚细胞Cd含量变化情况相似。其中,Se3 处理与CK 相比,4 种小麦细胞壁中Cd 含量降低50%~53%,细胞器中降低75%~78%,可溶性组分中降低39%~46%。小麦叶片中的Cd 主要积累于可溶性组分中(图4),占叶片Cd总量的59%~71%,其次为细胞壁,占比为21%~25%。随着Na2SeO3喷施浓度的升高,蜀紫麦1702、蜀紫麦1705 和蜀紫麦1706 小麦叶亚细胞可溶性组分中的Cd 分布占比上升了6~10 个百分点,细胞器中下降了5~10 个百分点,而细胞壁中分布占比变化不明显;紫糯麦168 在Na2SeO3喷施浓度最高时才出现明显变化,可溶性组分中Cd 分布占比上升6 个百分点,细胞器中下降5个百分点,细胞壁中下降1个百分点。
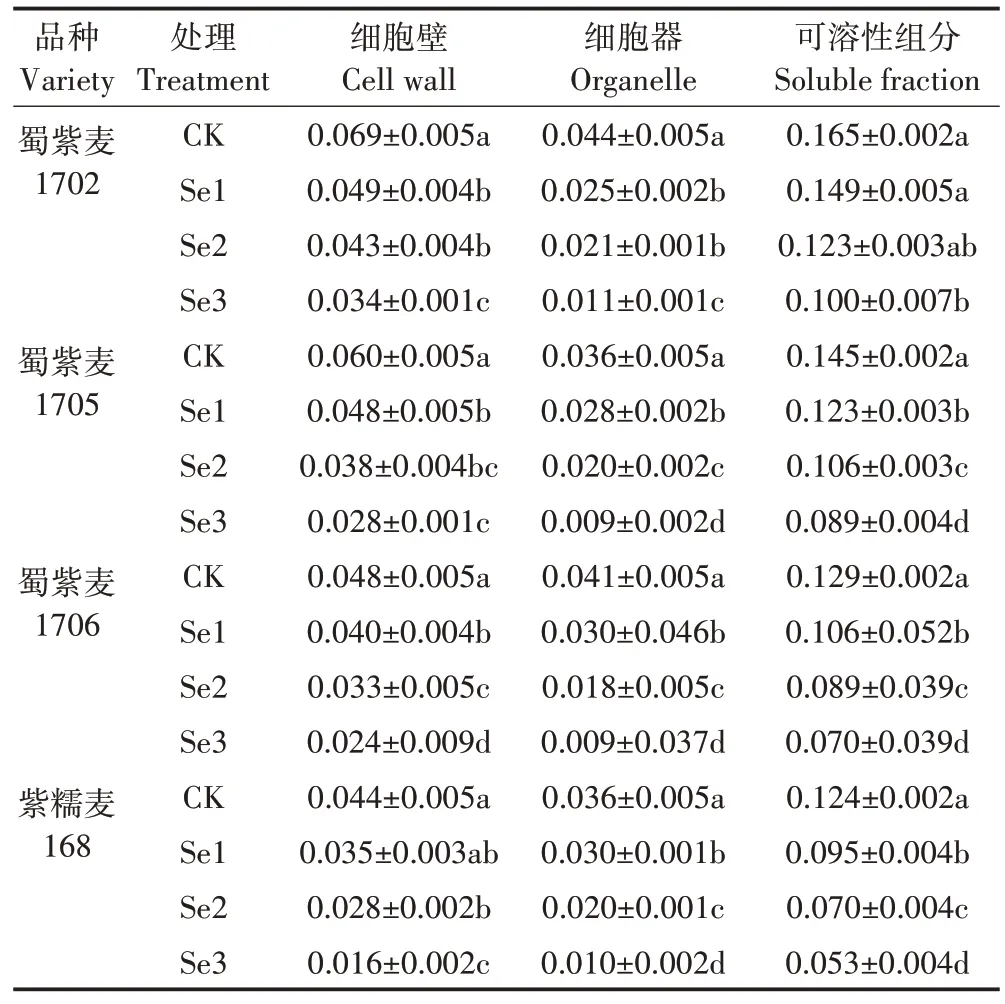
表4 叶面施Se对小麦叶亚细胞中Cd含量(以鲜质量计)的影响Table 4 Effects of foliar Se application on subcellular distribution of Cd concentration(calculated by fresh weight)in the leaves of wheat单位:mg·kg-1
3 讨论
不同品种小麦对Cd的积累存在一定差异。肖昕等[20]对苏徐2 号小麦的研究发现,成熟期小麦植株中不同器官Cd 含量顺序为根>叶片>茎>颖壳>果实。本试验在3.5 mg·kg-1Cd胁迫环境下,蜀紫麦1702、蜀紫麦1705和蜀紫麦1706根部Cd富集最多,其次是叶部,而紫糯麦168 叶部Cd 含量大于根部(图1),这与任超等[21]在土壤Cd 为4 mg·kg-1水平下对小麦的研究结果相似。这可能是由于不同小麦品种存在基因型差异,从而导致品种间Cd 积累特征的不同[22]。Wu等[23]发现,经Na2SeO3溶液喷施后,小麦各个器官的Cd含量均显著降低。Xia等[24]的盆栽和田间试验结果同样表明,叶面施Se 可显著降低小麦灌浆期籽粒中Cd的含量。屈婵娟等[25]的研究发现,施Se 可降低油菜根、茎、叶中Cd的含量。本研究结果与以上研究大致相同,Na2SeO3浓度在0.2~0.8 mmol·L-1时,小麦各器官Cd 的含量随Na2SeO3浓度增加呈降低趋势,其中籽粒Cd含量下降最高,达63%(图1)。在对水稻的研究中发现,Se和Cd存在明显的拮抗作用,二者可形成难溶性复合物,从而减少植物根部对Cd 的吸收[26]。卞威乐斯等[27]的研究发现,施Se 不仅可以降低植物对Cd 的吸收,还可以降低已吸收的Cd 的活性。此外,外源Se 可抑制Cd 胁迫下植物根部Cd 吸收基因的表达,从而减少对Cd 的吸收[28]。本研究中,喷施Se 后,各器官Cd 富集系数相应降低,表明Cd 在各器官中的积累能力受到抑制。籽粒Cd 含量与根(图5a)、茎(图5b)、叶(图5c)Cd 含量存在正相关关系(P<0.05),叶面喷施Se 减少了小麦根部对Cd 的吸收,从而减少了Cd 向地上部转运,因此籽粒中Cd 的积累量相应降低。
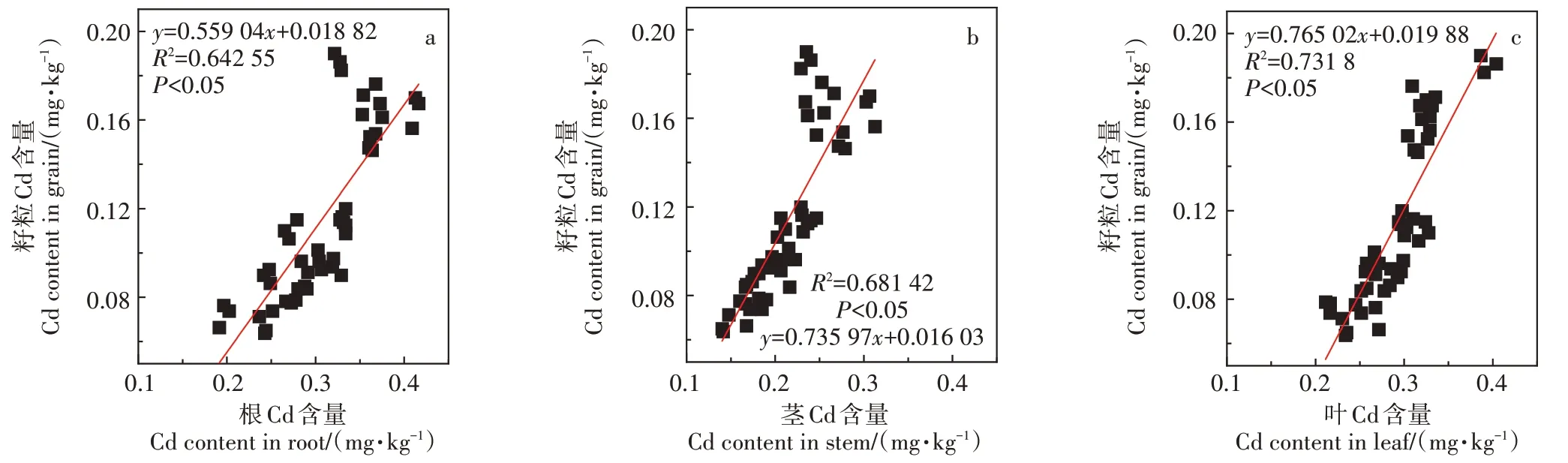
图5 籽粒与其他各器官Cd含量的相关性分析Figure 5 Relationships of Cd content between grain and other organs
本研究探讨了4 种小麦不同器官间Cd 的转运特征,经Na2SeO3溶液喷施后,4 种小麦的TF(茎-籽粒)和TF(叶-籽粒)均显著下降(P<0.05),然而,蜀紫麦1702 在Se1 处理后TF(根-茎)比其他3 种小麦显著降低(表2),这是该品种籽粒Cd含量大幅下降的原因。表明喷施Se 后各品种小麦转运特征存在差异,从而导致各品种小麦籽粒中Cd含量降低程度不同。进一步分析发现,4 种小麦经Se 处理后TF(茎-籽粒)和TF(叶-籽粒)下降分别达到22%~46%和34%~61%(表2),小麦籽粒Cd 含量与TF(茎-籽粒)(图6c)和TF(叶-籽粒)(图6d)存在显著的正相关关系,表明叶面施Se 主要是通过抑制Cd 从茎到籽粒和叶到籽粒的运输来降低籽粒Cd 的积累量。Jiang 等[29]在对水稻的研究中发现,叶面施Se 可减少Cd 由茎、叶向穗部的转运,使糙米中Cd 含量降低了40.36%。叶面可通过气孔和表皮亲水小孔直接吸收养分[30],叶面喷施可使更多的Se 元素进入小麦茎、叶组织。Na2SeO3与茎、叶组织中的Cd 相结合形成难溶的CdSeO3,改变细胞膜对Cd的通透性[31],从而抑制Cd由茎、叶向籽粒转运。
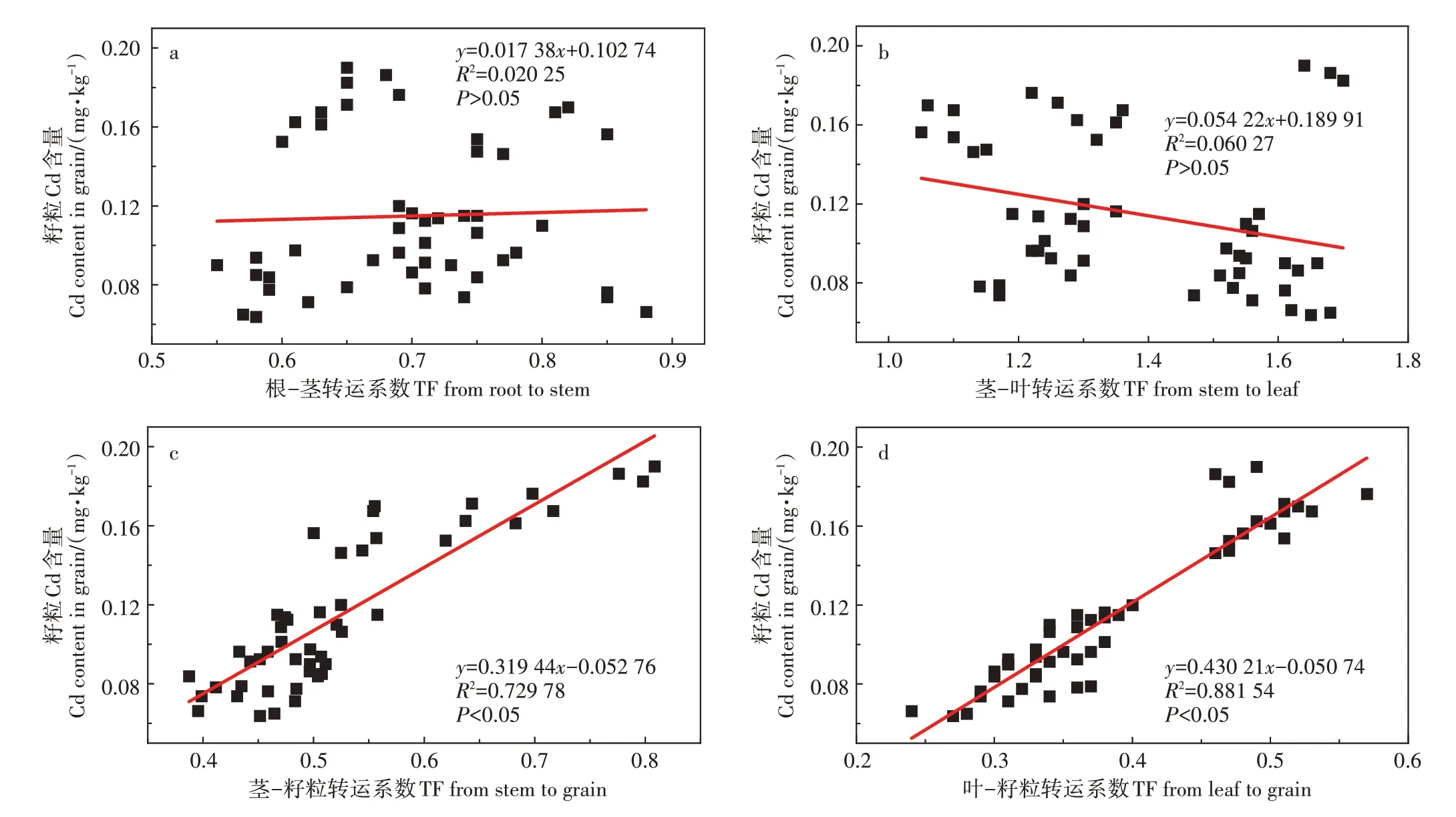
图6 籽粒Cd含量与小麦Cd转运系数的相关性分析Figure 6 Relationships between grain Cd content and Cd transport coefficient in wheat
基于Se 浓度和小麦各器官中Cd 含量之间的影响关系生成的结构方程模型图(图7),进一步表明了叶面施Se 通过茎、叶对籽粒Cd 含量产生影响的路径。该模型解释了小麦籽粒Cd 含量方差的12%。Se对小麦根、叶Cd 含量有显著的、直接的负效应(P<0.001),其中,对叶的影响强度最大,为-0.97;茎、叶Cd 含量对籽粒Cd 含量有显著的、直接的正效应(P<0.001),影响强度分别为0.40 和0.38。Gao 等[17]在对水稻的研究中也发现茎、叶中Cd 含量对籽粒Cd 含量有显著影响。上述结果表明,叶面施Se 可通过影响小麦叶Cd 含量来影响籽粒Cd 含量,也可通过抑制根对Cd 的吸收,进而改变茎、叶Cd 含量,最终影响籽粒对Cd的积累。
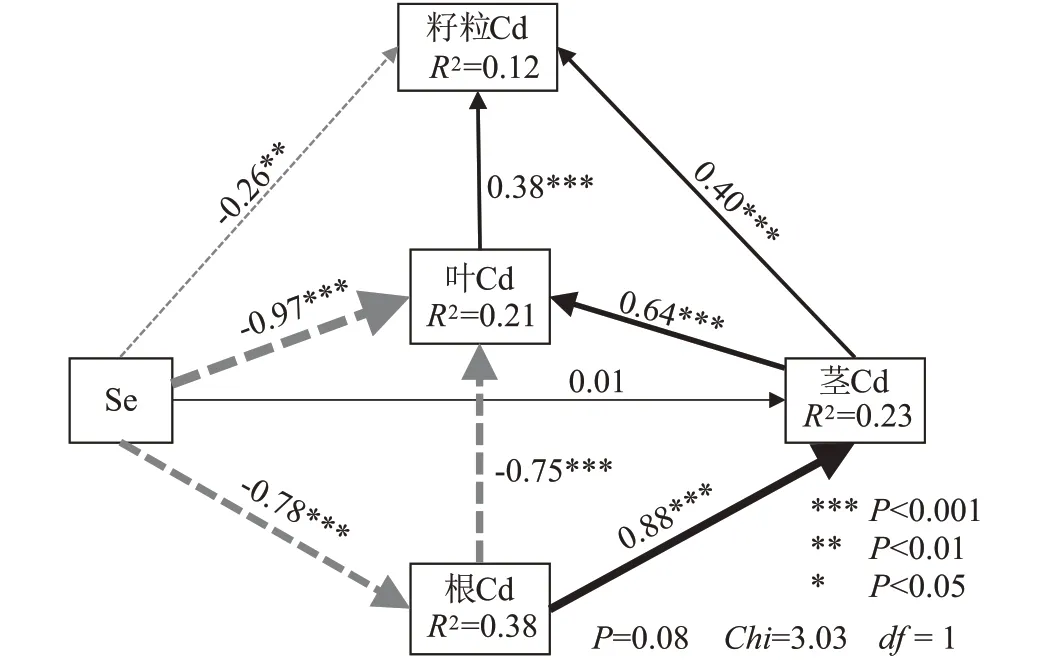
图7 叶面施Se对小麦Cd含量的影响路径结构方程模型图Figure 7 Structural equation model for the path of effects of foliar Se application on Cd content in wheat
Cd在亚细胞水平的分布特征能深入揭示Se对植物吸收和转运Cd 的影响机制[32]。本研究发现Cd 在小麦根、叶亚细胞中均主要分布于可溶性组分,其次是细胞壁,细胞器内含量最低,叶面喷施Se 后,增加了Cd 在可溶性组分中的比例。然而,李虹颖等[33]的研究表明,早籼788 水稻根、茎、叶亚细胞中细胞壁组分Cd 含量最高,且随施Se 浓度升高呈上升趋势。由此可见,不同植物中Cd 的亚细胞分布模式以及Se 对其分布的影响存在明显差异。相关研究表明,植物会对进入细胞内的Cd通过区室化积累于液泡或固定在细胞壁,或形成Cd 盐沉淀以及通过螯合方式来减轻Cd胁迫对植物的伤害[34]。大部分Cd会与细胞中的植物螯合肽(PCs)形成稳定的PC-Cd 螯合物,该螯合物转运至液泡中,以减少Cd 在细胞间的流动。Se 能促进谷胱甘肽(GSH)系统对PCs 的合成以及相关酶的活性[35],PCs的增多又直接影响到液泡对Cd的分隔容量(VSC)大小[36],进而增强Cd 在液泡中的滞留作用[37]。本试验中,喷施Se 后小麦根、叶亚细胞中的Cd更倾向积累于可溶性组分中。这与张雯等[14]对水稻的研究结果相似。说明本研究中Na2SeO3的施用促进了紫色小麦根、叶细胞中的Cd被区室化于液泡。Lux等[38]的研究发现,Cd 主要通过质外体在小麦根、茎、叶、籽粒间运输。随着Na2SeO3的浓度增大,Cd 在可溶性组分中的比例相应增大,大量Cd 被阻隔于液泡中,减少了其在质外体中的流动转移,最终减少了Cd向地上部的转运,尤其是减少了由茎向籽粒和叶向籽粒的转运。这说明Cd 的区室化是减少Cd 向籽粒转运的一个重要因素。
4 结论
叶面喷施Na2SeO3能显著降低紫色小麦各器官Cd的含量和富集系数,同时提高Cd在小麦根系中的分布占比,降低在籽粒中的分布占比。紫色小麦根、叶亚细胞中Cd的分布特征相似,含量顺序为可溶性组分>细胞壁>细胞器。叶面喷施Se能降低小麦亚细胞各组分的Cd 含量,并促进细胞中Cd 区室化分布于可溶性组分,有效阻控Cd从茎到籽粒和叶到籽粒的转运,这是Se减少籽粒Cd积累量的主要原因之一。

