过表达CTRP9抑制ApoE基因敲除小鼠肝脏脂肪病变
李向宇,艾乐乐,刘玉琪,梁国朵,相奥琪,陈晓畅,余 琦,关 华,2
(1.西安医学院基础与转化医学研究所,陕西省缺血性心血管疾病重点实验室,西安 710021;2.西安交通大学医学部实验动物中心,西安 710067)
C1q/肿瘤坏死因子相关蛋白9(C1q/tumor necrosis factor-related protein 9,CTRP9)是一种新发现的脂肪因子,是脂联素最接近的同源物[1-2]。CTRP9蛋白水解释放其球状结构域(global CTRP9,gCTRP9),作为主要循环亚型和功能单位存在于生物个体内[3]。在与脂联素受体1(adiponectin receptor 1,AdipoR1)和N-钙黏蛋白结合(N-cadherin)后,CTRP9激活各种信号通路以调节葡萄糖和脂质代谢[4]、血管舒张和细胞分化[5]。以往研究证明CTRP9可有效地抵抗心肌缺血再灌注后模型动物的炎症反应[6],以及其对2型糖尿病[7]、胰岛素抵抗和肥胖[8]、肺动脉高压[9]、心力衰竭[6]、心肌梗死和动脉粥样硬化[10]等也具有有益作用,抑制CTRP9表达能够显著加剧野生型C57BL/7J小鼠肝脏脂肪病变[11]。载脂蛋白E(ApoE)是所有血浆脂蛋白的重要组成部分,ApoE基因突变与脂肪变性和肝损伤密切相关[12-13]。本研究探讨CTRP9对高脂血症模型ApoE基因敲除(ApoE-/-)小鼠肝脏脂肪病变形成的影响及机制。
1 材料和方法
1.1 实验动物与分组
雄性SPF级ApoE-/-小鼠30只,8周龄,购自北京维通利华实验动物技术有限公司[北京百善SCXK(京)2016-0006]。将30只小鼠随机分为观察组与对照组,每组15只,对照组小鼠给予尾静脉注射腺病毒空载绿色荧光蛋白(adenovirus green florence protein,Ad-GFP),观察组小鼠给予尾静脉注射腺病毒Ad-CTRP9。2组小鼠注射病毒后均饲喂高脂高胆固醇饮食(HF/HC)12周,饲料成分为21%脂肪+0.15%胆固醇,饲喂至20周龄,采集尾静脉血,再给予150 mg·kg-1戊巴比妥腹腔注射处死小鼠收集肝脏组织。实验在西安交通大学实验动物中心屏障动物房[SYXK(陕)2012-005进行],动物饲养室温度、光照、噪声和换气次数均符合国际要求,自由饮水和采食,所有动物处理程序符合美国NIH实验动物管理法。
1.2 主要试剂和仪器
伊红染色液、苏木素染色剂、酒精购自北京雷根生物技术有限公司;水性封片剂购自广州凯秀贸易有限公司;总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇试剂盒(HDL-C)购自中生北控生物科技股份有限公司。冰冻切片机(德国Leika公司,型号:RM2235),图像分析系统(Image-Pro Plus 6.0),电子天平(瑞士Mettler Toledo公司,型号:AB104-S)。
1.3 实验方法
1.3.1 腺病毒CTRP9载体构建与细胞感染
根据文献[12]方法构建编码CTRP9重组腺病毒载体(Ad-CTRP9)。将CTRP9 cDNA亚克隆到腺病毒穿梭质粒pAdTrack CMV中。序列确认后,将重组穿梭质粒转化到BJ5183感受态细胞中。将重组腺病毒包装并在HEK293A细胞中扩增。纯化后,通过TCID50检测病毒滴度。构建空腺病毒载体(Ad-GFP)作为对照。
1.3.2 血脂水平检测
HF/HC饮食饲喂12周后,禁食16 h,尾静脉采血置于EDTA抗凝剂处理的Ep管中,3000 r·min-1,4 ℃离心15 min,取血浆,用商品化检测试剂盒检测TC、TG、LDL-C、HDL-C水平。根据中生北控检测试剂盒产品说明书,TC采用CHOD-PAP法,TG采用GPO-PAP法,HDL-C采用直接法-过氧化氢酶清除法,LDL-C采用直接法-表面活性剂清除法进行检测。
1.3.3 油红O(ORO)染色
从-80 ℃冰箱中取出肝脏组织冰冻切片在室温复温30 min,用4%多聚甲醛中固定30 min,蒸馏水冲洗3次,每次1 min;用60%异丙醇溶液预处理15 min,随后加入0.5%的ORO工作液室温染色30 min,随后用60%异丙醇溶液浸洗1 min,蒸馏水轻轻冲洗3次,用水溶性封片剂封片、照相。
1.3.4 苏木素-伊红(HE)染色
从-80 ℃冰箱中取出肝脏组织冰冻切片在室温复温30 min,用4%多聚甲醛固定30 min,蒸馏水冲洗3次,每次1 min;苏木素染色10 min;流动水冲洗,1%盐酸酒精分化10 s,伊红染色2 min,流动水冲洗3 min,95%乙醇浸洗2 min;100%乙醇浸洗2 min,二甲苯浸洗10 min,中性树脂封片、照相。
1.3.5 实时PCR(real-time PCR)分析
使用TRIzol Plus(美国Invitrogen公司)提取小鼠肝脏的总RNA,并使用SuperScript©Ⅲ第一链合成系统(美国Invitrogen公司)合成cDNA。使用TaKaRa TP800(日本TaKaRa Biology Inc)进行real-time PCR分析。定量转录物的数量,并根据其β-actin含量对每个样品进行标准化。PCR引物序列如表1所示。

表1 靶基因的引物序列
1.3.6 蛋白质印迹(western blotting)
从肝组织提取蛋白质,并通过BCA法测定浓度。从每组中随机选择总共6个样品进行western blotting。分离蛋白质,然后转移到聚偏氟乙烯膜上(美国Thermo Fisher Scientific Inc)。将膜与每种一级抗体(Ab)孵育如下:抗-CTRP9和抗-b-actin,按照制造商所用说明,在4 ℃下培养过夜,洗涤3次后,将膜与辣根过氧化物酶缀合的二级Ab(1:5000)孵育2 h,使用化学发光检测系统(美国Millipore公司)建立印迹。
1.3.7 肝脂质分析
将100 mg新鲜肝脏匀浆组织用1.9 mL氯仿-甲醇(2:1)混合物(v/v)稀释至2 mL,将匀浆提取过夜(4 ℃)并离心(3000 r·min-1,20 min)。用移液管取下相液体100 μL,并转移至玻璃管中,用氮气干燥脂质以使氯仿扩散,用50 μL乙醇溶解Ep管底部的脂质并使用商业分析试剂盒(中生北控生物科技股份有限公司)测量肝脏TC和TG。
1.4 统计学方法
2 结果
2.1 CTRP9在肝脏组织中的表达水平
Real-time PCR和western blotting检测结果显示,观察组肝脏组织中CTRP9 mRNA和蛋白表达均较对照组明显上调(P<0.05或P<0.001),其中基因表达上调约20倍,蛋白表达上调约2倍(P<0.05),见图1。
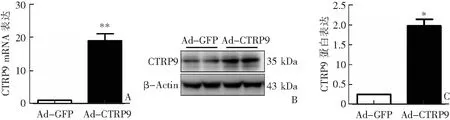
A:CTRP9 mRNA表达比较;B:western blotting检测;C:CTRP9蛋白表达比较;
2.2 体重和血脂水平分析
与对照组相比,观察组小鼠体重及血清TC、TG、HDL-C、LDL-C、葡萄糖水平差异无统计学意义(P>0.05),见图2。
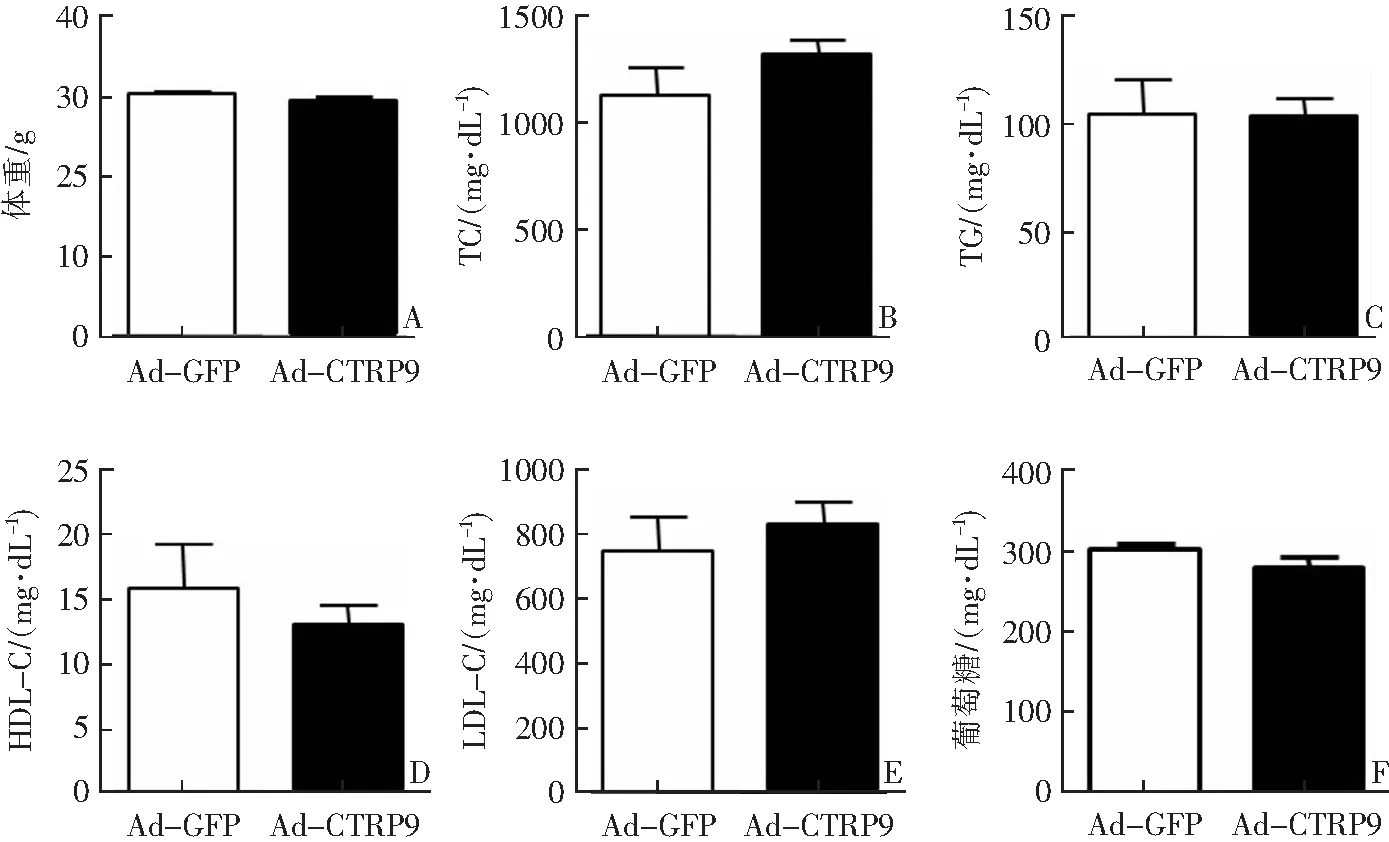
A:体重;B:血清TC水平;C:血清TG水平;D:血清HDL-C水平;E:血清LDL-C水平;F:血清葡萄糖水平。
2.3 肝脏脂肪病变及相关基因表达
肝脏组织HE、ORO染色显示,与对照组相比,观察组肝脏组织中脂质蓄积显著降低(图3A)。另外,与对照组相比,观察组肝脏组织中脂质含量显著降低(P<0.05),其中TC和TG含量分别下降45%和20%(图3B—C)。
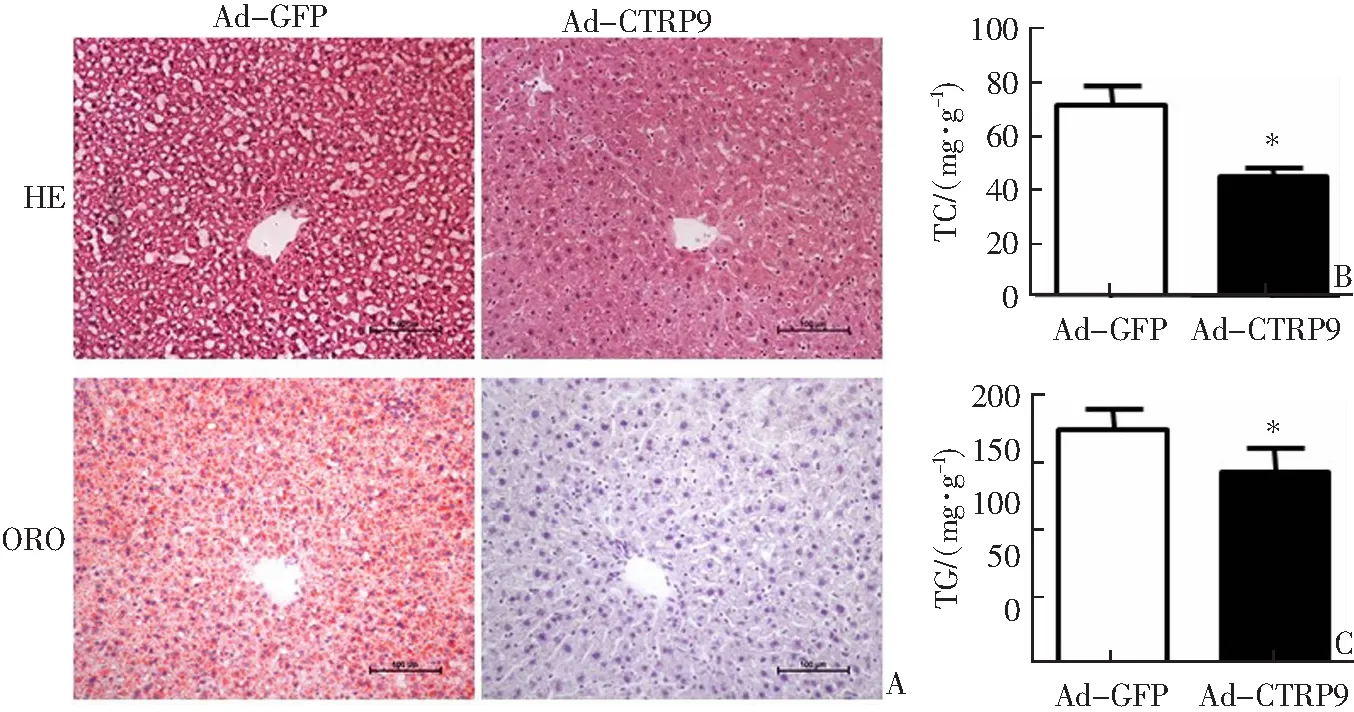
A:肝脏组织HE和ORO染色;B:肝脏组织TC含量;C:肝脏组织TG含量;*P<0.05与对照组(Ad-GFP)相比。
为了进一步确定CTRP9抑制肝脏脂肪病变的机制,利用real-time PCR检测肝脏组织中相关基因表达。结果显示:与对照组相比,观察组肝脏新生脂肪生成相关基因FAS、SCD1,转录调节因子SREBP1c,炎症相关基因MCP-1、MIP1α、IL-1β表达水平显著下降(P<0.01或P<0.001);脂代谢相关基因PPARα、PPARγ、LXRα、LXRβ,脂肪酸氧化和氧化磷酸化相关基因CPT1、CPT2、COX4、Cytoc、Acadl、Acadm表达水平显著升高(P<0.05或P<0.01),见图4。表明过表达CTRP9能够通过促进脂肪酸氧化磷酸化抑制肝脏组织中脂肪生成以及炎症反应,增加线粒体能量消耗,从而降低肝脏组织中脂质蓄积。
3 讨论
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)的发病率逐年升高,其危害不仅限于肝脏组织,对周身其他器官的代谢功能也产生剧烈影响[14]。NAFLD早期,肝细胞中脂质蓄积导致脂肪样变,多种细胞因子表达紊乱,线粒体功能障碍以及肝细胞炎症反应,促使NAFLD发展为非酒精性脂肪肝肝炎(non-alcoholic steatohepatitis,NASH)[15]。在本研究中,给雄性ApoE-/-小鼠饲喂高脂高胆固醇饮食,同时通过尾静脉注射腺病毒以确保CTRP9表达升高。结果显示,与对照组相比,尽管过表达CTRP9对小鼠的血脂水平和体重没有显著影响,但是肝脂肪病变显著减少,同时,肝脏组织中TC和TG水平显著降低。分子生物学实验进一步证实,肝组织线粒体氧化磷酸化相关基因表达显著升高,而新生脂肪生成以及炎症因子相关基因表达显著下降。表明过表达CTRP9可通过促进肝细胞线粒体氧化磷酸化显著降低ApoE-/-小鼠脂肪肝形成。
ApoE是所有血浆脂蛋白的重要组成部分,并作为细胞表面脂蛋白受体,如LDL受体的配体。当喂食标准饲料时,ApoE-/-小鼠自发地发生高胆固醇血症和动脉粥样硬化,而HF/HC可进一步加重这些损伤并加速该过程,喂食HF/HC的ApoE-/-小鼠可以作为一种快速且有价值的NAFLD模型[16]。外显子微阵列分析协同计算机断层扫描发现,ApoE基因突变与脂肪肝形成显著关联[12];基因突变序列分析结果显示,ApoE基因突变与脂肪变性和肝损伤密切相关[13]。因此,本研究通过检测喂食HF/HC的ApoE-/-小鼠肝脏中CTRP9的表达,探索CTRP9对脂肪肝形成的潜在机制。
SREBPs属于bHLH LZ转录因子家族,作为二聚体与脂质代谢靶基因SRE,5′-TCACCC-3′结合[17]。作为一个调节脂质合成的主控基因,SREBPs包含3种异构体,SREBP-1a、SREBP-1c和SREBP-2,在脂质合成中发挥不同的作用[18]。SREBP-1c肝脏过表达转基因小鼠证实,其在生脂基因转录激活中具有关键作用,导致肝脏脂质累积和胰岛素抵抗增加[19]。尽管已知SREBP通过结合SRE发挥功能,但由于非典型酪氨酸残基取代了存在于碱性区域的保守精氨酸,SREBP也可以与E-box域结合[20]。FAS(脂肪酸合酶)作为脂肪酸合成的关键基因,-CAT启动子区包含SRE和E-box结构域[20]。ChIP检测发现,SREBP1c与FAS启动子区结合,从而激活FAS基因的表达[21]。本研究中,过表达CTRP9抑制SREBP1c和FAS基因表达,油红O染色结果显示肝脏脂肪病变显著减少,与先前的研究结果相一致。
PPARα(过氧化物酶体增殖物激活受体α)是一种配体激活的转录因子,与PPARγ和PPARβ/δ均属于NR1C核受体亚家族,许多PPARα靶基因参与肌肉、心脏和肝脏等高氧化率组织中的脂肪酸代谢[22]。PPARα激活可改善NAFLD临床前模型中的脂肪变性、炎症和纤维化,确定了一个新的潜在治疗领域[23]。先前的研究[24-25]证实,PPARα是涉及过氧化物酶体和线粒体β氧化、FA反式转运和肝葡萄糖生成基因的转录调节因子,通过蛋白-蛋白相互作用负调控促炎信号通路,配体激活的PPARα通过干扰AP-1和NFκB信号通路抑制细胞因子诱导的IL-6基因表达,如全身炎症、动脉粥样硬化或NAFLD等动物模型中所见。本研究证实,过表达CTRP9促进PPARα基因表达上调,减轻肝脏脂肪变性,继而上调线粒体氧化磷酸化的基因表达,而炎症相关基因表达被抑制,与先前的研究结果相一致。
线粒体是参与能量生产和许多代谢过程的关键细胞器,在结构上,它们具有包围膜空间的内、外膜[26]。内膜内是线粒体基质,其中发生重要代谢过程,如三羧酸(tricarboxylic acid,TCA)循环[27]。在肝脏脂肪病变过程中,线粒体功能障碍,活性氧生成增加和氧化磷酸化受损。本研究显示,过表达CTRP9促进氧化磷酸化相关基因表达升高,说明CTRP9激活线粒体氧化磷酸化过程,加快线粒体能量代谢,这一分子机制与肝细胞中脂质蓄积减少相一致。
综上所述,过表达CTRP9可显著抑制ApoE-/-小鼠脂肪肝形成,肝脏中TC、TG含量显著减少。同时,过表达CTRP9可显著抑制肝脏脂质合成转录因子SREBP1c的表达,同时促进线粒体氧化磷酸化相关基因表达显著上调,表明CTRP9能够通过改善线粒体氧化磷酸化促进能量代谢、抑制脂质生成2个方面缓解高脂血症模型中肝脏脂肪病变的形成。

