解读溶解度曲线
王水池 洪兹田


溶解度曲线是全国各省市中考的热点题型,通常以选择题或填空题的形式进行考查,体现了数学函数图象与化学溶解度知识的完美结合。对溶解度曲线进行“点—线—面”分析及拓展,可获得有关物质溶解度的诸多信息,帮助同学们形成良好的认知基础。
[认知基础]
1.判断溶解度随温度的变化趋势
根据溶解度曲线中溶解度随温度的变化趋势可以判断溶解度受温度变化的影响。
2.比较固体物质的溶解度大小
只有在温度确定时,才能比较不同固体物质溶解度的大小;温度不确定时,无法比较溶解度的大小。
3.饱和溶液与不饱和溶液相互转化的方法
(1)对于大多数溶解度随温度升高而增大的固体物质,如KNO3、NH4Cl。
不饱和溶液[增加溶质或蒸发溶剂或降低温度增加溶剂或升高温度]饱和溶液
(2)对于少数溶解度受温度变化影响很小的固体物质,如NaCl。
不饱和溶液[增加溶质或蒸发溶剂增加溶剂]饱和溶液
(3)对于极少数溶解度随温度的升高而减小的固体物质,如Ca(OH)2。
不饱和溶液[增加溶质或蒸发溶剂或升高温度增加溶剂或降低温度]饱和溶液
4.判断溶液是否达到饱和状态及所得溶液的质量
从溶解度曲线中可知某温度下某物质的溶解度,结合[溶质质量溶剂质量=溶解度100 g],即可计算该温度下一定质量的溶剂中最多可溶解的溶质质量,进而可判断出所加入固体是否完全溶解(未溶解的固体不计入溶质)以及溶解后形成的溶液是否饱和。最终计算所形成溶液的质量 = 溶剂质量 + 溶解的溶质质量。
5.结晶的常用方法
注意:极少数物质(如熟石灰)的溶解度随温度的升高反而减小,使该类物质从其水溶液中析出的方法应变为升温结晶法。
6.饱和溶液的溶质质量分数随温度的变化规律
比较不同物质的饱和溶液温度变化后溶质质量分数的大小,可利用如下规律:
(1)溶解度增大“平行走”。如果温度变化后溶解度增大,此时溶液的组成未发生改变,饱和溶液变为不饱和溶液,但其溶质质量分数保持不变。
(2)溶解度减小“沿线走”。如果温度变化后溶解度减小,此时溶液中有晶体析出,溶液仍为饱和溶液。但其溶质质量分数减小,等于所变温度饱和溶液的溶质质量分数。
7.根据溶解度曲线确定混合物分离的方法
从溶解度曲线可知相关物质溶解度受温度变化的影响。假设a物质的溶解度随温度的升高而增大,b物質的溶解度受温度变化的影响很小。
(1)若a溶液中混有少量b,则采用降温结晶法提纯a;
(2)若b溶液中混有少量a,则采用蒸发结晶法提纯b。
[思维发散]
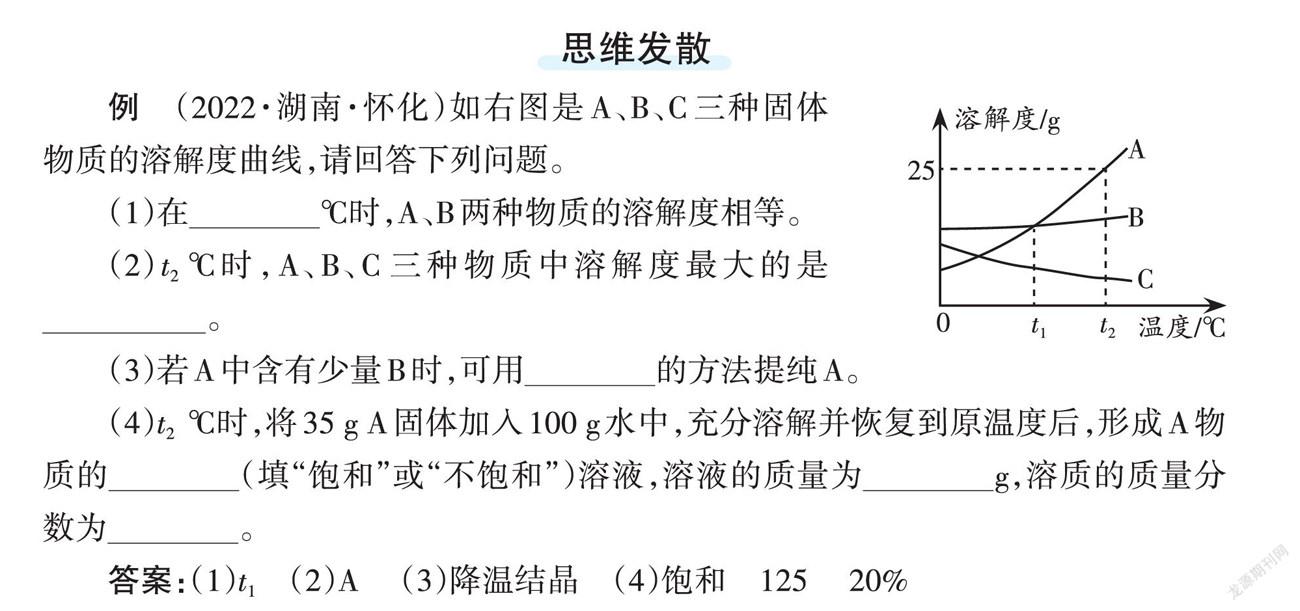
例 (2022·湖南·怀化)如右图是A、B、C三种固体物质的溶解度曲线,请回答下列问题。
(1)在___________℃时,A、B两种物质的溶解度相等。
(2)t2 ℃时,A、B、C三种物质中溶解度最大的是___________。
(3)若A中含有少量B时,可用___________的方法提纯A。
(4)t2 ℃时,将35 g A固体加入100 g水中,充分溶解并恢复到原温度后,形成A物质的 (填“饱和”或“不饱和”)溶液,溶液的质量为 ___________g,溶质的质量分数为___________。
答案:(1)t1 (2)A (3)降温结晶 (4)饱和 125 20%
(作者单位:福建省厦门市新店中学、福建省厦门市翔安第一中学)
——饱和溶液与不饱和溶液

