HMGB1、PDGF-AA在宫腔粘连中的表达及临床意义*
魏雯雯,李 敏,王玉风,房冬梅,侯学涛
(济南市第二妇幼保健院妇科,济南 271199)
宫腔粘连(intrauterine adhesion,IUA)又称Asherman综合征,是因妊娠或非妊娠子宫创伤引起的并发症,导致宫腔部分或全部闭塞,从而导致月经异常、不孕或反复流产等[1]。研究表明,HMGB1作为内源性细胞因子可参与炎症、血管新生等多种病理生理过程,在组织受损缺血状况下,血清HMGB1表达升高[2]。同时在动物实验中证实,用重组HMGB1可改善某些缺血性疾病结局[3]。血小板源性生长因子-AA(platelet-derived growth factor AA,PDGF-AA)作为促进成纤维细胞分裂、趋化的细胞因子,在细胞外基质的合成和降解中起重要作用[4]。本研究通过免疫组化法测定宫腔粘连内膜组织高迁移率组蛋白B1(high mobility group box 1 protein,HMGB1)、血小板源性生长因子-AA(platelet-derived growth factor,PDGF-AA)的表达,探讨HMGB1、PDGF-AA在宫腔粘连发病中的可能作用机制。
1 资料与方法
1.1 研究对象 选取2019年1月1日至2021年12月31日在济南市第二妇幼保健院妇科就诊的宫腔粘连及继发不孕行宫腔镜诊治术的患者,其中宫腔粘连组(轻、中、重度)48例,对照组(大致正常宫腔形态)41例。纳入标准:宫腔粘连组:符合宫腔粘连诊断标准(按AFS评分标准分度:1~4分为轻度,5~8分为中度,9~12分为重度),有生育要求者,宫腔镜检查在月经干净后3~7d内实施,闭经者随时手术。对照组:继发性不孕患者,经宫腔镜检查确认宫腔形态大致正常。排除标准:不明原因阴道不规则流血;合并高血压、糖尿病等内科疾病;合并盆腔炎、妇科恶性肿瘤、结核等其他生殖系统疾病;存在血栓形成高危因素或有血栓性疾病史。本研究经医院伦理委员会审查通过,患者均签署知情同意书。
1.2 取样方法 宫腔镜诊治术中应用微型钳钳取适量宫腔粘连组织周边子宫内膜组织,对照组钳取适量子宫内膜组织,经生理盐水冲洗后固定标本。
1.3 主要试剂及器材 兔抗人单克隆抗体Anti-HMGB1[EPR 3507](ab79823)购自Abcam公司,鼠抗人单克隆抗体PDGF-AA抗体(E-10)(sc-9974)购自Santa公司,DAB染色液、酶标羊抗鼠/兔IgG聚合物购于上海基因科技股份有限公司,抗体稀释液由北京中杉金桥生物技术有限公司提供。采用显微镜及多功能图像分析工作站(OLYMPUS,BX61)进行阅片及图像收集。
1.4 免疫组化检测HMGB1、PDGF-AA表达 组织样本采用多聚甲醛固定24h、石蜡包埋、切片(厚2μm)、二甲苯脱蜡、水化,添加柠檬酸盐缓冲液高压修复抗原,加3%过氧化氢静置10min,除去内源性过氧化物酶;加兔抗HMGB1、鼠抗PDGF-AA孵育,加二抗-酶标羊抗鼠/兔IgG聚合物30min,磷酸缓冲盐溶液(PBS)冲洗,加二氨基联苯胺(DAB)显色液;用苏木精重染、透明、封片、阅片。
1.5 结果判定 HMGB1阳性信号主要定位于子宫内膜腺上皮细胞的细胞核内,PDGF-AA阳性信号主要定位于子宫内膜腺上皮细胞胞浆;阳性表达主要表现为目标部位出现棕黄色颗粒沉淀。免疫组化染色结果采用半定量分析计数系统[5],根据染色阳性细胞百分率和染色强度综合评分进行结果判断。2名高级职称(副主任医师及以上)病理医生采用双盲法,独立对切片进行染色评估,在高倍镜下(400×)随机观察三个视野。根据细胞染色程度:蓝色、淡黄色、棕黄色、棕褐色,依次评为0、1、2、3分;根据阳性细胞数:将阳性细胞比值的0%~5%、6%~25%、26%~50%、51%~75%、大于75%分别评为0、1、2、3、4分。将两项分数相乘后的分值作为每张切片的最终评分0~12分:0为阴性(-),1~3分为弱阳性(+),4~8分为中等阳性(++),9~12分为强阳性(+++)。将免疫组化结果分为两组:低表达(-~+)和高表达(++~+++),其中以高表达之和计算阳性表达率。

2 结 果
2.1 两组一般情况比较 两组患者的年龄、孕产次比较,差异均无统计学意义(P>0.05),见表1。
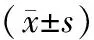
表1 两组研究对象一般情况比较
2.2 HMGB1、PDGF-AA在宫腔粘连中的表达 HMGB1阳性表达主要表现为组织的细胞核出现棕黄色颗粒,HMGB1高表达率在宫腔粘连组为41.67%,在对照组为68.29%,差异有统计学意义(P<0.05);PDGF-AA阳性表达主要表现为组织的胞浆出现棕黄色颗粒,PDGF-AA高表达率在宫腔粘连组为70.83%,在对照组为36.59%,差异有统计学意义(P<0.05),见图1、表2。

图1 宫腔粘连组与对照组HMGB1、PDGF-AA在宫腔组织中的表达(SP×400)

表2 两组研究对象HMGB1、PDGF-AA高表达率比较[n(%)]
2.3 HMGB1、PDGF-AA阳性表达与宫腔粘连程度的关系 宫腔粘连组织中,HMGB1表达与宫腔粘连程度呈负相关,粘连程度越高,HMGB1表达越低,差异有统计学意义(P<0.05),见表2。
2.4 相关性分析 Spearman等级相关分析结果表明,宫腔粘连中HMGB1和PDGF-AA蛋白表达呈负相关,差异有统计学意义(r=-0.294,P<0.05),见表3。

表3 宫腔粘连中HMGB1、PDGF-AA蛋白表达的相关性(n)
3 讨 论
宫腔粘连主要与子宫内膜基底层损伤有关,是子宫内膜损伤后修复障碍最严重的并发症之一。目前临床上存在各种治疗方法,但都未能彻底解决子宫内膜受损、生育力下降问题[6-7]。近年来关于病因的研究重点放在创伤和纤维细胞增殖活性学说上。有学者认为子宫内膜的生长和脱落是一个高度动态的过程,子宫内膜基底层损伤可引起内膜血液循环不足、子宫动脉闭塞甚至纤维化,导致组织缺氧,内膜上皮细胞再生障碍,最终造成胞外基质过度沉积、成纤维细胞增殖,引起宫腔粘连[8-9]。因此,创面组织中新生血管的生长对改善创面微循环、减少感染、促进子宫内膜再生等起着非常重要的作用,其形成障碍直接或间接引起宫腔粘连。探讨血管形成、组织修复相关的分子生物学机制,有助于为宫腔粘连治疗提供新的思路和靶点,对预后预测可能起到一定的辅助作用。
近期研究表明,HMGB1在血管形成、组织修复中起着不可替代的作用。HMGB1可通过多种途径促进血管生成:促进内皮细胞扩散、迁移、发芽,直接促进血管形成[10-11];通过多种机制间接调节血管生长,如HMGB1可通过巨噬细胞浸润、募集,诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)、IL-6、IL-8、TNF-α等炎性因子产生较强的促血管生成信号,引起巨噬细胞、内皮前体细胞和成纤维细胞生长因子的激活,其中内皮前体细胞和成纤维细胞生长因子可分化为内皮细胞并纳入新生血管,这些都对血管生成起重要作用[8,12]。HMGB1可通过内皮前体细胞的分化和募集诱导血管形成细胞,有助于血管网络的形成[13]。本研究表明,HMGB1在正常内膜组织中的表达高于宫腔粘连组,差异有统计学意义(P<0.05),与以上研究相符。
PDGF-AA是一种具有多生物学效应的生长因子,具有促进纤维细胞分化增殖、调节间充质干细胞表型转化等作用[14]。PDGF-AA过表达导致巨噬细胞、上皮细胞和成纤维细胞的相互作用失调,导致成纤维细胞的过度增殖,从而促进瘢痕形成[15]。本研究显示,宫腔粘连组子宫内膜组织中PDGF-AA表达高于对照组,差异有统计学意义(P<0.05);PDGF-AA表达与IUA粘连程度呈正相关,但差异无统计学意义。原因可能是子宫内膜受到损伤后,在缺氧及应激等各种作用下,激活血小板、炎性细胞及成纤维细胞等合成或释放细胞内蓄积的PDGF-AA,过度表达的PDGF-AA可促进成纤维细胞的形成和血管收缩作用,影响正常子宫内膜修复,并且由于炎性细胞对组织结构的破坏,正常子宫内膜逐渐被结缔组织取代,最终导致宫腔粘连的形成。
综上所述,HMGB1和PDGF-AA共同参与宫腔粘连的发生发展过程,有望成为监测宫腔粘连进展的潜在分子标志物,也可为宫腔粘连的防治提供新的治疗靶点。但本研究仅在蛋白表达水平上探讨了HMGB1、PDGF-AA与宫腔粘连的相互关系,其具体作用机制不明。后续需增加样本量,进一步深入研究宫腔粘连的发病机制,进而有助于对宫腔粘连高危妇女进行分子靶向治疗。

