传统开胸及全腔镜切除术对早中期食管癌的疗效比较
张建华 薛军英 王继超 杨锦 王林佩
食管癌作为常见、多发的一种消化道肿瘤,可分颈段、胸段(胸上、胸中和胸下段)及腹段,发病率和死亡率有地域性特征,世界各国有很大差异,病因尚无定论[1]。据统计,过去20年内全球食管癌发病率增加了50%,国内平均死亡约为15万/年,男多于女,>40岁是食管癌的高发人群[1]。食管癌的临床治疗主要以手术为主,放化疗为辅,尤其对早、中期食管癌患者。传统开胸与腹腔镜手术是当前食管癌治疗的主要手术方法,传统开胸术后5年生存率在30%左右,创伤大,伴有显著的术后并发症,如呼吸肌破坏所致的呼吸道感染。有研究发现,传统开胸术后有70%~80%的患者伴有大小程度不同的并发症[2,3],故探索新的治疗方法无疑迫切。经过多年的换代更新,腹腔镜手术在食管癌的临床治疗方面安全可行,术后恢复快,切口小而美观,对缩短患者住院天数,促进机体康复等均有益[4-6]。相较于传统开胸手术,腹腔镜手术并非完美,一是对医务工作者专业要求高,不然易造成试管解剖位置特殊及毗邻结构损伤;二是受手术器械及其他技术因素的限制,手术难度较传统开胸手术高。故研究传统开胸与全腹镜手术在食管癌治疗方面的临床差异完全有必要,报告如下。
1 资料与方法
1.1 一般资料 选择我院肿瘤科2019年1月至2021年1月早中期胸中段食管癌患者71例,传统开胸手术组:男21例,女14例;年龄20~75岁,平均年龄(55.62±5.68)岁。全腔镜切除术组男23例,女13例;年龄20~75岁,平均年龄(55.70±5.68)岁。2组年龄、性别比差异无统计学意义(P>0.05),具有可比性。本研究符合《赫尔辛基宣言》[7]医学研究准则。
1.2 纳入与排除标准
1.2.1 纳入标准:①影像学(CT、B超等)检查肿瘤无外侵(≤T3),各脏器功能评估可接受传统开胸及腹腔镜治疗;②早、中期胸中段食管癌,病灶上缘与胸廓顶距离为2~3 cm;③试管钡餐造影肿瘤直径<5 cm,无软组织阴影;④术前无任何辅助治疗,无远处转移;⑤手术由相同医师团队进行管胃、食吻合;⑥签署《知情同意书》且各项临床资料完整、有效。
1.2.2 排除标准:①胸腔或腹腔黏连致密,无法进行传统开胸或腹腔镜手术;②晚期胸中段食管癌及颈段、胸段(胸上、胸下段)、腹段食管癌;③肿瘤直径>5 cm,且病灶明显外侵,淋巴结较大和多处转移;④各脏器功能障碍;⑤不愿意参与本课题实验,入组前参加其他实验,临床资料缺失;⑥妊娠期、哺乳期女性。
1.3 手术方法
1.3.1 传统开胸手术组:静脉复合麻醉,取左侧卧位(呈90°状),选手术位置(右胸前外侧第4肋间)后常规消毒,做切口(切口大小长15~20 cm)进胸,探查胸腔情况,结合手术设施判断肿瘤是否存在外侵。游离胸段食管,清扫胸部淋巴结。改平卧位,做切口(上腹正中,切口长:15~20 cm)进腹,探查腹腔有无腹水及粘连,游离腹段食管,清扫腹部淋巴结,游离胃并缩胃成管状。再做切口(位置:颈部胸骨上两横指处,切口长度:8~10 cm,切口形状:弧形)行颈部吻合手术。手术方法及淋巴结清扫同全腔镜切除术组。
1.3.2 全腔镜切除术组:①静脉复合麻醉生效后,取俯卧位(单独垫高右侧:45°或60°)选取观察孔位置(右侧腋中线第7或8肋间处,观察孔切口:1 cm,目的:探查是否存在肿瘤外侵、胸腔有无黏连)。接着做3个常规辅助操作孔(第1个位置:腋后线第7肋间,第2个位置:肩胛下角线第8肋间,第3个位置:腋前线第3肋间,操作孔切口均为5 cm),不同病患的常规操作孔位置结合不同病患的胸腔解剖结构和肿瘤部位选定。②手术步骤:探查肿瘤并确保可打开纵隔胸膜者方可进行手术,解离食管下至食管裂孔水平,上至胸廓入口。确定解离位置后,双重夹闭奇静脉弓并切断(器械:Harmlock钳),接着对肺下韧带、隆突下淋巴结进行清扫,核实无残留后止血。确定无活动性出血后冲洗胸腔并放置胸腔闭式引流管(放置位置:镜孔处)并鼓肺,确保无漏气后对各切口进行缝合。放置胃肠减压管及十二指肠营养管各1根(放置部位:鼻部),关闭各切口结束手术。
1.4 观察指标
1.4.1 主要结局指标:淋巴结清扫个数、吻合口瘘、短期复发或转移、喉返神经损伤及肺部感染。
1.4.2 次要结局指标:①术前、术中、术后指标:心率(heart rate,HR)、平均动脉压(mean arterial pressure,MAP)、血氧饱和度(systemic oxygen saturation,SpO2)及中心静脉压(central venous pressure,CVP)、呼气末二氧化碳分压(end-tidal CO2partial pressure,PET-CO2)、pH值等;②术后短期疗效指标:胸部手术时间、术中出血量、术后第1天胸腔引流量、拔管时间、住院时间。
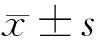
2 结果
2.1 2组术前、术中及术后检测指标比较
2.1.1 组内比较:传统开胸手术组术中HR、MAP、CVP较术前下降(P<0.05),PET-CO2较术前上升(P<0.05),术后HR较术中降低(P<0.05),CVP较术中上升(P<0.05),而术前、术中、术后其他指标相比差异不显著(P>0.05);全腔镜切除术组术中HR、MAP较术前降低(P<0.05),术后HR、MAP、PET-CO2较术中上升(P<0.05),而术前、术中、术后其他指标差异无统计学意义(P>0.05)。见表1。
2.1.2 组间比较:2组术前HR、MAP、SpO2、CVP、PET-CO2及PH值相比差异不显著(P>0.05);全腔镜切除术组术中HR、PET-CO2均低于传统开胸手术组(P<0.05),术后HR高于传统开胸手术组,CVP、PH值低于传统开胸手术组,差异均有统计学意义(P<0.05)。见表1。

表1 2组术前、术中及术后检测指标比较
2.2 2组手术短期疗效比较 全腔镜切除术组术中出血量、拔管时间均低于传统开胸手术组(P<0.05),2组胸部手术时间、术后第1天胸腔引流量、住院时间差异无统计学意义(P>0.05)。见表2。

表2 2组手术短期疗效评价指标比较
2.3 2组患者胸部淋巴结清扫情况比较 全腔镜切除术组胸部淋巴结总数、喉返神经旁淋巴结数、喉返神经旁淋巴结阳性数均高于传统开胸手术组,差异均有统计学意义(P<0.05)。见表3。

表3 2组胸部淋巴结清扫情况比较 个,
2.4 2组术后并发症发生率比较 传统开胸手术组术后并发症总发生率为40.00%(14/35),全腔镜切除术组术后并发症总发生率为16.67%(6/36),全腔镜切除术组术后并发症总发生率显著低于传统开胸手术组,差异均有统计学意义(χ2=13.402,P<0.05)。见表4。

表4 2组术后并发症发生率比较 例(%)
3 讨论
腹腔镜下切除术在恶性肿瘤治疗方面优势明显,既往荟萃分析证实,全胸腔镜肺癌根治术治疗非小细胞肺癌的临床疗效(远期)与开放手术相比毫不逊色[8],腹腔镜组4年生存率较开胸组提高了17%[9]。当然其在食管癌临床治疗方面也有巨大进步,这与腹腔镜下切除技术成熟,手术操作空间大,手术视野暴露充分等相关。但目前对腹腔镜下切除术在食管癌治疗方面的根治性、微创性、安全性仍尚存争议,故有研究的必要性。
全胸腔镜肺癌根治术在食管癌根治性方面的关键优势主要体现在淋巴结清扫方面,对提高患者术后生存有益。全腔镜切除术组胸部淋巴结总数、喉返神经旁淋巴结数、喉返神经旁淋巴结阳性数等胸部淋巴结清扫情况与传统开胸手术组相比显著更高(P<0.05),清扫结果与开放手术相比较接近,提示腹腔镜辅助食管癌根治术符合肿瘤根治的基本原则,与Hamouda等[10]分析结果吻合。(1)全腔镜下切除术能提供深部照明,放大手术视野,将早中期胸中段食管癌组织的解剖结构充分暴露,确保淋巴结清扫更精细、更安全,传统开胸手术显然无法达到此水准。(2)全腔镜下切除术的淋巴结清扫主要借助于超声刀游离,易损及临近器官或引起出血,这与手术操作缺乏触觉有一定相关性,故术前合理评估早中期胸中段食管癌淋巴结大小(<5 cm),选择适合的手术方法极关键。(3)全腔镜下切除术更注意气管膜部和锁骨下动静脉的保护,能有效避免隆突下淋巴结和双侧喉返神经旁淋巴结清扫的安全性,降低其永久性损伤;同时,全腔镜下切除术能有效降低肿瘤种植转移。侯强强[11]腹腔镜组、传统开胸组的短期复发或转移率为14.20%和15.10%,与本文11.11%和20.00%相近,其中全腔镜切除术组较上述研究偏低,传统开胸手术组较上述研究偏高,原因可能与样本量的选取有关,故评价本手术方法的远期疗效须增大样本量。术中出血量、手术时间、术后第1天胸腔引流量、拔管及住院时间等是全腔镜切除术微创性好坏的关键。陈保富等[12]证实,胸腹腔镜手术在食管癌临床治疗方面优势明显,Jawitz等[13]发现,胸腹腔镜手术治疗食管癌术中出血量更低,术后恢复更快。全腔镜切除术组术中出血量、拔管时间均低于传统开胸手术组(P<0.05)。(1)全腔镜切除术无需离断胸大肌、前锯肌肋间肌等[14,15]胸部肌肉组织,能确保试管血液的阶段性供血,避免腹部切口出血和创伤。(2)全腔镜切除术耗时更短,由于其良好的手术视野和组织、血管暴露,减少术中出血,节约拔管时间。但全腔镜切除术仍存吻合口瘘、喉返神经损伤,故可能影响组内临床治疗的整体疗效(如换药时间、禁食期延长等[16]问题),需重视。肺部感染是传统食管癌切除术的主要并发症,通过比较2组相关数据发现,全腔镜切除术组的并未发生肺部感染,原因可能为:(1)全腔镜切除术能有效的保护病患的脏器功能,避免肺部组织致病菌感染;(2)样本量偏低。而传统开胸手术组有1例,原因在于本手术需切断背阔肌、前锯肌和正中腹部组织[17]才能实现手术治疗,切口长,创伤大,术中需长时间分开肋骨,因此病患术后疼痛更明显,呼吸功能更损害严重;研究发现,术后疼痛会降低食管癌患者的主动性咳嗽频率,咳痰减少,故极易增加呼吸功能障碍风险。相比较而言,全腔镜切除术的安全性较传统开胸手术更高[18,19]。
综上所述,全腔镜切除术在早中期食管癌的临床治疗中根治性更高、微创性更好,安全性更优,较传统开胸手术优势明显,可明显减少病患术中出血量,提高胸部淋巴结、喉返神经旁淋巴结清扫率,降低术后并发症,创伤小、出血少、恢复快,并发症低等特征,可在食管癌治疗方面推广与普及。

