LncRNA LUCAT1靶向调控miR-937-5p/MMP13轴对非小细胞肺癌细胞增殖、迁移能力的影响
付堂清 李文忠 罗仕云 师路 杜镇鸿
肺癌是导致癌症相关死亡的主要原因之一,非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌病例的80%以上[1]。约60%的肺癌患者在确诊时已处于晚期,无法通过根治性手术治疗。由于NSCLC细胞对于化疗、放疗和靶向治疗的耐药性,晚期NSCLC的治疗仍然极具挑战[2,3]。长链非编码核糖核酸(long non-coding ribonucleic acid,LncRNA)肺癌相关转录物1(lung cancer-associated transcript 1,LUCAT1)可以促进部分癌症的进展。LUCAT1在NSCLC组织和细胞系中的表达水平显著升高,促进NSCLC细胞对顺铂的耐药性,敲低LUCAT1可显著抑制了裸鼠异种移植肿瘤的生长[4,5]。这些研究证实LUCAT1是NSCLC的一个有潜力的治疗靶点,而LUCAT1对NSCLC进程的促进作用的详细机制值得进一步研究。微小RNA(microRNA,miRNA)在癌症生物学中也占有重要地位,其中微小RNA-937-5p(microRNA-937-5p,miR-937-5p)是近期新发现的一类miRNA。据报道,miR-937-5p在结直肠癌中表达升高,可通过下调其靶基因促进肿瘤细胞增殖、迁移和血管生成[6]。据报道,基质金属蛋白酶家族成员基质金属蛋白酶13(matrix metalloproteinase 13,MMP-13)在包含NSCLC在内的肿瘤发展中具有重要作用[7]。因此,本研究将探究LUCAT1在NSCLC中的生物学功能及其调控机制,以期为NSCLC的靶向治疗提供实验依据,报道如下。
1 资料与方法
1.1 一般资料 本研究经医院伦理委员会批准,并且获得每位患者的书面知情同意书,均按照赫尔辛基宣言的原则进行。招募2018年4月至2020年4月本院术前未接受放疗、化疗或靶向治疗的65例NSCLC患者,其中男38例,女27例;平均年龄(52.45±6.36)岁,其中肺腺癌40例,患者诊断为患者肺鳞状细胞癌25例。术中采集NSCLC组织及其相应癌旁组织,所有组织标本切除后立即在液氮中冷冻并保存在-80℃冰箱中待测。
1.2 主要材料 NSCLC细胞系H1299(YS743C)、H1975(YS213C)、A549(YS1995C)和H2228(YS3251C)与人正常肺上皮细胞系BEAS-2B(AC-2620H)均获自美国典型培养物保藏中心(ATCC);胎牛血清(C0227)、青霉素-链霉素(ST488)、BrdU(≥99%,ST1056)、DAPI(C1002)、RIPA裂解液(P0013B)、ECL试剂盒(P0018FS)均获自上海Beyotime;PRMI-1640培养基(A1049101)获自美国Thermo Fisher Scientific;靶向LUCAT1的shRNA(sh-LUCAT1)和相应阴性对照(sh-NC)、miR-937-5p抑制物(anti-miR-937-5p)、miR-937-5p模拟物(miR-937-5p mimics)和相应阴性对照(miR-NC mimics)均购自上海Genepharma;Lipofectamine 2000(11668500)、pcDNA3.1表达载体(V79020)、TRIzol试剂(10296010)、SuperScript IV逆转录酶(18090010)购自美国Invitrogen;QuantiTect SYBR Green PCR试剂盒(DXT-204143)获自美国Aiagen;一抗MMP13(ab51072,60 kDa)、GAPDH(ab9485,37 kDa)、二抗山羊抗兔IgG H&L(HRP,ab205718)均获自英国Abcam;Cell Counting Kit-8(CCK-8,CK04)获自日本Dojindo;Dual-Luciferase Reporter Assay System(E1910)获自美国Promega。
1.3 方法
1.3.1 细胞培养与转染:人正常肺上皮细胞系BEAS-2B和NSCLC细胞系(H1299、H1975、A549和H2228)维持在含有10%胎牛血清、1%双抗的PRMI-1640培养基中,在5%CO2的恒温(37℃)培养箱中培养。将靶向MMP-13 mRNA序列亚克隆到pcDNA3.1获得MMP-13过表达质粒(OE-MMP-13)。同时,将A549细胞转移至96孔板中(1×104个/孔)依次分为Control组(正常培养)、sh-NC组(转染sh-NC)、sh-LUCAT1组(转染sh-LUCAT1)、sh-LUCAT1+anti-miR-937-5p组(转染sh-LUCAT1和anti-miR-937-5p)、sh-LUCAT1+OE-MMP-13组(转染sh-LUCAT1和OE-MMP-13)。转染前,使用不含血清的PRMI-1640培养基培养24 h。按照说明,将Lipofectamine 2000与上述寡核苷酸或质粒混合,并添加到培养基中,24 h后更换为完全培养基,继续培养24 h,用定量实时聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)和蛋白印迹检测转染效率。
1.3.2 qRT-PCR检测基因相对表达水平:使用TRIzol试剂从组织或细胞中提取总RNA。采用微量分光光度计(美国NanoDrop 2000)检测总RNA的浓度和纯度,采用Agilent-2100凝胶电泳系统(上海安捷伦)检测总RNA的完整性。使用逆转录试剂盒进行RNA的逆转录。使用QuantiTect SYBR Green PCR试剂盒在ABI 7500 FAST实时PCR系统(美国Applied Biosystems)上进行qRT-PCR。GAPDH用作LUCAT1和MMP13 mRNA定量的内部对照,U6用作miR-937-5p定量的内部对照。根据2-ΔΔCt公式计算目的基因相对表达水平,引物由中国深圳华大基因公司合成。本研究中使用的详细引物序列如下:LUCAT1:正向5’-ACCAGCTGTCCCTCAGTGTTCT-3’,反向5’-AGGCCTTTATCCTCGGGTTGCCT-3’;miR-937-5p正向5’-GTGAGTCAGGGTGGGGCTGG-3’,反向5’-TGGTGTCGTGGAGTCG-3’;MMP13正向5’-CCTGGACAAGTAGTTCCAAAGG-3’,反向5’-AGGGATAAGGAAGGGTCACAT-3’;GAPDH正向5’-GAAGGTGAAGGTCGGAGTC-3’,反向5’-GAAGATTGGTGATGGGATTTC-3’;U6正向5-CTCGCTTCGGCAGCACA-3’,反向5-AACGCTTCACGAATTTGCGT-3’。
1.3.3 蛋白印迹检测蛋白水平:将转染后的A549细胞用RIPA裂解液提取总蛋白。将蛋白与上样缓冲液混合后变性。随后,将每组中蛋白质样品通过SDS-PAGE分离后转移至PVDF膜,5%脱脂牛奶封闭膜1 h。添加一抗(MMP-13和GAPDH,稀释度1∶1 000),将PVDF膜在4℃下孵育过夜。使用二抗(山羊抗兔IgG,稀释度1∶5 000)孵育1.5 h。ECL试剂盒对蛋白质显影后使用Image J对蛋白质条带的灰度值进行定量分析。GAPDH作为内部对照。
1.3.4 CCK-8检测细胞活力:将转染后的A549细胞制备单细胞悬液并转移至96孔板中(2×103个/孔),培养48 h后向每个孔中添加10 L CCK-8溶液,1 h后使用SAFAS Xenius XL酶标仪(上海瑞轩)检测每个孔在450 nm处的吸光度。
1.3.5 BrdU检测细胞增殖:将转染后的A549细胞制备单细胞悬液并接种到24孔板中(1×105个/孔),向每孔中添加BrdU试剂,培养12 h后,将细胞与抗BrdU抗体在室温下孵育2 h。之后使用DAPI染色液对细胞进行复染。然后在CX41荧光显微镜(日本Olympus)下对BrdU阳性细胞数和DAPI阳性细胞数进行统计。细胞增殖率(%)=BrdU阳性细胞/DAPI阳性细胞×100%。
1.3.6 Transwell检测细胞迁移:无血清培养基将转染后的A549细胞制备单细胞悬液,细胞密度为1×105个/ml。吸取100 μl悬浮液加入到Transwell小室的上室中,下室中加入600 μl含有10%胎牛血清的PRMI-1640培养基。24 h后,用棉签擦去上室剩余的细胞,迁移的细胞用4%多聚甲醛固定,结晶紫染色。在显微镜下对通过膜的细胞进行计数。
1.3.7 双荧光素酶报告基因检测:将预测的LUCAT1或MMP13 3’-UTR与miR-937-5p之间的结合序列扩增并克隆到pmirGLO载体中用于构建野生型(WT)报告载体(LUCAT1 WT和MMP-13 WT)。然后对结合序列进行突变,将突变的序列扩增并克隆到pmirGLO载体中用于构建突变型(MUT)报告载体(LUCAT1 MUT和MMP-13 MUT)。将上述报告载体与miR-937-5p mimics或miR-NC mimics共转染到A549细胞中。48 h后测定荧光素酶的活性,萤火虫荧光素酶的活性标准化为海肾荧光素酶的活性。
1.3.8 体内实验:体内实验经本医院伦理委员会审查并批准。20只雄性BALB/c裸鼠,6~8周龄,平均体重(22.5±2.0) g,购自河南省实验动物中心,许可证号SCXK(豫)2017-0001。将裸鼠维持在标准动物房条件下(23℃、40%湿度、12 h光照和黑暗循环、自由获取食物和水)。适应饲养后将动物分为2组(sh-NC组和sh-LUCAT1组,每组10只)。将上述转染的A549细胞(1×105个/只)注射到对应裸鼠中,3周后,将裸鼠安乐死,测量肿瘤体积并称重。通过qRT-PCR检测各肿瘤组织中LUCAT1、miR-937-5p和MMP13 mRNA相对表达水平。
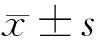
2 结果
2.1 LUCAT1、miR-937-5p和MMP-13 mRNA在NSCLC组织和细胞系中的表达水平 与癌旁组织比较,NSCLC组织中LUCAT1和MMP-13 mRNA表达水平明显增高,miR-937-5p表达明显降低(P<0.05)。与BEAS-2B细胞相比,NSCLC细胞系中LUCAT1和MMP-13 mRNA表达水平明显增高,miR-937-5p表达明显降低,差异均有统计学意义(P<0.05)。鉴于在NSCLC细胞系中,A549细胞中LUCAT1表达最高,因此选用此细胞建立LUCAT1敲低细胞模型,进行后续研究。见表1、2。

表1 qRT-PCR检测组织中LUCAT1、miR-937-5p和MMP-13 mRNA表达

表2 qRT-PCR检测细胞中LUCAT1、miR-937-5p和MMP-13 mRNA表达
2.2 5组A549细胞转染效率验证 与sh-NC组比较,sh-LUCAT1组A549细胞中LUCAT1和MMP-13表达水平均显著降低,miR-937-5p表达显著增高,差异均有统计学意义(P<0.05)。与sh-LUCAT1组比较,sh-LUCAT1+anti-miR-937-5p组A549细胞中LUCAT1表达变化未达到统计阙值(P>0.05),miR-937-5p表达显著降低,MMP-13表达显著增高,差异均有统计学意义(P<0.05);sh-LUCAT1+OE-MMP-13组A549细胞中LUCAT1和miR-937-5p表达变化未达到统计阙值(P>0.05),MMP-13表达显著增高(P<0.05)。而sh-NC组与Control组相比,以上各基因表达差异均无统计学意义(P>0.05)。见表3,图1。

表3 5组A549细胞中LUCAT1、miR-937-5p和MMP-13表达情况

图1 免疫印迹检测A549细胞中MMP-13蛋白水平;1~5依次表示为Control组、sh-NC组、sh-LUCAT1组、sh-LUCAT1+anti-miR-937-5p组和sh-LUCAT1+OE-MMP-13组
2.3 5组A549细胞增殖、迁移能力 与sh-NC组比较,sh-LUCAT1组A549细胞活力、细胞增殖率和迁移细胞数量均显著降低(P<0.05)。与sh-LUCAT1组比较,sh-LUCAT1+anti-miR-937-5p组或sh-LUCAT1+OE-MMP-13组A549细胞活力、细胞增殖率和迁移细胞数量均显著增高(P<0.05)。而sh-NC组与Control组比较,以上指标差异均无统计学意义(P>0.05)。见图2、3,表4。

图2 BrdU检测5组A549细胞增殖情况(×200)

图3 Transwell检测5组A549细胞迁移情况(×200)

表4 5组A549细胞增殖、迁移情况比较
2.4 LUCAT1、miR-937-5p和MMP-13之间关系验证 使用生物信息学工具分析发现,LUCAT1与miR-937-5p、miR-937-5p与MMP-13 3’UTR之间存在相互作用位点。通过双荧光素酶报告基因检测证实,转染miR-937-5p mimics显著抑制了LUCAT1 WT报告载体的荧光素酶活性(P<0.05),而LUCAT1 MUT的荧光素酶活性未观察到明显变化(P>0.05),说明LUCAT1与miR-937-5p之间存在相互作用关系。同理证实miR-937-5p与MMP-13之间亦存在相互作用关系。见图4,表5。

图4 生物信息学预测LUCAT1与miR-937-5p、miR-937-5p与MMP-13 3’UTR之间存在互补结合位点

表5 双荧光素酶验证LUCAT1与miR-937-5p、miR-937-5p与MMP-13 3’UTR相互作用关系
2.5 敲低LUCAT1调控miR-937-5p/MMP-13轴抑制NSCLC细胞体内生长 用异种移植肿瘤检查LUCAT1对NSCLC细胞体内生长的影响。与sh-NC组比较,sh-LUCAT1组裸鼠肿瘤体积及重量均显著降低(P<0.05)。qRT-PCR结果显示,敲低LUCAT1后,肿瘤组织中miR-937-5p水平升高,MMP-13 mRNA水平降低(P<0.05)。见图5,表6。

图5 2组裸鼠解剖的肿瘤图像

表6 敲低LUCAT1通过调控miR-937-5p/MMP-13轴抑制NSCLC细胞体内生长
3 讨论
肺癌的发病率和死亡率都很高,NSCLC作为常见的肺癌类型,引起了极大的关注。鉴于目前晚期NSCLC患者预后较差,存活率低[8]。因此,深入了解NSCLC的分子机制对制定有效的治疗策略具有极大帮助。越来越多的研究证实LncRNA在包含NSCLC在内的多种癌症的发生和进展中发挥重要作用。例如:PCGEM1在NSCLC细胞和组织中上调,敲低其表达可显著抑制NSCLC细胞恶性行为进展[9]。在以往的研究中,LUCAT1在NSCLC中的作用已经得到初步的探索。据报道,LUCAT1在NSCLC组织和细胞系中表达水平升高,并且LUCAT1的敲低阻碍了NSCLC细胞的增殖、迁移和侵袭;此外,LUCAT1的敲低会增加A549细胞对顺铂的敏感性[4]。
本研究表明LUCAT1的表达在NSCLC组织和细胞系中显著增加。通过体外功能实验表明,敲低LUCAT1抑制了NSCLC细胞活力、增殖和迁移。此外,NSCLC体内异种移植肿瘤实验表明,LUCAT1的敲低抑制了体内肿瘤组织的生长。以上结果表明,LUCAT1是NSCLC中的一种致癌LncRNA,可能是该病有希望的治疗靶点。
竞争性内源性RNA(ceRNA)网络是一种常见的转录后调控机制,是指LncRNA与mRNA竞争与miRNA结合,从而解除miRNA对mRNA的抑制作用[10]。这种由LncRNA和miRNA相互作用形成的ceRNA网络已经在包括NSCLC在内的多种癌症的发展中被报道[11]。例如,EWSAT1通过竞争性结合miR-330-5p调节其表达进而影响NSCLC进展[12]。因此,本研究探讨了LUCAT1是否作为ceRNA上调NSCLC中某些mRNA。通过生物信息学分析发现,miR-937-5p可能是LUCAT1的潜在靶标。在之前的一些研究中探索了miR-937-5p在癌症生物学中的作用。例如:miR-937-5p在乳腺癌中发挥原癌基因作用,抑制其表达可显著抑制乳腺癌细胞增殖并引起S期细胞停滞[13]。在这项研究中发现,miR-937-5p在NSCLC组织和细胞中表达降低,与前人研究[6,13]并不相同。表明miR-937-5p在NSCLC中发挥抑癌作用,其在不同癌症中可能发挥不同的生物学效应。随后,通过双荧光素酶报告基因实验检测并证实了miR-937-5p与LUCAT1之间的相互作用,同时抑制LUCAT1可明显上调miR-937-5p的表达,表明LUCAT1可靶向负调控miR-937-5p表达。此外,转染miR-937-5p抑制剂逆转了敲低LUCAT1对NSCLC细胞增殖和迁移的影响。这些数据表明LUCAT1通过与miR-937-5p结合参与NSCLC的发展功能。
MMP-13是首次在乳腺癌中发现的一类发挥致癌作用的基因,下调其表达可显著抑制癌细胞进展[14]。例如抑制MMP-13表达可通过抑制前列腺癌细胞的侵袭和迁移能力阻止前列腺癌的转移[15]。已有研究证实,MMP-13过表达可作为肺腺癌患者发生脑转移的驱动因素之一[16],且上调MMP-13表达可增加肺腺癌的顺铂耐药[17]。另外,MMP-13还可作为迁移、侵袭标志性蛋白促进肺癌转移性[3,18]。在本研究中,MMP-13被证实是miR-937-5p的新靶点,同时证明LUCAT1可通过靶向miR-937-5p间接调控MMP-13的表达。同时证实,过表达MMP-13可明显抑制敲低LUCAT1对NSCLC增殖、迁移的影响。以上数据表明,由LUCAT1、miR-937-5p和MMP-13形成的ceRNA网络导致NSCLC中MMP-13表达失调,进而影响NSCLC细胞增殖和迁移。
总之,以上研究表明敲低LUCAT1可以通过靶向上调miR-937-5p表达间接抑制MMP-13的表达,进而通过抑制细胞增殖和迁移在NSCLC中发挥抑癌作用。

