外源6-BA调控孕穗期低温后小麦幼穗发育的转录组分析
李凌雨 周琦锐 李 洋 张安民 王贝贝 马尚宇 樊永惠 黄正来张文静
安徽农业大学农学院, 安徽合肥 230036
由于极端天气的频繁发生, 低温胁迫已成为制约小麦(Triticum aestivumL.)生产的主要灾害之一。低温会造成小麦的产量下降, 其中以孕穗期低温对小麦产量的影响最为直接, 此时小麦正处于关键生育时期, 对低温非常敏感[1], 幼穗是否能够发育良好直接决定了小麦最终产量的高低[2]。目前已有研究表明, 孕穗期低温胁迫后外源喷施6-BA能有效缓解低温对小麦的伤害[3], 但其相关的分子调控机制仍不明确。因此探究6-BA调控孕穗期低温后小麦幼穗发育的分子机制, 可为探索减轻春季低温对小麦伤害的栽培措施提供理论基础。
低温胁迫下, 植物内部会发生多种响应途径以适应环境和自我保护, 如渗透调节物质的积累、抗氧化系统的调节、内源激素水平的调节等[4]。低温胁迫会影响小麦正常生长发育, 施用外源植物生长调节剂能在一定程度上提高植物抗寒性, 而6-BA作为一种在植物生理反应中具有多种功能的细胞分裂素,在调控小麦等多种植物的抗逆性方面都发挥着关键作用[5-7]。目前有研究表明, 6-BA能显著改善低温引起的植株生长不良和叶绿素含量的下降, 调节小麦内源激素水平变化, 提高抗氧化酶活性, 促进籽粒灌浆, 提高小麦产量[8-10]。另有研究表明, 使用6-BA还可显著提高碳水化合物含量(蔗糖、己糖和淀粉)[11-12]。Wang等[13]通过转录组分析发现, 使用6-BA后白菜叶片中有大量差异基因富集于抗氧化物质合成、植物激素信号转导和呼吸代谢等过程。干旱胁迫下外源硫化氢(H2S)能够提高小麦抗旱性, Li等[14]研究发现,H2S减轻干旱伤害可能与运输系统、植物激素信号转导、蛋白质加工、脂肪酸和氨基酸代谢等途径有关。
目前针对6-BA影响小麦抗寒性的研究主要集中于叶片生理活性和产量的变化, 通过转录组测序探究其分子调控机制的研究仍比较匮乏。本研究选用低温敏感性不同的小麦品种, 于孕穗期低温处理后喷施6-BA, 通过对小麦幼穗进行转录组测序, 明确外源6-BA缓解低温对小麦幼穗伤害的调控途径及重要调控基因。
1 材料与方法
1.1 试验材料
本试验选用的小麦品种为对低温敏感型小麦品种皖麦52 (安徽省宿州市种子公司选育)和迟钝型小麦品种烟农19 (山东省烟台市)农业科学院小麦研究所选育)。
1.2 试验设计
本试验于2020年11月至2021年6月于安徽省合肥市安徽农业大学试验基地农萃园进行(31.52°N、117.17°E)。试验点属亚热带季风湿润气候区, 年平均降水量约900~1000 mm, 年平均气温约15~16℃。试验地土壤有机质含量为15.16 g kg-1, 全氮含量为0.86 g kg-1, 速效氮、速效磷、速效钾含量分别为149.61、22.31和101.67 mg kg-1。采用盆栽的栽培方式, 每个盆高30 cm, 直径30 cm, 盆底开6个排水孔。每盆装9 kg筛过的土壤(取自田间0~20 cm的耕作层), 将盆埋入试验田, 盆内土壤与地面齐平,每盆添加有机肥(微生物菌剂, 有机质含量≥80%)45 g, 复合肥7 g (N∶P∶K=15∶15∶15), 尿素4.57 g(含氮量46%), 拔节期追施尿素2.28 g。于2020年11月5日进行播种, 先覆沙土0.6 kg, 播种后再覆沙土0.9 kg, 齐苗后, 间苗至每盆10株。其他田间管理措施均按高产栽培要求进行。
于小麦孕穗期(2021年3月18日)将盆栽移入人工气候室进行低温处理。人工气候室18:00—06:00温度设定为-2℃, 06:00—18:00温度设置为5℃, 气候室相对湿度设置为70%, 连续处理24 h。处理结束后将盆栽移回大田, 于次日上午10:00, 根据前期试验选择喷施浓度为20 mg L-1的6-BA溶液至叶片正反两面均有一层小水珠欲滴落为止, 以喷施等量蒸馏水的同品种小麦作为对照, 24 h后取样。样品经液氮速冻后, 用于总RNA提取和转录组测序。
1.3 可溶性糖及淀粉含量测定
外源6-BA处理10 d后取小麦幼穗, 105℃杀青0.5 h, 80℃烘干至恒重后粉碎并过100目筛, 称取0.1 g样品至10 mL离心管, 加入8 mL配制的80%乙醇溶液80℃水浴30 min, 冷却后离心, 重复3次,合并上清液用于测定可溶性糖, 残渣用于测定淀粉,采用蒽酮比色法测定可溶性糖和淀粉含量[15]。
1.4 RNA-seq测序及差异表达基因筛选
转录组测序由上海欧易生物医学科技有限公司完成, 构建好的文库用Agilent 2100 Bioanalyzer质检合格后, 使用Illumina HiSeq测序仪进行测序。原始数据使用Trimmomatic[16]软件进行质控并去除接头, 得到高质量的clean reads。利用HISAT2[17]将clean reads与参考基因组进行比对。使用Cufflinks软件计算每千个碱基的转录每百万映射读取的fragments (FPKM值), 以对转录本或基因的表达水平进行定量[18-19]。使用DESeq (2012) R软件检测差异表达基因, 将P-value < 0.05且差异倍数Fold Change > 2作为筛选标准。
1.5 差异基因注释和功能富集分析
对样品间筛选出的差异基因进行GO富集分析,结合GO注释结果对差异基因功能进行描述, 并用超几何分布检验方法计算每个GO条目中差异基因富集的显著性。利用KEGG (Kyoto Encyclopedia of Genes and Genomes)数据库对差异基因进行Pathway分析, 并用超几何分布检验的方法计算每个Pathway条目中差异基因富集的显著性, 以判定差异基因主要影响的生物学功能或者通路。
1.6 差异基因的qRT-PCR验证
以小麦GAPDH基因作为内参基因, 选择差异基因ARF5、AGPL1、SWEET15为待验证基因, 主要功能涉及生长素、淀粉合成和糖转运。特异性引物序列见表1。用SYBR Green染料进行qRT-PCR, 重复3次。采用2-ΔΔCt法进行计算, 得出样本间表达量差异倍数关系。

表1 实时荧光定量PCR所用的引物Table 1 Primers for qRT-PCR used in this study
1.7 数据处理
幼穗生理数据采用SPSS 22.0软件进行方差分析, 用Origin 2017进行作图。韦恩图、聚类热图由在线软件制作(https://cloud.oebiotech.com/task/)。
2 结果与分析
2.1 幼穗形态
如图1所示, 外源喷施6-BA溶液10 d后, 烟农19和皖麦52幼穗形态都出现了明显的变化。与对照相比, 6-BA处理后的小麦幼穗生长状态更好, 穗形更加饱满, 穗长也优于对照。

图1 外源6-BA处理后幼穗表型变化Fig. 1 Phenotypic changes of young spike after exogenous 6-BA treatmentWanmai 52 CK为皖麦52低温处理后喷施清水; Wanmai 526-BA为皖麦52低温处理后喷施6-BA溶液; Yannong 19 CK为烟农19低温处理后喷施清水; Yannong 196-BA为烟农19低温处理后喷施6-BA溶液。Wanmai 52 CK is Wanmai 52 sprayed with water after low temperature treatment; Wanmai 526-BA is Wanmai 52 sprayed with 6-BA solution after low temperature treatment; Yannong 19 CK is Yannong 19 sprayed with water after low temperature treatment;Yannong 19 CK is Yannong 19 sprayed with 6-BA solution after low temperature treatment.
2.2 幼穗可溶性糖含量和淀粉含量
与对照相比, 外源6-BA处理10 d后小麦幼穗中可溶性糖含量显著上升, 皖麦52与对照相比上升5.34%, 烟农19与对照相比上升9.55% (图2)。与对照相比, 低温胁迫后喷施6-BA小麦的淀粉含量也随之上升, 皖麦52与对照相比上升7.17%, 烟农19与对照相比上升10.50%。低温胁迫下植株为了增强对胁迫的适应性保护自身, 需要消耗更多的糖及其他能量载体, 喷施6-BA后糖及淀粉含量增加有利于增强植株对低温胁迫的抵抗能力。
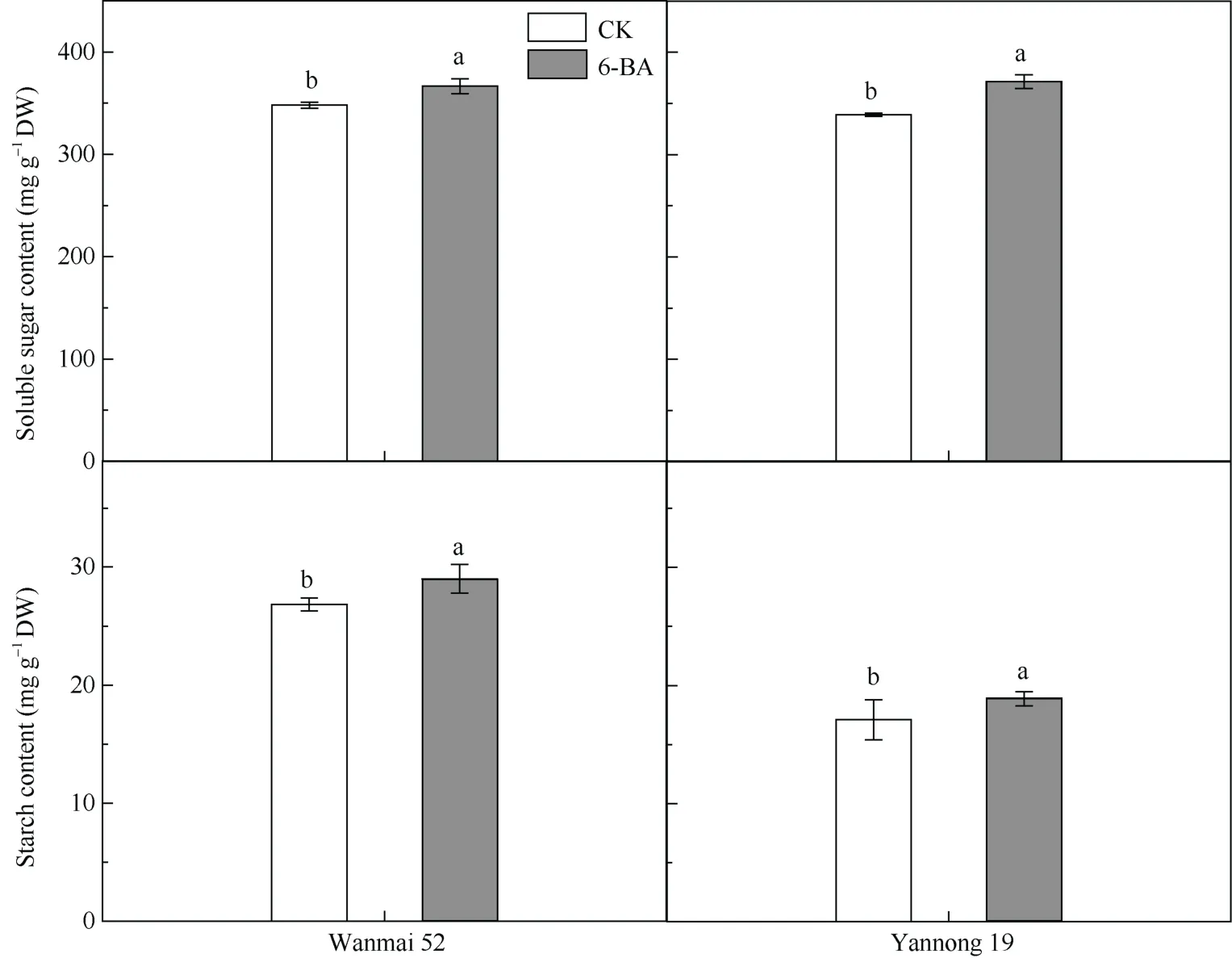
图2 幼穗可溶性糖含量及淀粉含量Fig. 2 Soluble sugar and starch content in young spikes
2.3 转录组数据分析
测序共获得79.75G的Clean Data。Q30的碱基分布均超过94.90%。每个样本中reads与小麦参考基因组的比对率为94.52%~97.10%。样品间相关性检验表明, 重复样品间的相关系数均超过0.99, 生物重复一致性极高。
皖麦52共检测出差异基因22,770个, 其中有8080个基因表达上调, 14,690个基因表达下调; 烟农19检测出差异基因9866个, 其中有4991个基因表达上调, 4875个基因表达下调。根据韦恩分析可知, 有661个差异基因在两小麦品种中均上调, 1220个差异基因均下调。
2.4 差异表达基因的GO注释与富集

图3 差异表达基因的韦恩图Fig. 3 Venn plots of differently expressed genes (DEGs)
对识别出的差异基因进行GO功能注释, 将其分为3个主要功能类别:分子功能、细胞组分和生物过程。在两类基因型小麦品种中, GO富集在生物过程、细胞成分和分子功能中的项数均为23、20和21。将两个品种差异基因富集最多的20个GO条目进行整合, 发现两个品种表现出了相似的富集趋势,差异基因富集最多的20个GO条目中有17条都相同(表2), 除了对刺激和转录因子结合活性的反应,其他过程可能在小麦响应外源6-BA缓解低温胁迫伤害的过程中发挥关键作用。其中大量差异基因被富集于细胞组分分类, 包括膜的有机成分(GO:0016021)、细胞膜(GO:0016020)和细胞核(GO:0005634), 另有大量基因参与跨膜转运(GO:0055085), 说明低温处理后喷施6-BA小麦内部细胞膜透性可能发生变化。

表2 低温胁迫后喷施外源6-BA差异表达基因的GO注释Table 2 GO annotation of DEGs after spraying 6-BA under low temperature stress
2.5 差异表达基因的KEGG富集
根据Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库开展通路富集分析。结果表明, 皖麦52的差异基因被成功富集到199条KEGG通路上,其中有80个通路显著富集。烟农19的差异基因被成功共富集187条KEGG通路上, 其中有56个通路显著富集。
通过KEGG分析发现, 两个品种在差异基因富集前20的通路中有10条相同的生理代谢途径(图4)。值的注意的是, 低温胁迫下喷施6-BA后, 低温敏感型和迟钝型品种中都显著富集了谷胱甘肽代谢、细胞色素P450、苯丙烷类生物合成、苯丙氨酸代谢等有关抗氧化的代谢途径。另外还在淀粉和蔗糖代谢、植物激素信号转导、精氨酸和脯氨酸代谢、乙醛酸和二羧酸代谢途径显著富集。表明低温胁迫后喷施外源6-BA, 抗氧化代谢、糖代谢、植物激素调节及渗透调节等可能增加植物抗寒性、缓解低温造成的伤害。

图4 KEGG通路富集散点图Fig. 4 Scatter diagram of KEGG pathway enrichment
淀粉和蔗糖代谢途径(ko00500)和激素信号转导途径(ko04075)在两基因型小麦品种中都排在差异基因富集前20的通路中。皖麦52中激素信号转导途径含有87条相关上调基因, 烟农19中含有96条相关上调基因。其中相同的差异基因有两条TraesCS4A02G207600、TraesCS4D02G014900, 都与生长素信号转导有关, 间接影响细胞增大和植物生长(图5)。淀粉和蔗糖代谢途径在皖麦52中含有89条相关上调基因, 烟农19中含有77条相关上调基因。其中两个品种的共有差异基因有 4条,TraesCS5D02G484500、TraesCS7D02G451800、TraesCS2D02G381000、TraesCS6B02G031300, 主要涉及淀粉、果糖和葡萄糖的合成(图6)。

图5 IAA信号通路基因表达模式分析Fig. 5 Analysis of gene expression pattern in IAA signaling pathway红蓝色块代表相应的FPKM数值, 数值越大, 颜色越红; 从左到右样本依次为皖麦52 CK、皖麦526-BA、烟农19 CK、烟农196-BA。The color lump represents the corresponding FPKM value, and the higher the value, the redder the color. The samples from left to right are Wanmai 52 CK, Wanmai 526-BA, Yannong 19 CK, and Yannong 196-BA.

图6 糖类物质积累相关基因表达模式分析Fig. 6 Analysis of the expression pattern of carbohydrate accumulation related genes色块所知内容同图5。The contents of the colors are the same as those given in Fig. 5.
2.6 qRT-PCR验证
为了验证转录组表达数据的可靠性, 选择3个在低温处理后喷施6-BA差异表达的基因, 用qRT-PCR进行验证(图7)。结果表明选取的目的基因表达趋势与转录组测序结果一致, 均表现为上调。证明转录组数据是真实可靠的。
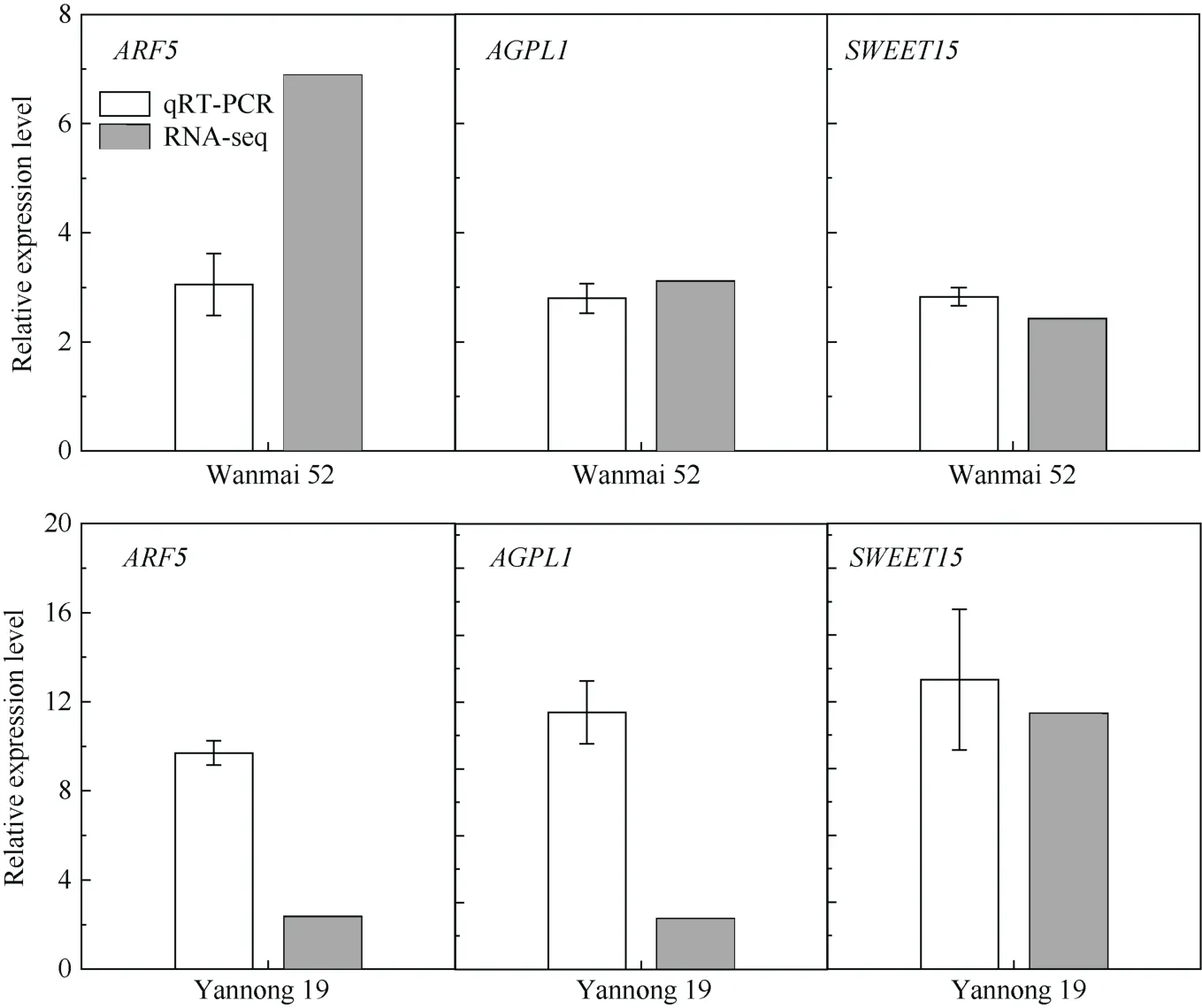
图7 差异表达基因qRT-PCR验证Fig. 7 Verification of the differentially expressed genes by qRT-PCR
3 讨论
3.1 差异表达基因分析
孕穗期低温会严重影响植株正常生长发育并降低小麦产量, 前人研究表明, 低温胁迫后喷施6-BA能缓解低温对小麦产量造成的不利影响[3]。低温胁迫下小麦对6-BA的响应是通过复杂的调控网络进行的, 而转录组分析则能够明晰这些调控机制。本研究对获得的差异表达基因进行统计分析, 结果表明两基因型小麦品种的处理与对照之间均存在大量的差异基因, 正是这些上调或下调基因导致处理与对照之间的差异表现。对两组RNA-seq数据进行进一步的韦恩分析, 确定了相关的候选基因, 外源6-BA处理后这些基因在低温敏感性不同的两种小麦中均显著上调。PMEI8和CCR1在上调基因中反复出现且高度显著, 这两个基因在维持细胞壁完整和对非生物胁迫的响应中均起着重要作用[20-23]。ARF5的表达在本试验中差异性显著, 生长素反应因子(ARF)是一类转录因子, 可作为介导生长素基因表达的关键调节因子[24]。因此外源6-BA可能通过激活ARF5转录, 启动了生长素信号转导, 从而促进低温胁迫后小麦的生长发育, 这可能是外源6-BA处理后小麦幼穗的穗形穗长优于对照的原因之一。同时韦恩分析显示, 两类小麦中与碳水化合物代谢相关的基因AGPL1、1-SST、SWEET15等也在上调基因当中。AGPL1在小麦籽粒淀粉合成中扮演重要角色, 其表达量与腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)的活性呈显著正相关, 而AGPase的活性又与籽粒内淀粉积累速率呈显著正相关[25-26], 有研究表明, 禾本科作物的AGPL1基因过表达可显著提高植株的AGPase活性与淀粉含量, 从而增加粒重与产量[27-28]。通过测定小麦幼穗的淀粉含量可知,喷施6-BA后两基因型小麦品种的淀粉含量均显著上升, 而AGPL1的显著上调很有可能就是引起幼穗中淀粉含量上升的原因。1-SST基因可诱导果聚糖合成, 果聚糖的积累可提高植物的抗寒性, 并且通过稳定植物膜系统使其免受低温胁迫的伤害[29-30]。已有研究证明SWEET15在低温胁迫下被诱导表达, 起到渗透调节的作用[31]。同时, Chen等[32]证明SWEET15和SWEET12、SWEET11的三重突变体种子表现为严重的缺陷, 包括粒重降低、淀粉和脂质含量下降以及种皮褶皱。
通过GO富集可知两类基因型小麦品种差异基因的功能都主要富集于细胞膜透性、结合作用、氧化还原过程、碳水化合物代谢、催化活性, 这些可能是小麦响应外源6-BA调控植株抗寒性、缓解低温伤害的关键功能基因。KEGG分析表明, 两个品种的差异表达基因均主要参与抗氧化代谢、植物激素信号转导、淀粉和蔗糖代谢、渗透调节等途径。Zhao等[33]对低温胁迫后的小麦植株进行转录组分析, 明确了渗透调节、碳水化合物代谢和激素信号转导等途径对低温胁迫的响应, 结合本试验说明6-BA在低温胁迫下可能会通过加强小麦体内的生理生化反应来提高小麦的抗寒性。两小麦品种在6-BA的作用下基本采用相似的响应途径来缓解低温胁迫造成的损伤, 这些途径主要与抗氧化、渗透调节、植物激素调节和碳水化合物代谢有关。
3.2 外源6-BA对幼穗形态、可溶性糖和淀粉含量及相关途径的影响
研究发现喷施6-BA后小麦幼穗的生长发育状态更好, 穗形饱满, 穗长增加(图1), 幼穗可溶性糖含量和淀粉含量均有提高。幼穗和小花的发育与植株内部能否提供充足的碳水化合物直接相关, 幼穗中可溶性糖能为小花的发育提供能量, 在小花分化发育期增加穗可溶性糖含量, 有利于促进小花发育为籽粒[34]。同时, 有研究表明。淀粉总是向生长发育迅速的器官积累, 而淀粉含量低的小穗在逆境中易停止发育转向退化[35]。因此, 幼穗中可溶性糖和淀粉含量的增加能促进小花发育和籽粒形成, 而外源6-BA处理后幼穗中可溶性糖和淀粉含量的增加可能是6-BA能缓解低温对小麦产量影响的原因。通过KEGG富集可知, 低温敏感性不同的两类小麦的差异基因均显著富集于IAA信号转导通路和淀粉和蔗糖代谢途径。生长素作为一类内源激素在植物的整个生命周期中都起重要作用, 植物能够快速感知和响应生长素水平的变化。AUX1属于AUX1/LAX家族, 主要负责生长素向细胞内的输入[36]。生长素上调小RNA (SAUR)家族是对生长素反应最迅速和最强烈的一类基因, 在植物体内起着较为关键的作用[37]。KEGG富集结果表明两类小麦的上调差异基因都富集于IAA信号通路的AUX1和SAUR。说明6-BA可能通过加强小麦内部的IAA信号转导来调节小麦遭遇低温后的生长发育, 这也可能是喷施6-BA后小麦幼穗穗形更饱满, 穗长更长的原因。淀粉和蔗糖代谢途径(ko00500)涉及许多复杂的通路,本研究中, 两类小麦有四个相同的上调差异基因富集到淀粉和蔗糖代谢途径, TraesCS5D02G484500、TraesCS7D02G451800、TraesCS2D02G381000、TraesCS6B02G031300, 分别涉及果糖、葡萄糖和淀粉的合成。这些基因表达上调, 促进糖类物质的合成, 而植物在低温胁迫下为了增强对低温的适应性,需要消耗更多的糖和其他能量载体来产生脂质、氨基酸等, 进一步促进细胞膜流动性和结构重排[38-39],因此糖类物质的增加有利于增强植物对低温的适应性。外源6-BA可能通过调控淀粉和蔗糖代谢途径来促进小麦内部糖类物质的合成以提高小麦抗寒性、促进小花发育和籽粒形成。
本研究发现孕穗期低温胁迫后喷施6-BA溶液,低温敏感型和迟钝型小麦幼穗的穗形都更饱满、穗长更长, 且幼穗可溶性糖含量和淀粉含量均有所增加。结合转录组分析发现, 外源6-BA处理后, 两类小麦的上调差异基因均显著富集于植物激素信号转导途径和淀粉和蔗糖代谢途径, 具体涉及IAA信号转导和果糖、葡萄糖及淀粉的合成。表明低温胁迫后6-BA通过调控与IAA信号转导和糖类物质合成相关的基因的表达, 来调节低温后小麦的生长发育、促进可溶性糖和淀粉的合成。
4 结论
通过对低温胁迫下外源6-BA处理后小麦的幼穗表型分析表明, 6-BA可以缓解低温胁迫造成的负面效应。转录组分析发现, 6-BA处理可诱导细胞膜透性、氧化还原及碳水化合物代谢等相关基因的表达, 通过调节小麦抗氧化物质代谢、渗透调节、激素信号转导和碳水化合物代谢等途径来缓解低温损伤、增强小麦抗寒性, qRT-PCR结果表明转录组测序结果准确可信。

