术前不同放射治疗对局部进展期直肠癌的效果对比
马 娜
湖北江汉油田总医院放射科,湖北省潜江市 433124
新辅助放化疗后再行手术切除是局部进展期直肠癌(LARC)(T3~T4/N+)的标准治疗模式[1]。术前放化疗可缩小瘤体,降低肿瘤分期,提高局控率和R0手术切除率,进而提高保肛率,延长患者生命周期,改善患者生存质量[2]。三维适形放疗(3DCRT)是直肠癌常见放疗方式,但因其计划靶区(PTV)为马蹄形,对小肠、膀胱等危及器官保护欠佳。容积调强弧形放疗(VMAT)是一种新型动态适形调强放疗,研究显示[3],VMAT剂量分布与适形指数更佳,可提高 LARC 5年生存率,但关于放疗后直肠癌病灶内恶性生物学标志基因表达特征的研究较少。直肠癌病灶内存在多种增殖、侵袭相关基因表达,其与直肠癌恶性生物学特征密切相关。基于此,本文探讨了3DCRT与VMAT对局部进展期直肠癌的疗效及对病灶内恶性生物学标志基因表达的影响,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2020年2月—2022年1月我院胃肠外科收治的80例LARC患者的临床资料。纳入标准:(1)确诊为直肠腺癌,经影像学或病理组织判定为Ⅱ或Ⅲ期;(2)既往无盆腔放疗史;(3)肿瘤距肛门距离<10cm;(4)同步化疗方案为卡培他滨单药治疗;(5)放化疗6~8周行全直肠系膜切除术(TME)。排除标准:(1)非腺癌;(2)合并其他恶性肿瘤或有远处转移;(3)合并严重的心、肝、肾疾病;(4)既往接受过放、化疗或免疫治疗等;(5)临床资料不完整。根据放疗方式的不同分为对照组和观察组,每组40例。对照组中男27例、女13例;年龄48~76岁,平均年龄(57.84±10.32)岁;吸烟史:有29例,无11例;手术方式:Dixon 23例、Miles 11例、Hartmann 6例。观察组男25例、女15例;年龄47~77岁,平均年龄(58.61±10.67)岁;吸烟史:有26例,无14例;手术方式:Dixon 26例、Miles 9例、Hartmann 5例。两组性别、年龄、吸烟史、手术方式等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批。
1.2 放疗方法 对照组采用3DCRT技术,治疗计划仅为临床靶区(CTV)外扩6~9mm,形成一个计划靶区(PTV);观察组采用VMAT技术,治疗计划为肿瘤靶区(GTV)外扩6~9mm形成计划靶区1(PTV1),CTV外扩6~9mm形成PTV2。放疗1次/d,5次/周,共进行5周。对照组处方剂量:46Gy/2.0Gy×23F;治疗计划系统采用常规3野设计(后野+左右野),剂量分布为(1.6~2)∶1∶1,左右野常规加30°~60°固定或合成楔形板。95%处方剂量的等剂量线包含96%以上PTV,最低剂量为93%。观察组处方剂量:PTV1为50Gy/2 Gy×25F,PTV2为46Gy/1.84Gy×25F;治疗计划100%处方剂量的等剂量线包含98%以上PTV,采用单弧照射。放疗时行同期卡培他滨单药化疗(1.0g/m2),2次/d,5d/周。放化疗结束后6~8周,行TME治疗。
1.3 观察指标 (1)手术情况:包含手术时间、术中出血量、保肛率及R0切除率。(2)术后TNM分期及病理缓解情况;(3)基因表达水平:分别取患者术前直肠活检病灶及手术切除的病灶进行基因表达检测。试剂盒为北京康为世纪生产,检测时先采用分离病灶内RNA(超纯RNA提取试剂盒),然后将RNA合成cDNA(Super RT cDNA第一链合成试剂盒),再取cDNA 2μl与UItraSYBR Mixture试剂10μl、引物0.8μl等混合,进行荧光定量PCR后,计算基因mRNA表达量。

2 结果
2.1 两组手术情况比较 相较于对照组,观察组术中出血量更少,R0切除率更高(P<0.05);两组手术时间及保肛率无显著差异(P>0.05)。见表1。
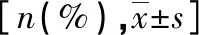
表1 两组手术情况比较
2.2 两组术后TNM分期及病理缓解情况比较 观察组术后TNM分期优于对照组(P<0.05);两组病理完全缓解(pCR)无显著差异(P>0.05)。见表2。
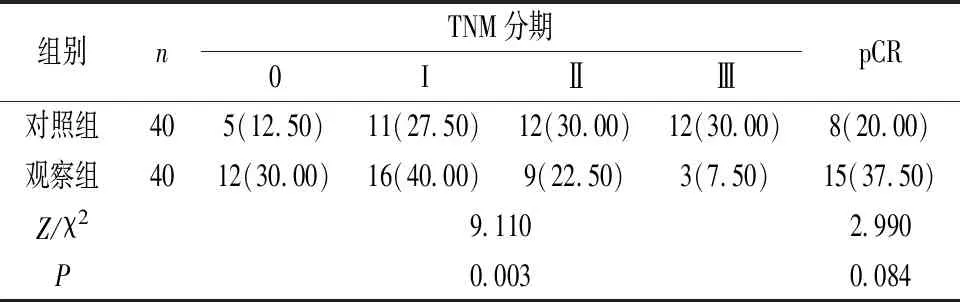
表2 两组术后TNM分期及病理缓解情况比较[n(%)]
2.3 两组病灶内抑癌基因表达水平比较 相较于对照组,观察组手术切除病灶中MTDUI、Runx3及p53表达水平更高(P<0.05)。见表3。

表3 两组病灶内抑癌基因表达水平比较
2.4 两组病灶内侵袭基因表达水平比较 相较于对照组,观察组手术切除病灶内MMP-9及Slug表达水平显著更低,TIMPI表达水平显著更高,差异有统计学意义(P<0.05)。见表4。

表4 两组病灶内侵袭基因表达水平比较
3 讨论
术前同期新辅助放化疗6~8周行TME手术是目前治疗LARC的标准方式。随着放疗技术的不断革新,3DCRT与VMAT均成熟应用于临床治疗。研究表明[4],相较于3DCRT,VMAT的剂量学优势明显,且其均匀性与适形性更佳,但关于两组放疗方式对病灶内增殖、侵袭相关性基因表达变化的对比研究较少。
肿瘤R0切除是肿瘤根治的理想状态,其表明肿瘤病灶周围5cm处无显微镜下残留。一般来说,R0切除反映患者综合治疗效果较好,患者5年存活率更高。本文结果显示,观察组术中出血量少于对照组,R0切除率高于对照组,术后临床分期优于对照组;而两组手术时间、保肛率及pCR无明显差异。由此表明,术前实施VMAT放疗技术可减少术中出血量,患者治疗效果更好。研究显示[5],术前放疗可致病灶组织黏膜、黏膜下层等纤维化形成瘢痕,造成术中剥离困难,增加术中出血量,且放疗会造成肠系膜微血管脆性增加,进一步增加术中出血量。而通过VMAT放疗会显著缩短放疗时间,对组织及微血管的影响更小,从而减少术中出血量。同时,VMAT放疗均匀性与适形指数更高,照射更精准,在相同剂量照射下,其在PTV剂量分布更佳,治疗效果更好。因此,相较于3DCRT,VMAT缩小瘤体的效果更明显,R0切除率更高,降低临床分期的效果更佳。相对来讲,瘤体缩小,R0切除率高,保肛率同样会升高,而本文中,两组保肛率并无显著差异,原因可能与本研究样本少有关,也可能与现行手术日趋成熟有关。相关研究表明[5],LARC患者经术前放化疗后,其总体pCR为15%~38%。本文结果亦与之相近(20.00%、37.50%),但两组pCR并无显著差异,原因可能是病例少有关,也可能是因为pCR达到与否与肿瘤本身的放射敏感性有关。
肿瘤病灶内抑癌基因表达缺失会造成细胞异常凋亡,同时会造成肿瘤细胞活力增强[6]。MTDUI、Runx3、p53是肿瘤细胞浸润生长过程中常见抑癌基因,其通过多种途径发挥抑癌活性、诱导细胞凋亡。本文结果发现,相较于对照组,观察组手术切除病灶内MTDUI、Runx3、p53表达更高。由此表明,术前VMAT放疗能明显促使多种抑癌基因表达上调,从而促进肿瘤细胞凋亡。肿瘤细胞浸润性生长会涉及细胞外基质水解及细胞上皮—间充质转化。
MMP-9是一种具有降解和重塑细胞外基质作用的催化酶,其表达水平升高有利于肿瘤细胞侵袭[7];TIMPI是阻止蛋白酶发生水解活性的抑制分子;Slug是一种调控上皮—间充质转化的转录因子,其与直肠腺癌的发生、发展及侵袭转移密切相关。本文结果显示,相较于对照组,观察组手术切除病灶内MMP-9与Slug表达水平更低,TIMPI表达水平更高。由此表明,术前VMAT放疗能明显促使病灶内侵袭基因下调,侵袭抑制基因上调,进而抑制肿瘤细胞浸润生长。
综上所述,相较于3DCRT,VMAT放疗技术在提高手术R0切除率的同时,能明显调节病灶内抑癌基因、侵袭基因表达水平,从而促进肿瘤细胞凋亡,抑制其侵袭。

