lncRNA RMST靶向miR-224-3p调控缺氧复氧诱导的心肌细胞损伤
李 悦,郝艳丽,吴 涛
心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤是一种常见的心血管疾病,其特征为心肌组织血液供应减少,血液供应恢复导致缺血组织的继发性损伤[1]。目前,I/R损伤是导致缺血性心脏病病人高死亡率的重要原因。I/R损伤机制复杂,其中细胞内过度的氧化应激反应与细胞凋亡相关,对心肌组织损伤细胞的结构和功能有直接影响[2]。因此,提高心肌细胞抗氧化反应能力、减轻细胞凋亡可能是预防I/R损伤的有效方法。长链非编码RNA(long non-coding RNAs,lncRNAs)是一类长度超过200个核苷酸的新型非编码RNA,其通过在表观遗传、转录和转录后水平调控基因表达,参与自噬、氧化应激损伤、凋亡等多种病理过程[3-5]。研究表明,神经元细胞HT-22糖氧剥夺损伤模型中lncRNA横纹肌肉瘤相关转录物-2(rhabdomyosarcoma 2-associated transcript,RMST)表达上调,抑制lncRNA RMST表达可提高HT-22细胞存活率,减轻糖氧剥夺诱导的细胞凋亡[6]。lncRNA RMST表达下调还可抑制小胶质细胞活化,降低炎症反应,减轻神经元细胞损伤[7]。序列分析发现,miR-224-3p含有lncRNA RMST结合位点,miR-224-3p可抑制糖氧剥夺诱导的原代神经元细胞氧化应激损伤和凋亡,对脑I/R损伤具有保护作用[8]。然而lncRNA RMST、miR-224-3p在心肌细胞I/R损伤中的作用机制尚不明确。因此,本研究建立缺氧复氧(H/R)细胞模型,探讨lncRNA RMST和miR-224-3p在心肌损伤中的作用,以期为防治心肌I/R损伤提供新的方向。
1 材料与方法
1.1 材料与试剂 人心肌细胞株(HCM)购于中国科学院上海细胞库;DMEM培养液、Lipofectamine 3000、TRizol试剂、miRNA逆转录试剂盒购于美国Invitrogen公司;胎牛血清购于杭州四季青公司;青链霉素双抗溶液、丙二醛(malonaldehyde,MDA)含量检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒和谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)活性检测试剂盒购于北京索莱宝生物科技公司;miR-224-3p模拟物(miR-224-3p mimics)、模拟物阴性对照(miR-NC)、miR-224-3p抑制物(anti-miR-224-3p)、抑制物阴性对照(anti-miR-NC)、RMST小干扰RNA(si-RMST)、阴性对照序列(si-NC)以及双荧光素酶报告载体均由上海吉玛制药公司提供;逆转录酶、2×SYBR Green master mix购于大连Takara生物公司;膜联蛋白-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)购于上海钰博生物公司;兔B细胞淋巴瘤-2(B cell lymphoma -2,Bcl-2)多克隆抗体、兔Bcl相关X蛋白(Bcl associated X protein,Bax)单克隆抗体、兔磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG购于上海碧云天生物公司。
1.2 方法
1.2.1 构建心肌细胞H/R模型 HCM细胞采用含10%胎牛血清、1%青链霉素双抗的DMEM培养液于37 ℃、含5%CO2的细胞培养箱中,当细胞融合度为80%时,0.25%的胰酶消化后进行传代培养。收集对数期心肌细胞用于后续实验。参照梁冰等[9]的方法构建H/R模型。缺氧处理前将细胞培养液中通入5%CO2、95%N2使其成为缺氧培养液。将细胞置于缺氧培养箱(含5%CO2、95%N2)中37 ℃培养3 h,然后更换为新鲜培养液,置于常规细胞培养箱(含5%CO2、95%空气)中37 ℃培养3 h。
1.2.2 细胞转染和实验分组 转染前1 d,取2×105个对数期HCM细胞接种于24孔板;转染当天,用50 μL无血清Opti-MEM培养基稀释待转染的序列片段,并轻轻混匀,室温静置5 min;用50 μL无血清Opti-MEM培养基稀释Lipofectamine 3000,室温静置5 min;将Lipofectamine 3000和待转染序列片段的稀释液混合,室温静置20 min。将上述混合液加到培养板各孔内,培养6~8 h后更换为新鲜培养液,转染48 h时收集细胞进行H/R处理。根据转染序列片段不同分为H/R+si-NC组、H/R+si-RMST组、H/R+miR-NC组、H/R+miR-224-3p mimics组、H/R+si-RMST+anti-miR-NC组、H/R+si-RMST+anti-miR-224-3p组。正常培养的HCM细胞作为对照组,H/R模型细胞作为H/R模型组。
1.2.3 实时荧光定量PCR(RT-qPCR)检测lncRNA RMST和miR-224-3p相对表达量 使用TRizol试剂从各组细胞中分离总RNA,利用逆转录酶、miRNA逆转录试剂盒合成cDNA。将cDNA稀释20倍作为扩增模板。配制20 μL反应体系,包括2×SYBR Green master mix 10 μL、cDNA模板2 μL、正向引物1 μL、反向引物1 μL,补加双蒸水至20 μL。扩增条件为95 ℃ 5 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共循环40次。RMST正向引物5′-AGCAATGCATTCTTTCACATGG-3′,反向引物5′-ATGCAATTTCGGTGGTTGGC-3′;GAPDH正向引物5′-AATGGGCAGCCGTTAGGAAA-3′,反向引物5′-GCGCCCAATACGACCAAATC-3′;miR-224-3p正向引物5′-AGTCTCTGGCTGAC TACATCACAG-3′,反向引物5′-CTACTCACAAAACAGGAGTGGAATC-3′;U6正向引物5′-CCCTGGCACCCAGCAC-3′,反向引物5′-GCCGATCCACACGGAGTAC-3′。
1.2.4 流式细胞术检测细胞凋亡 胰蛋白酶消化各组细胞,用磷酸盐缓冲液洗涤细胞2次后,用1×结合缓冲液重悬细胞获得细胞密度为1×106个/mL的细胞悬液。取100 μL细胞悬液,分别加入5 μL Annexin V-FITC,充分混匀,避光孵育15 min,再加入5 μL PI,室温避光孵育5 min,补加1×结合缓冲液390 μL。混匀后,立即上机检测细胞凋亡情况。
1.2.5 细胞计数试剂盒(CCK-8)法检测细胞活力 每组取5×106个HCM细胞接种于96孔板,培养48 h后向各孔内加入CCK-8溶液10 μL,室温反应2 h,酶标仪检测450 nm处各孔的光密度值(OD)。存活率=实验组OD/对照组OD。
1.2.6 MDA含量、SOD和GSH-Px活性及LDH释放量检测 HCM细胞处理完毕后,分别收集细胞培养液上清和细胞。LDH检测试剂盒分析培养液上清中LDH活性。取各组HCM细胞,采用细胞裂解液冰上裂解30 min,4 ℃离心机12 000 r/min离心15 min,收集上清液,按照试剂盒说明书检测MDA含量、SOD和GSH-Px活性,严格按照试剂盒说明书进行检测。
1.2.7 蛋白质印迹(Western Blot)检测Bcl-2和Bax蛋白相对表达量 RIPA裂解液提取各组细胞的总蛋白,随后进行蛋白定量。取适量蛋白样品与等体积上样缓冲液混合均匀100 ℃煮5 min至蛋白变性。冷却至室温后,取30 μg蛋白上样至各加样孔进行聚丙烯酰胺凝胶电泳。当溴酚蓝移至凝胶底部时终止电泳。利用湿法转膜装置进行转膜。5%脱脂牛奶4 ℃封闭过夜。用1∶1 000稀释的一抗溶液室温孵育2 h,TBST洗膜3次,每次10 min;用1∶1 000稀释的二抗溶液室温孵育1 h,TBST洗膜3次,每次10 min。用化学发光显色试剂进行显影,曝光后,图像处理软件进行灰度分析,结果以目的蛋白/内参GAPDH灰度值比值表示。
1.2.8 双荧光素酶报告基因实验 将含有miR-224-3p结合位点的lncRNA RMST野生型(WT)序列或突变型(MUT)序列克隆到荧光素酶报告质粒,获得双荧光素酶报告载体WT-RMST、MUT-RMST。参照1.2.2步骤将WT-RMST、MUT-RMST分别与miR-224-3p mimics、miR-NC共转染心肌细胞,48 h后收集细胞并测定相对荧光素酶活性。同时分别转染pcDNA、pcDNA-RMST、si-NC、si-RMST至心肌细胞,48 h后按照RT-qPCR步骤测定miR-224-3p相对表达量。

2 结 果
2.1 lncRNA RMST和miR-224-3p在H/R诱导的心肌细胞损伤中的表达 与对照组比较,H/R模型组心肌细胞中lncRNA RMST表达明显升高,miR-224-3p表达明显降低,差异均有统计学意义(P<0.05)。详见表1。

表1 lncRNA RMST和miR-224-3p在H/R诱导的心肌细胞损伤中的表达(±s)
2.2 抑制lncRNA RMST表达对H/R诱导的心肌细胞氧化应激和细胞存活的影响 与对照组比较,H/R模型组心肌细胞RMST表达、MDA含量、LDH释放量明显升高,SOD、GSH-Px活性、细胞存活率明显降低,差异均有统计学意义(P<0.05);与H/R+si-NC组比较,H/R+si-RMST组心肌细胞RMST表达、MDA含量、LDH释放量明显降低,SOD、GSH-Px活性、细胞存活率明显升高,差异均有统计学意义(P<0.05)。详见表2。

表2 抑制lncRNA RMST表达对H/R诱导的心肌细胞氧化应激和细胞存活的影响(±s)
2.3 抑制lncRNA RMST表达对H/R诱导的心肌细胞凋亡的影响 与对照组比较,H/R模型组心肌细胞凋亡率、Bax蛋白表达明显升高,Bcl-2蛋白表达明显降低,差异均有统计学意义(P<0.05);与H/R+si-NC组比较,H/R+si-RMST组心肌细胞凋亡率、Bax蛋白表达明显降低,Bcl-2蛋白表达明显升高,差异均有统计学意义(P<0.05)。详见表3、图1、图2。

表3 抑制lncRNA RMST表达对H/R诱导的心肌细胞凋亡的影响(±s)

图1 凋亡相关蛋白表达条带图
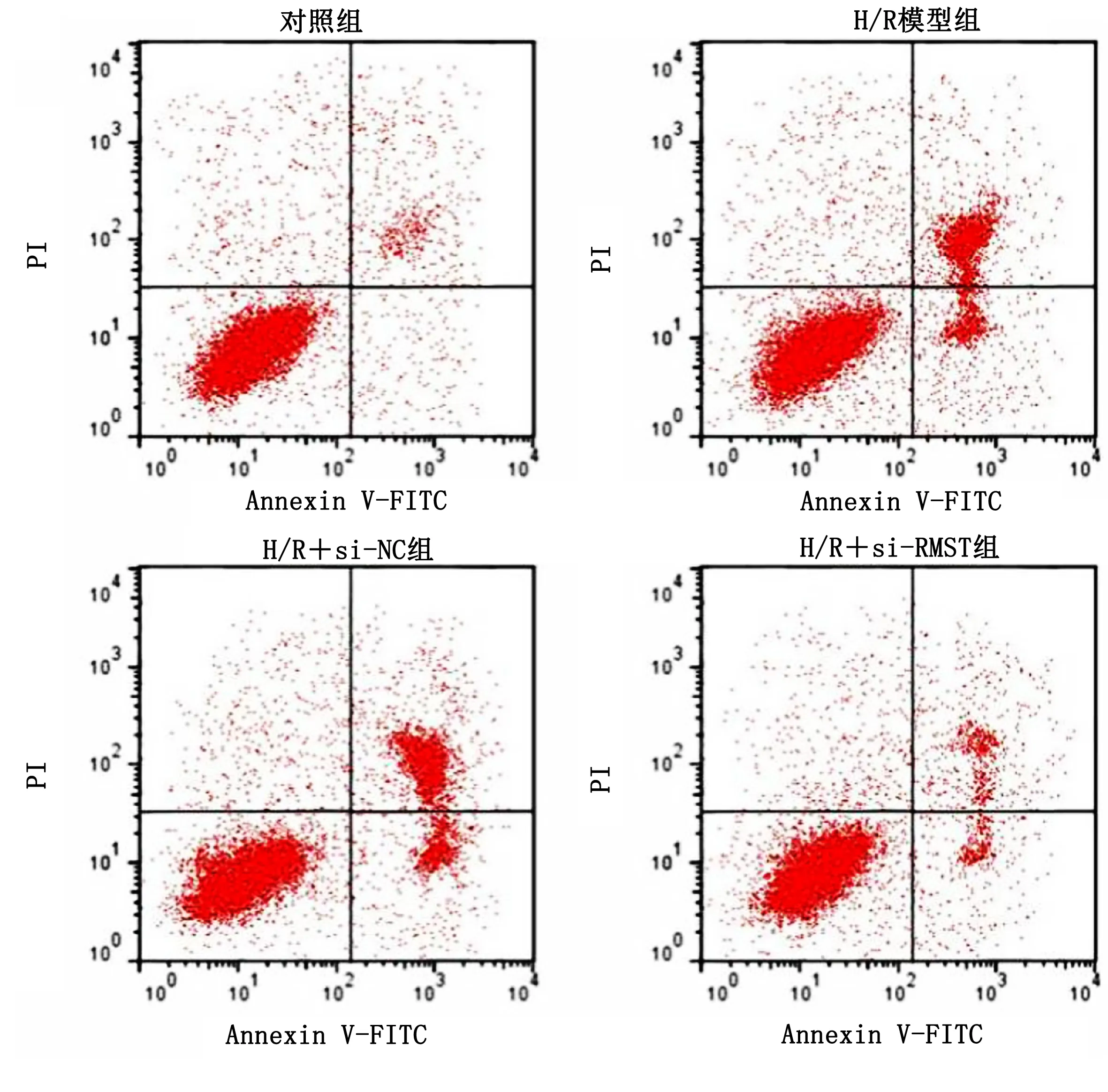
图2 细胞凋亡流式图
2.4 lncRNA RMST靶向调控miR-224-3p的表达 LncBase Predicted v.2数据库在线分析显示,lncRNA RMST含有与miR-224-3p互补的核苷酸序列(见图3)。双荧光素酶报告实验显示,miR-224-3p mimics和WT-RMST共转染组心肌细胞的相对荧光素酶活性较miR-NC和WT-RMST共转染组明显降低,差异均有统计学意义(P<0.05);而miR-224-3p mimics和MUT-RMST共转染组心肌细胞的相对荧光素酶活性与miR-NC和MUT-RMST共转染组比较无明显变化。RT-qPCR检测显示,pcDNA-RMST组心肌细胞miR-224-3p表达较pcDNA组明显降低,差异有统计学意义(P<0.05);si-RMST组心肌细胞miR-224-3p表达较si-NC组明显升高,差异均有统计学意义(P<0.05)。详见表4、表5。

表4 双荧光素酶报告实验结果(±s)

表5 lncRNA RMST调控miR-224-3p的表达(±s)
2.5 miR-224-3p过表达对H/R诱导的心肌细胞损伤的影响 与H/R+miR-NC组比较,H/R+miR-224-3p组miR-224-3p的表达水平明显升高,细胞凋亡率、Bax蛋白表达、MDA含量、LDH释放量明显降低,Bcl-2蛋白表达、SOD和GSH-Px活性、细胞存活率明显升高,差异均有统计学意义(P<0.05)。详见表6、图4、图5。

表6 miR-224-3p过表达对H/R诱导的心肌细胞损伤的影响(±s)

图4 凋亡相关蛋白表达条带图

图5 细胞凋亡流式图
2.6 干扰miR-224-3p表达逆转了抑制lncRNA RMST表达对H/R诱导的心肌细胞损伤的作用 与H/R+si-RMST+anti-miR-NC组比较,H/R+si-RMST+anti-miR-224-3p组心肌细胞miR-224-3p表达水平明显降低,细胞凋亡率、Bax蛋白表达、MDA含量、LDH释放量明显升高,Bcl-2蛋白表达、SOD和GSH-Px活性、细胞存活率明显降低,差异均有统计学意义(P<0.05)。详见表7、图6、图7。

表7 干扰miR-224-3p表达逆转了抑制lncRNA RMST表达对H/R诱导的心肌细胞损伤的作用(±s)

图6 凋亡相关蛋白表达条带图

图7 细胞凋亡流式图
3 讨 论
心肌细胞I/R损伤可导致充血性心力衰竭、恶性心律失常,严重威胁人类生命健康[10]。因此,积极探索与心肌细胞I/R损伤有关的基因,分析其潜在作用和可能机制,对治疗心肌I/R损伤有重要意义。lncRNA RMST在糖氧剥夺诱导神经元细胞损伤、大脑中动脉闭塞诱导的脑损伤以及缺血性脑卒中病人血浆中表达明显升高,抑制lncRNA RMST表达对神经元损伤、缺血性脑损伤具有保护作用,脑内注射RMST干扰载体还可减少小脑梗死面积和改善神经功能[11-12]。lncRNA RMST高表达促进氧葡萄糖剥夺诱导的脑微血管内皮细胞损伤,抑制lncRNA RMST可能是保护脑微血管内皮细胞免受缺氧缺血损伤的相关机制[13-14]。本研究显示,H/R诱导后HCM细胞中lncRNA RMST表达明显升高、细胞凋亡率明显升高、存活率下降。Bcl-2/Bax比值是参与细胞凋亡调控的重要因素,Bax表达增加、Bcl-2表达降低可促进线粒体膜通透性孔开放,并随后释放细胞色素C、凋亡诱导因子、Caspases激活因子,促进细胞凋亡的发生[15]。与功能分析结果一致,抑制lncRNA RMST表达可减轻H/R诱导对HCM细胞Bax蛋白表达的促进和Bcl-2蛋白表达的抑制作用。进一步研究发现,H/R诱导后HCM细胞上清液中MDA含量明显升高,SOD和GSH-Px活性降低。活性氧自由基攻击体内脂肪酸导致脂质过氧化产物MDA积累,而MDA含量是氧化损伤程度的重要标志[16]。SOD和GSH-Px是体内清除自由基的首要物质,其可对抗和阻断活性氧自由基对细胞的损害,及时修复受损细胞[17]。抑制lncRNA RMST表达后,SOD和GSH-Px活力升高,MDA含量降低,LDH释放量降低,说明抑制lncRNA RMST表达可提高HCM细胞抗氧化能力,减轻H/R诱导的HCM细胞氧化应激损伤和凋亡。
多项研究证实,lncRNA通过发挥miRNA分子海绵作用,进而参与心肌细胞凋亡和氧化应激损伤[18-19]。例如,lncRNA核富含丰富的转录本1(nuclear-enriched abundant transcript 1,NEAT1)通过抑制miR-520a表达调节凋亡相关蛋白Bcl-2和Bax表达,改变Caspase-3活化水平进而保护心肌细胞免于H/R诱导的凋亡[20]。丹参酮ⅡA能够减轻H/R处理后心肌细胞的凋亡、氧化应激和线粒体膜电位改变,其机制与下调lncRNA AK003290/miR-124-5p分子轴有关[21]。本研究通过双荧光素酶报告基因实验证实lncRNA RMST对miR-224-3p具有靶向负调控作用。miR-224-3p位于染色体Xq28,研究显示过表达miR-224-3p可降低骨肉瘤细胞活力和侵袭能力,具有抗肿瘤作用[22]。过表达miR-224-3p还可降低高糖诱导的大鼠肾小管上皮细胞炎性反应[23]。本研究结果显示,H/R诱导可降低HCM细胞中miR-224-3p表达水平,过表达miR-224-3p可提高HCM细胞存活和抗氧化应激能力,减轻H/R诱导的凋亡和氧化应激损伤。此外,本研究证实,miR-224-3p是lncRNA RMST的直接靶点,且lncRNA RMST对miR-224-3p具有负调控作用。由于抑制lncRNA RMST表达与过表达miR-224-3p的抗凋亡、抗氧化应激损伤作用类似,本研究推测HCM细胞中存在lncRNA RMST/miR-224-3p通路。进一步研究发现,抑制miR-224-3p表达可部分逆转抑制lncRNA RMST对H/R处理的HCM细胞凋亡、氧化应激损伤的影响,这进一步说明抑制lncRNA RMST通过靶向miR-224-3p对H/R诱导的心肌细胞损伤具有保护作用。
综上所述,H/R诱导后心肌细胞中lncRNA RMST表达升高、miR-224-3p表达降低。抑制lncRNA RMST通过靶向上调miR-224-3p能够减轻H/R诱导的心肌细胞凋亡和氧化应激损伤,为心肌I/R损伤治疗提供了新的方向。

