给予舌下神经核5-羟色胺对SD大鼠睡眠呼吸暂停的影响
王 伟,王广发,闫春良,薛旗山,杨国辉,胡系伟
睡眠呼吸暂停综合征(sleep apnea syndrome,SAS)是一组临床常见疾病,主要表现为睡眠呼吸机能障碍,患病率高、危害严重[1]。临床上将睡眠呼吸暂停分为阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)与中枢型睡眠呼吸暂停(central sleep apnea,CSA),同时也常见两种呼吸暂停混合存在的混合性睡眠呼吸暂停(mixed sleep apnea,MSA),其中临床上以OSA为主的阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)最为多见[2]。全球30~69岁的人群中,近10亿人患有OSAHS,而中至重度OSAHS者估计接近4.25亿人[3]。我国成年人的OSAHS患病人数接近1.8亿,需要治疗的中至重度OSAHS为6000万~7000万人[4]。目前,OSAHS的发病机制尚未完全清楚。OSAHS的病理机制可能有多因素参与,除了气道解剖结构外,上气道扩张肌活动、通气稳定性的神经调控以及中枢呼吸调控机制可能也参与其中,并发挥着重要的作用[5]。5-羟色胺(serotonin,5-HT)是一种重要的单胺类神经递质,研究发现5-HT与睡眠呼吸暂停关系密切,5-HT及其受体在呼吸中枢的调控和OSAHS的发病机制中可能发挥着至关重要的作用[6]。本团队前期在麻醉并切断大鼠双侧颈部迷走神经条件下通过微透析的方法提高大鼠舌下神经核5-HT及5-HT2受体激动剂水平,监测大鼠颏舌肌肌电活动,发现提高Sprague-Dawley(SD)大鼠舌下神经核整体5-HT及5-HT2受体激动剂水平可以提高SD大鼠颏舌肌肌电活动,从而证明提高SD大鼠舌下神经核整体5-HT及5-HT2浓度可以增加SD大鼠舌下神经核的兴奋性[7-8]。但以上研究均是在麻醉并切断大鼠双侧颈部迷走神经的条件下完成的,并不能反映自然基础状态下5-HT对舌下神经核的调节作用,为了进一步研究自然状态下5-HT对舌下神经核的调节作用,本研究选取自然状态下SD大鼠通过微透析方法给予舌下神经核5-HT,观察5-HT对大鼠睡眠呼吸暂停的影响。
1 材料与方法
1.1 实验动物 由于SD大鼠是天然的中枢性呼吸暂停动物模型,本实验选取健康雄性SD大鼠8只,体质量280~350 g,由北京联合利华实验动物中心提供。SD大鼠均可自由活动、进食、饮水;饲养温度(22±2)℃,湿度40%;并予明暗周期(08:00~20:00开灯;20:00次日08:00熄灯)适应。饲养7 d后开始实验。
1.2 微透析导管、脑电及肌电电极安放方法 SD大鼠通过腹腔注射氯胺酮及戊巴比妥钠进行麻醉,给予大鼠腹腔注射地塞米松及阿托品以减少大鼠脑水肿及气道分泌物。观察大鼠角膜反射消失,将大鼠头部固定在脑立体定位仪上,并对其颅顶部皮肤剃毛消毒。从大鼠双眼连线水平向后剪开颅顶皮肤并暴露颈肌,清洁颅骨表面,清晰显现颅顶及十字缝。以十字缝为坐标轴原点,确定四针脑电电极于坐标系的对称位置,即分别位于(0.15,0.25)mm、(-0.15,0.25)mm、(-0.15,-0.25)mm、(0.15,-0.25)mm,用微型电钻钻透颅骨,将脑电极插入钻孔内,切勿损伤硬脑膜,将电极板固定在颅骨表面,并将连接在肌电电极的导线引入颈部肌肉中,打结固定并缝合颈部皮肤。按《大鼠脑立体定位仪图谱》定位舌下神经核坐标:前囟后(14.0±0.5)mm,俯侧(9.5±0.1)mm,中线旁(0.3±0.02)mm,用微型电钻钻透颅骨,切勿损伤硬脑,将微透析导管缓慢置入大鼠舌下神经核内并固定。术后将大鼠分笼单独饲养,饲养条件同术前,1周后,观察大鼠无异常后进行睡眠呼吸监测。
1.3 药物配制 5-HT浓度为10~50 mmol/ L对舌下神经核团的影响最为明显[9]。因此,本实验将5-HT溶解于新鲜人工脑脊液(ACSF)中,配制成浓度为10 mmol/ L的溶液备用。
1.4 睡眠呼吸监测 睡眠监测时间为360 min(11:00~17:00),此时间段为大鼠的生理睡眠时间。监测前1 d相同时间将大鼠置于相同环境中预适应,以保证大鼠于监测当天能顺利入睡,监测时将上述电极与多导生理仪相连。监测第1天未给药,对大鼠进行睡眠呼吸监测;第2天,通过微量泵及微透析导管将新鲜ACSF以0.4 μL/min的速度匀速泵入舌下神经核,共144 μL,同时进行睡眠呼吸监测;第3天以同样的方法将新鲜配制的5-HT溶液通过微量泵及微透析导管泵入舌下神经核,同时对大鼠进行睡眠呼吸监测。
1.5 肌电监测 应用生物机能实验系统,每隔10 s为一屏进行分析,根据脑电及肌电波形,采用单盲法人工确定睡眠分期,分别为清醒期、非快速眼动(non-rapid eye movement,NREM)睡眠期及快速眼动(apideye-movemen,REM)睡眠期。同时采用单盲法人工进行叹息后呼吸暂停(post-sigh apnea,PS)及自发性呼吸暂停(spontaneous apnea,SP)的判断,计算机记录睡眠和呼吸的分析结果。分析完毕后,软件自动计算各期睡眠时间及发生呼吸暂停的次数,并计算叹息后呼吸暂停指数(post-sigh apnea index,PSAI)、自发性呼吸暂停指数(spontaneous apnea index,SPAI)。
1.6 微透析导管植入确认 实验结束后大鼠再次通过腹腔注射氯胺酮及戊巴比妥钠进行麻醉,通过微量泵及微透析导管向大鼠舌下神经核缓慢注入中性红(2 μL/min)15 min进行染色。将所有大鼠脑组织进行冰冻切片,通过显微镜判断微透析导管是否植入舌下神经核。结果显示,8只SD大鼠舌下神经核微透析导管均植入准确无误,检测正常(见图1、图2)。
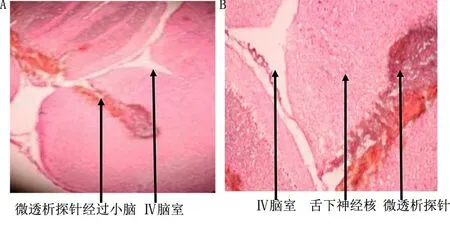
图1 大鼠脑组织切片(A为4倍镜下图;B为8倍镜下图;红色部分为中性红通过微透析导管注入舌下神经核团染色所致)

图2 《大鼠脑立体定位图谱》[10]中舌下神经核与第四脑室位置(4V为第四脑室;Ⅻth为舌下神经核)

2 结 果
2.1 不同处理因素对各期睡眠时间的影响
2.1.1 对NREM期睡眠时间的影响 给予ACSF时NREM期睡眠时间与未给药时比较,差异无统计学意义(P>0.05)。给予5-HT时NREM期睡眠时间与未给药时、给予ACSF时比较,差异均无统计学意义(P>0.05)。详见表1。

表1 不同处理因素对各期睡眠时间的影响比较(±s) 单位:min
2.1.2 对REM期睡眠时间的影响 给ACSF时REM期睡眠时间与未给药时比较,差异无统计学意义(P>0.05)。给5-HT时NREM期睡眠时间与未给药时、给ACSF时比较,差异均无统计学意义(P>0.05)。详见表1。
2.2 不同因素对睡眠呼吸暂停的影响
2.2.1 对NREM期睡眠呼吸暂停的影响 给ACSF时,NREM期PSAI、SPAI与未给药时比较,差异无统计学意义(P>0.05)。给5-HT时,NREM期PSAI、SPAI与未给药时、给ACSF时比较,差异均有统计学意义(P<0.05)。详见表2。

表2 不同处理因素对睡眠呼吸暂停的影响比较(±s) 单位:次/h
2.2.2 对REM期睡眠呼吸暂停的影响 给ACSF时,REM期PSAI、SPAI与未给药时比较,差异无统计学意义(P>0.05)。给5-HT时,REM期PSAI、SPAI与未给药时、给ACSF时比较,差异均有统计学意义(P<0.05)。详见表2。
3 讨 论
睡眠呼吸暂停综合征是一类患病率高、危害严重并可涉及各年龄段人群的疾病[11]。其中,以OSAHS在临床上最为多见[12]。OSAHS病人在睡眠时存在上气道完全或部分阻塞,在临床上可表现为反复睡眠时打鼾、呼吸表浅、呼吸暂停,甚至憋醒、晨起头痛、白天嗜睡、疲劳、低通气、低氧血症和高碳酸血症等,具有潜在的危害,是引起心脑血管疾病尤其是高血压的重要原因之一,甚至引起死亡[13]。OSAHS是涉及多个系统的复杂疾病,其发病机制尚不完全清楚。在临床工作中发现OSAHS病人在接受气管切开治疗后常出现CSA[14-15]。因此,OSAHS的发病机制除了与气道解剖结构的异常有关外,可能还涉及中枢机制[16]。研究显示,5-HT与睡眠呼吸暂停关系密切,5-HT及其受体对舌下神经核兴奋性及呼吸中枢具有重要的调节作用[17]。但是由于血脑屏障的存在,5-HT在外周和中枢的作用截然不同[18]。脑内的5-HT能神经纤维在呼吸中枢及呼吸运动神经元均有分布,通过作用于呼吸中枢及呼吸运动神经元的5-HT受体,在呼吸的调控中发挥重要作用[19]。OSAHS病人NREM期5-HT兴奋性较清醒期降低,并在REM期进一步降低,同时伴随着舌下神经发放冲动的减少,因而导致颏舌肌、颏舌骨肌、腭帆张肌等睡眠依赖的上气道肌肉张力下降,造成了OSAHS病人气道的狭窄和塌陷均发生在睡眠状态,并且在REM期更为严重,可能是OSAHS的发病机制之一[20]。
研究发现,OSAHS动物模型给予5-HT后,舌下神经核兴奋性增加,颏舌肌活动明显增加,上气道不易塌陷,但上述研究都是在麻醉切断迷走神经或者去大脑条件下进行的,相比较处于清醒或自然睡眠状态的动物,麻醉去大脑或者切断迷走神经的动物中缝核活性是增加的,有更多的5-HT传递至舌下神经核[21]。因此,本实验旨在研究自然睡眠状态下SD大鼠,通过微透析方法向舌下神经核缓慢持续给予5-HT,观察5-HT对SD大鼠睡眠呼吸暂停的作用。
本研究以SD大鼠为模型进行相关研究,样本量较少,结论存在局限性。本研究结果显示,通过微透析的方法提高舌下神经核整体5-HT浓度可改善SD大鼠NREM期及REM期的睡眠呼吸暂停。提高舌下神经核整体5-HT浓度对SD大鼠NREM期及REM期睡眠时间无影响,表明舌下神经核与5-HT及其受体在呼吸的调控中具有重要作用。同时本研究结果也存在一定的不足,首先脑内的微透析结果只能反映固定时间范围内舌下神经核对大鼠睡眠呼吸暂停的影响,并不能完全反映大鼠睡眠呼吸暂停情况,同时脑部植入微透析导管及脑电电极的安置均会对脑组织产生一定的损伤;其次,5-HT通过其受体发挥作用,不同受体功能不一,机制复杂[22-23]。本研究采用的5-HT浓度为10 mmol/L,由于5-HT参与睡眠调节作用表现与受体类型和剂量浓度大小有关,因此对于5-HT及其受体不同浓度对大鼠中枢舌下神经核兴奋性及睡眠呼吸暂停产生的影响仍需进一步探讨。因此,为进一步阐明睡眠呼吸暂停的发病机制、寻找更具针对性的治疗,还需对5-HT各受体亚型功能进行更深入的研究。同时,本研究以SD大鼠为研究对象,虽然大鼠是CSA的动物模型,但该动物的脑电活动及呼吸暂停与人类较相似,可作为睡眠呼吸暂停研究的天然动物模型,但研究结果并不能完全反映人类睡眠呼吸暂停的情况。因此,5-HT及舌下神经核对人类睡眠呼吸暂停的影响仍需要进一步深入研究。

