苦参碱通过调控miR-122对肝癌HepG2细胞迁移和侵袭的影响及机制
蓝水清,黄桂柳,黄赞松,管爱星
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院消化内科,广西 百色 533000;3. 广西肝胆疾病临床医学研究中心,广西 百色 533000)
肝细胞癌(hepatocellular carcinoma,HCC)素有“癌中之王”的称号,病程短、治疗困难、手术率低[1],是我国主要的常见恶性肿瘤。由于疾病早期缺乏特定症状,大多数HCC患者直到晚期才被诊断[2-3]。尽管手术是肝癌治疗的最佳选择之一,但晚期肝癌患者通常不适合手术,全身治疗仍然是姑息治疗的唯一选择[4],因此,寻找有效的治疗药物和方法对降低病死率及延长寿命至关重要。苦参碱(苦参碱C15H24N2O)是从苦参根中分离得到的重要四环喹啉类生物碱之一[5]。研究显示苦参碱有抑制肝癌细胞增殖、促进其凋亡、抑制肝癌血管内皮细胞增殖和恶性细胞的侵袭转移的作用[6]。有研究证实HCC的增殖、迁移和侵袭与miRA-122的表达呈负相关[7],而苦参碱可上调肝癌 HepG2细胞的MicroRNA-122表达,促进肿瘤细胞凋亡[8],因此推测苦参碱是通过上调miR-122调控肝癌的侵袭转移。但miR-122在HCC中的生物学作用及靶基因仍未完全明确。本研究选用人肝癌细胞HepG2细胞为研究对象,以期探讨苦参碱通过作用于miR-122调控肝癌侵袭转移的作用及分子机制,为苦参碱用于HCC的治疗提供实验依据。
1 材料与方法
1.1材料 人肝癌HepG2细胞由右江民族医学院附属医院邓益斌博士惠赠,苦参碱购自上海阿拉丁生化科技股份有限公司(规格:M109803-1g),胎牛血清(批号:FBSST-01033-500),DMEN高糖培养基(批号:D6429-500ML)、CCK-8(批号:CK04-500T)、TRIzOL(批号:15596-026)、生工miRNA第一链 cDNA合成(茎环法)均购自广西卓一生物技术有限公司;PTG GAPDH Rabbit Polyclonal Antibody(批号:10494-1-AP)、E-cadherin Rabbit Polyclonal Antibody(批号:20874-1-AP) 、N-Cadherin Rabbit Polyclonal Antibody(批号:22018-1-AP) 、Vimentin Rabbit Polyclonal Antibody(批号:10366-1-AP)均购自广西卓一生物技术有限公司。
1.2方法
1.2.1细胞培养 HepG2细胞用含10%胎牛血清、100 μg/mL青链霉素的DMEM培养基,置于37 ℃、5% CO2培养箱中培养,待细胞密度达到80%进行传代培养,每2~3 d传代1次,取处于对数生长期的细胞用于实验。
1.2.2CCK-8法检测不同浓度苦参碱对HepG2细胞的抑制作用 取对数生长期的细胞,胰酶消化后重悬成细胞悬液,以细胞密度为5×104个/毫升,接种于96孔板中,每孔100 μL细胞悬液。分为实验组、阴性对照组、空白对照组,实验组含不同浓度的苦参碱,阴性对照组含完培的细胞悬液,空白组只含完全培养基,不含细胞及药物,每组设4个复孔。放入培养箱中培养24 h后,弃旧培养基,实验组分别加入不同浓度的苦参碱100 mL,浓度为0.5 mg/mL、1 mg/mL、2 mg/mL、4 mg/mL、8 mg/mL;向阴性对照组及空白对照组加入等量完全培养基。培养箱中继续培养48 h后,每孔分别加入10 μL CCK-8溶液,继续孵育3 h,在全自动酶标仪450 nm波长处测定(OD)值,计算苦参碱对HepG2细胞作用48 h后的抑制率(IR)。选择半数抑制率(IC50)的药物浓度作为后续实验干预条件。
1.2.3实时定量PCR(real-time qRT-PCR)检测miR-122的表达 取对数生长期的细胞消化重悬后以细胞密度为5×104个/孔,接种于24孔板中,培养24 h后,弃旧培养基,用PBS清洗两遍,每孔加入0.5 mL悬浮稀释的慢病毒(hsa-miR122-5P),同时以对照阴性慢病毒转染目的细胞建立对照组细胞株(LV3-NC),细胞常规于37 ℃、5%CO2培养箱培养。转染后12 h观察细胞生长状态,如无明显毒性作用,约48 h后更换成完全培养基。72 h后可用胰酶消化重悬加入嘌呤霉素(1 mg/L)筛选去除转染差的细胞,qPCR检测各组转染后细胞中miR-122表达变化情况,细胞荧光高表达及生长稳定后可继续培养进行后续细胞实验。
实验分为4组,miR-122 mimic+苦参组、苦参组、miR-122 mimic组、阴性对照组,苦参组加入含IC50浓度(经计算为1.0 mg/mL)为苦参碱的完全培养基,其余两组加入完全培养基,孵育箱培养48 h后,加入Trizol,提取各组细胞总RNA,待RNA浓度和纯度测定后,反转成cDNA。以cDNA为模板,U6为内参进行实时荧光定量PCR。Hsa-minR-122-5P引物序列:上游引物5′-GCGTGGAGTGTGACAATGG-3′,下游引物5′-GTGCAGGGTCCGAGGT-3′,按照预变性95 ℃,5 min,变性95 ℃,10 s,退火 60 ℃,30 s,40个循引环的程序进行,使用2-△△Ct法分析结果。
1.2.4细胞划痕实验 将转染的细胞及未转染的细胞进行消化,并制成单细胞悬液,每孔取5×105个/孔细胞置于6孔板中,当细胞密度达到80%~90%时,用200 μL无菌枪头垂直于孔板在细胞表面划痕,用PBS清洗两遍,实验分为4组,miR-122 mimic+苦参组、苦参组、miR-122 mimic组、阴性对照组,有苦参的组加入含IC50浓度(经计算为1.0 mg/mL)苦参碱的无血清DMEM培养基,其余两组加入无血清DMEM培养基,分别于0 h、48 h在划痕的同一位置进行观察和拍照,最后用ImageJ软件计算细胞划痕愈合率。计算公式:划痕愈合率(%)=(0 h的划痕面积-48 h的划痕面积)/0 h的划痕面积×100%。
1.2.5细胞侵袭实验 从-20 ℃的冰箱中取出matrigel在冰上溶解,用DMEM培养基进行稀释(质量浓度为1 mg/mL) ,于每孔100 μL matrigel添加到上室中凝成胶状。实验分为4组,miR-122 mimic+苦参组、苦参组、miR-122 mimic组、阴性对照组,调整细胞密度为5×104/mL的细胞悬液200 μL加到Transwell小室,下室分别加入含苦参碱及不含苦参碱的完全培养基,48 h后用PBS洗涤小室2次,用多聚甲醛固定15 min,再用结晶紫染色15 min。在显微镜下进行观察和拍照,最后使用ImageJ对细胞进行计数。
1.2.6Western Blot 提取干预后各组细胞中总蛋白,用BCA试剂盒对蛋白裂解产物进行定量,SDS-PAGE 凝胶电泳分离蛋白裂解物,将蛋白转移到PVDF膜上,快速封闭液封闭30 min。TBST洗涤3次,每次10 min,PVDF 膜与一抗在4 ℃孵育过夜,TBST洗涤3次,每次10 min,用二抗在室温下孵育1 h,然后再洗涤3次,每次10 min,最后蛋白显影及对蛋白条带灰度值定量分析。
1.2.7统计学方法 应用Graphpad 9.0软件进行统计学分析,多组间比较采用单因素分差分析,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1苦参碱对HepG2细胞增殖的影响 不同浓度苦参碱作用于HepG2细胞48 h后,苦参碱各浓度组对HepG2细胞增殖均有不同程度抑制作用,各浓度组细胞活力与阴性对照组相比差异有统计学意义(P<0.001),见表1。GraphPad Prims 9.0软件计算IC50,IC50值为(1.026± 0.138) mg/mL,故选择苦参碱浓度为1.0 mg/mL作为后续实验的干预条件。

表1 不同浓度苦参碱对HepG2细胞增殖的影响
2.2miR-122的表达水平及苦参碱对miR-122表达的影响 实时荧光定量PCR结果显示,miR-122 mimic+苦参组、苦参组、miR-122 mimic组的相对表达量增高,与阴性对照组相比差异有统计学意义(P<0.001),见图1、表2。
2.3苦参碱对HepG2迁移和侵袭的影响 划痕实验反应细胞的水平迁移能力,miR-122 mimic+苦参组、苦参组、miR-122 mimic组的划痕愈合率均小于阴性对照组(P均<0.001)。Transwell实验反映细胞的垂直侵袭能力,miR-122 mimic+苦参组、苦参组、miR-122 mimic组的穿膜细胞数均少于阴性对照组,其差异有统计学意义(P<0.001),见图2、表3。
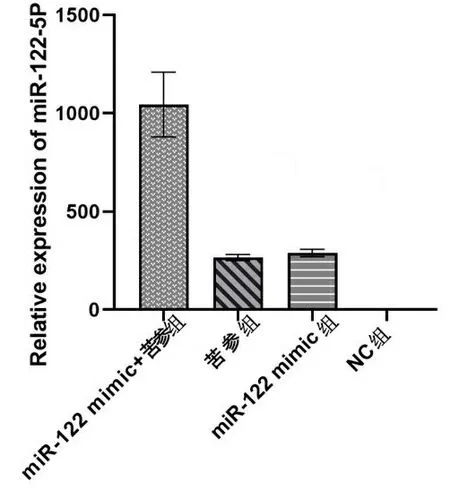
图1 苦参碱对miR-122表达的影响
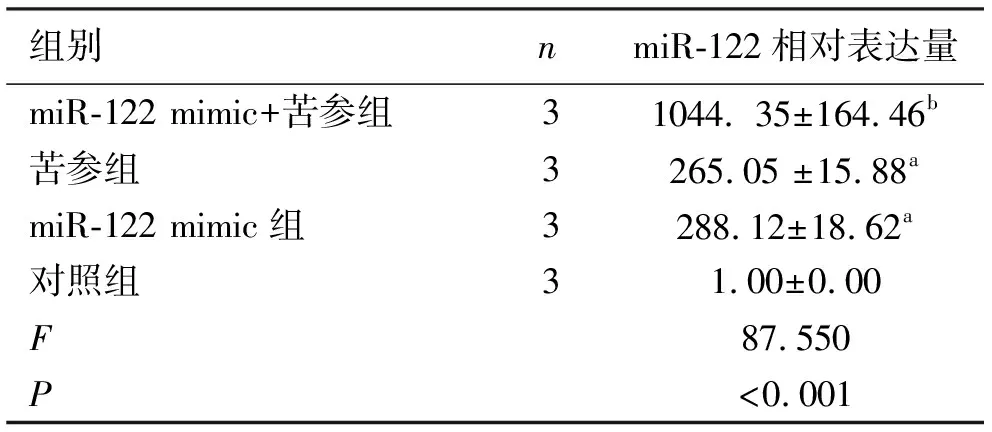
表2 各组miR-122相对表达量
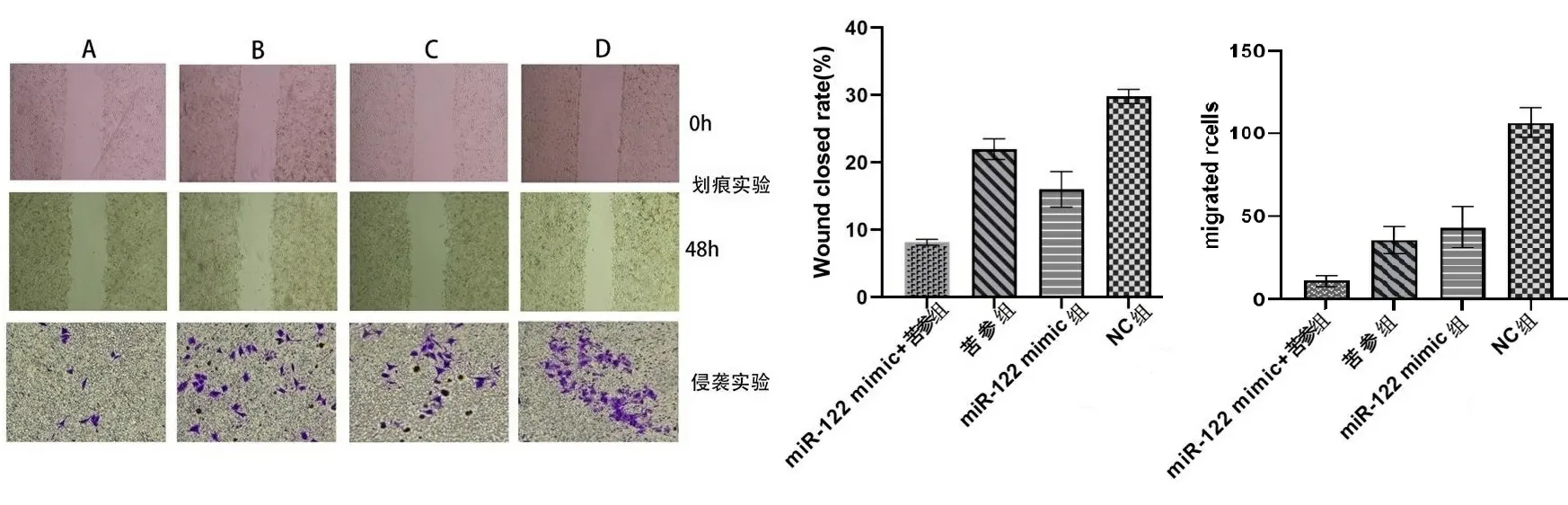
注:A.miR-122 mimic+苦参组,B.苦参组,C.miR-122 mimic组,D.阴性对照组。

表3 各组划痕愈合率及Transwell穿膜细胞数
2.4Western Blot法 检测E-cadherin、N-cadherin、Vimentin蛋白表达情况,经苦参碱过表达miR-122干预后上皮细胞标志性蛋白E-cadherin表达高于阴性对照组(P<0.001),而N-cadherin表达低于阴性对照组(P<0.001),Vimentin表达低于阴性对照组(P<0.001),见表4。
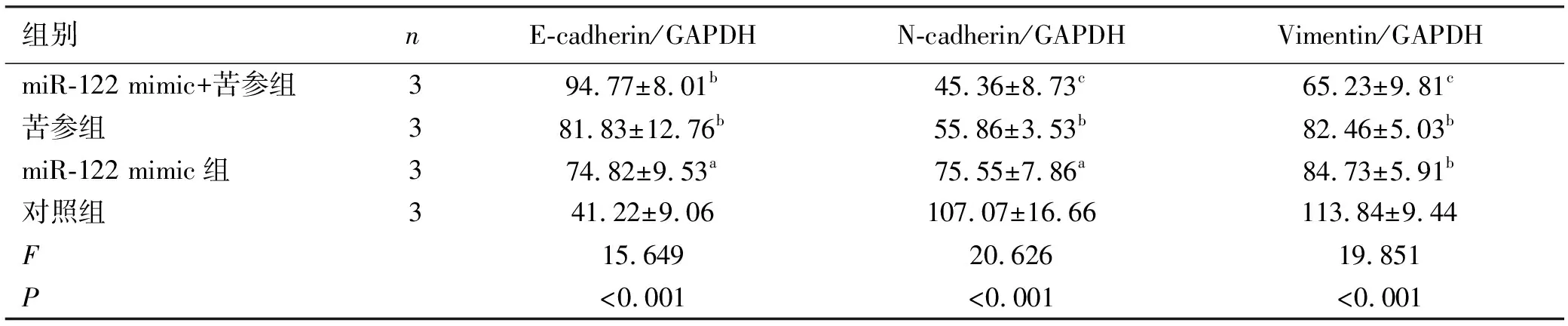
表4 苦参碱作用HepG2细胞后E-cadherin、N-cadherin、Vimentin蛋白水平变化
3 讨论
本研究发现,分别将浓度为0.5 mg/mL、1 mg/mL、2 mg/mL、4 mg/mL、8 mg/mL的苦参碱作用于HepG2细胞48 h后,各浓度组对HepG2 细胞增殖均有不同程度抑制作用,根据计算出的IC50,选择1 mg/mL浓度作为后续实验研究条件。划痕试验及侵袭试验提示苦参碱能抑制肝癌细胞的迁移及侵袭能力,进一步研究发现苦参碱可以上调肝癌HepG2细胞中的miR-122表达,提高E-cadherin蛋白表达水平、下调N-cadherin、 Vimentin蛋白表达水平。
苦参碱是从经典中药苦参根中分离得到的一种主要生物碱成分[9-10],长期以来一直用于抗炎、抗病毒、抗肿瘤、免疫调节等方面的治疗[11]。其中抗肿瘤作用具有良好的前景,目前研究发现其抗肿瘤作用与抑制细胞侵袭及迁移等相关。杨静波等[12]发现苦参碱及氧化苦参碱均可抑制肝癌SMMC-7721细胞的增殖及迁移,促进细胞凋亡。张贝贝等[13]研究发现氧化苦参碱可抑制乳腺癌MCF-7细胞增殖、侵袭及迁移,其作用机制与抑制Wnt/β-catenin 通路激活、逆转上皮-间充质转化(epithelial-mesenchymal transition,EMT)机制有关。张彩灵等[14]发现,苦参素能抑制肝癌的增殖及迁移,其机制是通过上调HepG2细胞miR-204的表达来抑制TGF-β1进而抑制EMT的发生。黎梨[15]研究发现苦参素通过影响ZEB1及EC表达来削弱EMT作用,进而抑制 P-gp的表达来逆转HCC中化疗耐药性。戴美琴[16]发现苦参碱能抑制肝癌Bel-7402和SMMC-7721细胞迁移、侵袭,其机制是通过诱导miR-199a-5p表达,抑制HIF-1α的功能,进而产生抗EMT的作用。EMT与肿瘤起始、侵袭、转移和治疗耐药性有关[17],它有助于肿瘤进展,并被认为是多种类型肿瘤扩散的驱动因素[18]。EMT的特点是上皮指标N-cadherin、Vimentin的水平升高和E-cadherin 的水平降低[19],故检测N-cadherin、Vimentin及E-cadherin表达程度可反映EMT水平。本实验研究显示,苦参碱作用后,肝癌细胞侵袭迁移能力减弱,E-cadherin蛋白表达上调,N-cadherin及Vimentin蛋白表达下调,提示苦参碱可能通过抑制EMT而抑制肝癌侵袭及迁移水平。
为进一步研究苦参碱抑制肝癌侵袭迁移的机制,本实验通过转染miR-122上调其表达后检测细胞侵袭迁移能力及相关因子的表达。结果显示苦参碱能上调miR-122的表达,苦参碱组、miR-122 mimic组和miR-122 mimic+苦参组均能抑制肝癌HepG2细胞侵袭和转移,且miR-122 mimic+苦参组抑制作用最明显。张轩等[20]发现氧化苦参碱能提高肝细胞中miR-122 表达,对乙型肝炎病毒的复制有明显的抑制作用。向发良[21]发现苦参素能上调MicroRNA-122表达和下调MicroRNA-21,进而抑制人肝癌HepG2细胞增殖,促进其凋亡。孙秀光等[22]研究发现上调肝癌HepG2细胞miR-122的表达后能下调N-myc下游调节基因3(NDRG3)的表达进而抑制肝细胞癌的细胞增殖、侵袭及迁移。王静等[23]研究发现转染miR-122 mimic上调miR-122后,肝癌MHCC-97H细胞迁移能力受到抑制,而转染miR-122 inhibitor抑制miR-122表达后,细胞迁移能力则增强,进一步研究发现miR-122可调控EMT,表明miR-122可通过调控肝癌细胞EMT抑制肝癌的侵袭与迁移。以上研究提示苦参碱可能作用于miR-122,而miR-122表达增加后可抑制侵袭转移,本研究发现苦参碱作用后miR-122表达增加,提示苦参碱能上调miR-122的表达,通过转染miR-122使其过表达后,苦参碱对肝癌侵袭及迁移的抑制作用更加显著,提示苦参碱可上调mi-122的表达进而抑制肝癌侵袭迁移。而苦参碱组、miR-122 mimic组及联合组均能上调E-cadherin蛋白表达、下调N-cadherin、Vimentin蛋白表达,且联合组作用最明显,提示苦参碱抑制肝癌细胞侵袭及迁移能力可能是通过上调miR-122表达进而影响EMT水平实现的。
综上所述,苦参碱能抑制肝癌HepG2细胞增殖、迁移及侵袭,其机制可能与上调miR-122表达,从而抑制EMT发生有关。

