微生物菌剂对连作地块草莓生长、土壤养分及微生物群落的影响
杨肖芳 郭 瑞 姚燕来 朱为静 洪磊东 洪春来 朱凤香 王卫平
(1浙江省农业科学院园艺研究所,浙江 杭州 310021;2浙江省农业科学院环境资源与土壤肥料研究所,浙江 杭州 310021;3湘湖实验室,浙江 杭州 311231)
草莓(Fragaria×ananassaDuch.)为蔷薇科草莓属多年生草本植物,因果实色泽艳丽、口感鲜美,且富含维生素、矿质元素、胡萝卜素、鞣酸、类黄酮和花青素等多种营养物质而深受消费者喜爱,拥有较大市场需求量[1]。据联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)最新统计,2018年世界草莓总产量达到833.71万吨,我国草莓年生产量占世界草莓总产量的35.6%,是世界草莓生产量最大的国家[2]。设施农业的兴起实现了草莓的周年生产,但重茬导致的连作障碍问题严重制约了草莓的生产和发展[3]。草莓连作障碍形成的原因主要包括土壤理化性质劣变[4-6]、土壤微生物群落变化[7-8]以及化感物质自毒作用[9-11]等。而土壤微生物群落结构的失衡是造成草莓连作障碍的主要原因[12]。研究发现,随着草莓连作年限的增长,土壤中的细菌、放线菌种类及数量呈现逐年减少的趋势,而土壤中真菌的种类及数量明显增加[13]。许多真菌,如灰霉病菌(Botrytis cinerea)[14]、草莓黄斑球藻菌(Sphaerotheca macularisf.sp.fragariae)[15]、炭疽病菌(Colletotrichum acutatum)[16]、草莓尖孢镰刀菌(Fusarium oxysporumf.sp.fragariae)[17]等是引起草莓病害的罪魁祸首。随着人们对生态平衡和可持续发展的重视,生物防治成为解决连作障碍的热点,其中微生物菌剂的研发与应用在生物防治中发挥重要作用[18]。
微生物菌剂的施用不仅能够抑制病原菌的生长,改善土壤微生物群落结构[19],还具有增加土壤有效养分含量[20]、提高草莓品质[21]等作用。常用的微生物菌剂菌株资源有芽孢杆菌、假单胞菌、放线菌、固氮菌和乳酸菌等,其中芽孢杆菌微生物菌剂应用广泛[22-28]。研究表明,某些枯草芽孢杆菌具有抑制草莓根腐病菌、尖孢镰刀菌和灰霉病菌的功能[29-30]。刘紫英等[31]筛选出的L501 枯草芽孢杆菌能够降解草莓连作自毒障碍物质苯甲酸,且对根腐病具有拮抗作用,能够用于修复草莓重茬。柳晓磊等[32]研究发现,含有枯草芽孢杆菌和地衣芽孢杆菌的混合微生物菌剂能够显著提升土壤中有效磷、速效钾和碱解氮的含量。Hong 等[33]发现,芽孢杆菌(Bacillus velezensisCE100)能够抑制草莓真菌病害并提高产量。周艳孔等[21]发现,向土壤施用植物乳杆菌和解脂耶罗威亚微酵母菌等混合微生物菌剂,不仅能够显著促进草莓植株生长和提高产量,而且可以增加果实中可溶性固形物和维生素C的含量。本研究采用大田试验探究施用不同微生物菌剂对草莓生长和产量的影响,并对草莓土壤中的养分含量和微生物群落进行分析,探索微生物菌剂促生、抗病的作用机制,旨在为草莓产业的可持续发展提供生防材料和理论支撑。
1 材料与方法
1.1 试验材料与方案
试验于2020年9月—2021年4月在浙江省农业科学院海宁市杨渡科研创新基地大棚(120.4114°E,30.4406°N)进行,试验地连续种植草莓10年,土壤基本理化性质为有机质25.87 g·kg-1,全氮1.55 g·kg-1,碱解氮146.49 mg·kg-1,有效磷118.82 mg·kg-1,速效钾123.35 mg·kg-1,pH值6.58,电导率(electrical-conductivity,EC)0.69 µs·cm-1。供试草莓品种为浙江省农业科学院园艺研究所培育的越心,定植时间为9月6日,收获开始时间为11月20日,结束时间为次年4月20日;供试微生物菌剂由浙江省农业科学院环境资源与土壤肥料研究所研制,K1 号抗病菌剂为单一微生物菌剂,其主要成分是解淀粉芽孢杆菌WSW1(对尖孢镰刀菌、茄病镰刀菌等多种病原菌有显著拮抗作用),有效活菌数量为1.01×109CFU·mL-1;NKY1 号抗病促生菌剂为复合微生物菌剂,由解淀粉芽孢杆菌WSW1和阿耶波多氏芽孢杆菌JHIJ2-2(具有解磷、解钾、产吲哚乙酸和产嗜铁素等功能)组成,有效活菌数量为2.1×109CFU·mL-1;供试复合肥购于杭州好多收农资店,N-P2O5-K2O 组成为17-17-17。
试验采用塑料大棚双层保温促成设施栽培方式,在同一大棚内设置1 个对照和2 个微生物菌剂处理。所有处理按照常规施用肥料即底肥每亩撒施兔粪1 000 kg、菜籽饼300 kg和复合肥15 kg后灌水闷棚,闷棚结束后定植草莓苗,后期均追施4 次膨果肥(15-5-30),每次2 kg,共8 kg。CK 处理不施用菌剂;T1 处理施用单一微生物菌剂(K1号抗病菌剂),T2处理施用复合微生物菌剂(NKY1 号菌剂),T1 和T2 处理所使用的菌剂均为成品菌剂,定植时分别用T1 和T2菌剂100倍液蘸根,然后每隔30 d浇灌T1和T2菌剂150倍液,每次每株100 mL;对照用清水蘸根,清水浇灌。每个处理试验小区面积为20 m2,每小区草莓种植数为200株,株行距为22 cm×45 cm,重复3次,随机排列。
1.2 测定指标及方法
1.2.1 草莓生长指标和产量的测定 在试验期间(11月20日—4月20日)定期对每个处理的成熟草莓采摘并进行健康草莓单株产量和小区草莓总产量的测定;在草莓计产结束后统计草莓植株的存活率并采集植株样品,每个小区随机选择20 株统计其茎长、根长和根重。
1.2.2 土壤理化性质的测定 草莓收获结束后(4月20日),采用五点取样法对每个小区0~20 cm 的土壤进行采集。依据《土壤农化分析》[34]的方法进行土壤理化性质的测定,其中土壤有机质(organic matter,OM)含量采用氧化还原法经高温消煮后进行滴定,全氮(total nitrogen,TN)含量采用半微量凯氏定氮法用酸标准溶液滴定,碱解氮(available nitrogen,AN)含量采用碱解扩散法用酸标准溶液滴定,有效磷(available phosphorus,AP)含量采用NaHCO3浸提后用TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司)检测,速效钾(available potassium,AK)含量用CH3COONH4浸提后用BWB-1 火焰分光光度计(BWB Technologies,英国)检测,pH 和EC 值分别用PB-10 pH计(德国Sartorius 公司)和DDSJ-308F 电导率仪(上海仪分科学仪器有限公司)进行测定(水土比为2.5∶1)。
1.2.3 土壤微生物多样性的测定 对草莓收获结束后采集的土壤样品进行微生物多样性测定。高通量测序分析由上海美吉生物医药科技有限公司完成。主要试验流程:取0.25 g 充分混匀的土壤样品,采用Powersoil®DNA 提取试剂盒(MOBIO Laboratories Inc.,美国)提取土壤微生物总的基因组DNA,用琼脂糖凝胶电泳检测纯度和浓度,并稀释至1 ng·µL-1。分别采用带标记的细菌通用引物515F(5'-GTGCCAGCMGCC GCGG-3')-806R(5'-GGACTACHVGGGTWTCTAAT-3')和真菌通用引物ITS1F(5'-CTTGGTCATTTAGAGGAA GTAA-3')-ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')特异性引物扩增土壤细菌16S rRNA 基因区域和土壤真菌ITS 基因区域。之后按照美吉公司提供的标准方法,在Illumina MiSeq 平台(美国Illumina 公司)上将原始数据进行质量过滤和合并后,在97%的相似水平下进行聚类、获得分类操作单元(operational taxonomic unit,OTU)。对OTU 序列进行物种注释,并分别在各个分类水平统计各样本的群落组成。使用QIIME 1.9.1 计算ACE 指数、Chao1 指数、香农指数(Shannon)和辛普森指数(Simpson)。
1.3 数据处理与分析
采用Microsoft Excel 2016 软件处理试验数据;运用GraphPad Prism 9 软件的单因素方差分析(ANOVA)和Tukey 检验功能进行差异显著性检验,并用GraphPad Prism 9 软件制作图表;运用Canoco5 软件进行相关性冗余分析。
2 结果与分析
2.1 微生物菌剂对草莓生长和产量的影响
由图1-A 可知,与CK 相比,施用微生物菌剂处理(T1、T2)均能促进草莓植株的生长。T1 和T2 的植株茎长分别较CK 显著增加41.73%和34.41%(图1-B),植株根长显著增加10.99%和16.45%(图1-C);T1 的植株根重较CK 增加17.67%,但未达到显著水平,T2的植株根重分别较CK 和T1 显著增加72.52% 和46.61%(图1-D)。
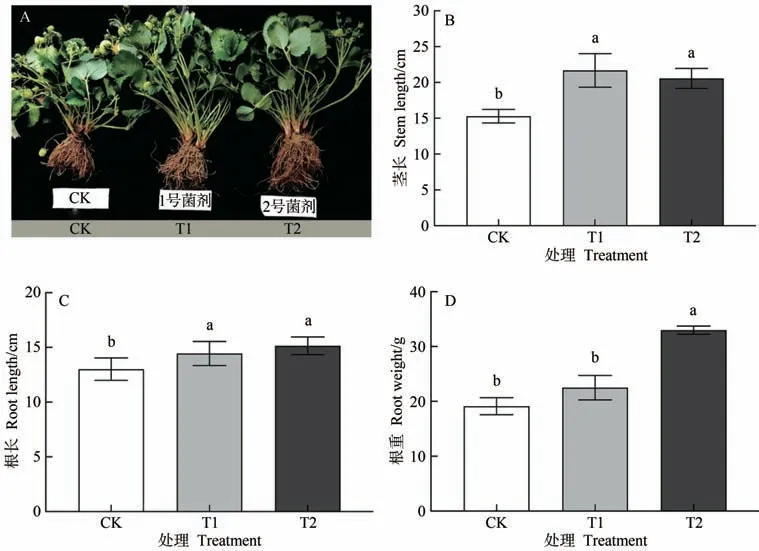
图1 不同处理下草莓茎长、根长和根重的变化Fig.1 Changes in strawberry stem length,root length and root weight under different treatments
由图2 可知,CK 植株存活率为64.26%,T1、T2 植株存活率显著高于CK,分别达到了82.25% 和89.45%。对于健康的草莓植株,CK、T1、T2 单株草莓平均产量分别为554.68、573.98、603.94 g,且各处理间无显著差异,表明T1、T2 并不会提高健康草莓植株的单株平均产量。与CK 相比,T1 和T2 草莓总产量分别显著提高30.16%和41.79%。草莓总产量与植株存活率之间存在线性相关关系,表明不同处理间草莓总产量的增加主要得益于植株存活率的提高。
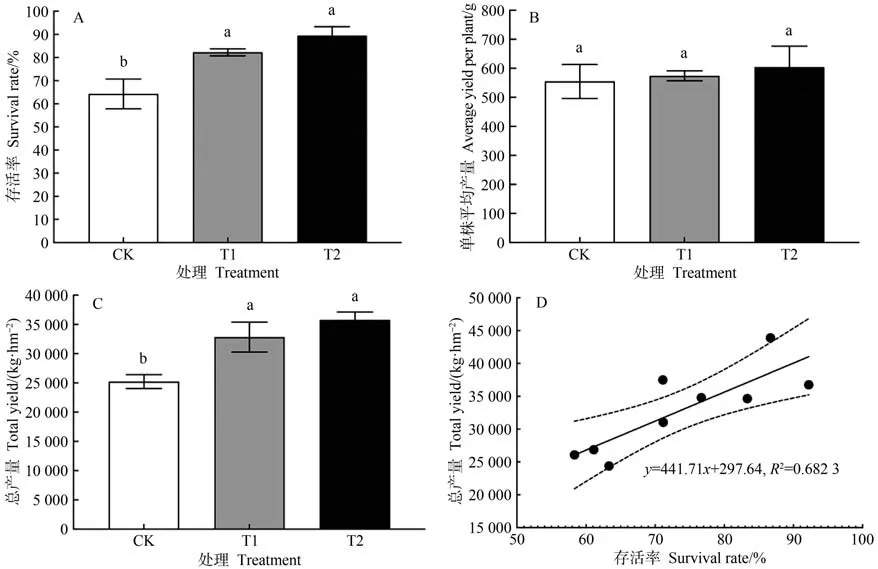
图2 不同处理下草莓存活率和产量的变化Fig.2 Changes in strawberry survival rate and yield under different treatments
2.2 微生物菌剂对草莓土壤理化性质的影响
由表1 可知,CK 和T1 土壤pH 值无显著差异,T2土壤pH 值显著低于CK 和T1,分别降低3.51%和4.10%。与CK 相比,T1、T2 均不同程度地显著增加了土壤EC 值,分别增加8.19%和22.93%。三组处理的EC 值均在500 µs·cm-1以上,呈轻度盐渍化趋势[35]。T1、T2 土壤有机质和全氮含量较CK 无显著差异。与CK 相比,T1、T2 的土壤碱解氮含量分别显著降低11.49%和6.28%。CK 和T1 土壤有效磷之间无显著差异,T2 土壤有效磷含量分别较CK 和T1 显著增加18.31%和20.01%;T1 和T2 土壤速效钾含量分别较CK 增加16.27%和55.27%,其中T2 显著高于CK 和T1;这可能是微生物菌剂中的微生物具有解磷和解钾作用导致的。
2.3 微生物菌剂对草莓土壤微生物群落结构的影响
2.3.1 不同处理下土壤微生物OTU 水平群落组成分析 如图3所示,土壤细菌测序结果中,三组处理共有OTU 数为2 960 个,占总细菌总OTU 数量的99.62%。土壤真菌测序结果中,三组处理共有的OTU 数为264 个,占真菌总OTU 数量的39.46%,CK、T1、T2 处理特有OTU 数分别占真菌总OTU 数量的5.98%、22.87%、7.03%。上述结果表明,三组处理土壤细菌组成较为相似,而真菌组成差异较大。

图3 土壤细菌(A)和真菌(B)在OTU水平上的群落组成韦恩图Fig.3 Venn diagram of community composition of soil bacteria(A)and fungi(B)at the OTU level
2.3.2 不同处理下土壤微生物门水平群落组成分析 在门水平上分别对不同处理土壤中细菌和真菌丰度排名前十的物种进行差异性分析。由图4 可知,细菌群落中所有处理的优势菌门均为厚壁菌门(Firmicutes),占26.06%~27.97%,其次为变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)。与CK相比,T1、T2 中类芽孢杆菌门(Gemmatimonadota)的相对丰度分别降低0.62 和1.01 个百分点,其中T2 处理达到显著水平(P<0.05);T1、T2 拟杆菌门(Bacteroidota)的相对丰度分别增加了0.67 和0.49 个百分点,其中T1达到显著水平(P<0.05)。真菌群落中所有处理的优势菌门均为子囊菌门(Ascomycota),占64.4%~71.08%。施用微生物菌剂均提高了土壤中罗泽菌门(Rozellomycota)和毛霉菌门(Mucoromycota)的相对丰度。与CK 相比,罗泽菌门和毛霉菌门在T2 中的相对丰度分别显著增加3.51(P<0.05)和0.49 个百分点(P<0.001);T1、T2 中担子菌门(Basidiomycota)的相对丰度分别减少6.64和5.19个百分点,但未达到显著水平。从门水平上看,微生物菌剂的施用对细菌群落影响较小,而对真菌群落影响较大。
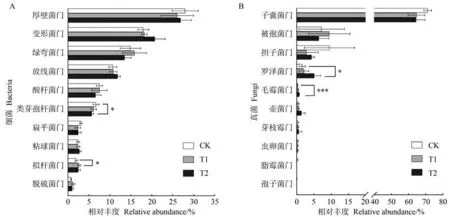
图4 土壤细菌(A)和真菌(B)在门水平上的群落组成差异图Fig.4 Diagram of differences in community composition of soil bacteria(A)and fungi(B)at the phylum level
2.3.3 不同处理下土壤微生物属水平群落组成分析 在属水平上分别对不同处理土壤中细菌和真菌丰度较高的十个物种进行差异性分析。由图5 可知,细菌群落中所有处理的优势菌属均为芽孢杆菌属(Bacillus),占10.08%~10.98%。与CK 相比,T1、T2 中鞘氨醇单胞菌属(Sphingomonas)的相对丰度分别降低0.27 和0.19 个百分点,其中T1 达到显著水平(P<0.05)。真菌群落中所有处理的优势菌属均为曲霉属(Aspergillus),占40.12%~54.74%。与CK 相比,T1、T2 中曲霉属的相对丰度分别降低8.78 和14.62 个百分点,青霉属(Penicillium)的相对丰度分别降低1.65和1.79 个百分点,均在T2 达到显著水平(P<0.01);T1、T2 中根霉属(Rhizopus)的相对丰度分别增加了0.16 和0.49 个百分点(P<0.001),假霉样真菌属(Pseudallescheria)的相对丰度分别增加0.31和1.98个百分点(P<0.05),均在T2达到显著水平。从属水平上同样看出,微生物菌剂的施用对细菌群落影响较小,而对真菌群落影响较大,其中T2对真菌群落组成的影响大于T1。
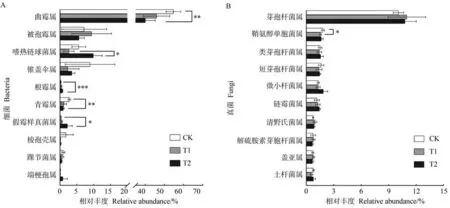
图5 土壤细菌(A)和真菌(B)在属水平上的群落组成差异图Fig.5 Diagram of differences in community composition of soil bacteria(A)and fungi(B)at the genus level
2.4 微生物菌剂对草莓土壤微生物群落多样性的影响
2.4.1 不同处理对土壤细菌群落多样性的影响 由表2 可知,从细菌群落丰富度指数角度分析,与CK 相比,T1、T2 的土壤细菌群落ACE 指数分别降低1.03%和0.43%,Chao1 指数分别降低1.07%和0.56%。从细菌群落多样性指数角度分析,CK、T1、T2土壤细菌群落的Shannon 指数分别为6.77、6.74、6.79,Simpson 指数分别为0.003 3、0.003 5、0.003 2,各处理间无显著差异。综上,微生物菌剂的施用对土壤细菌群落的丰富度和多样性影响较小。
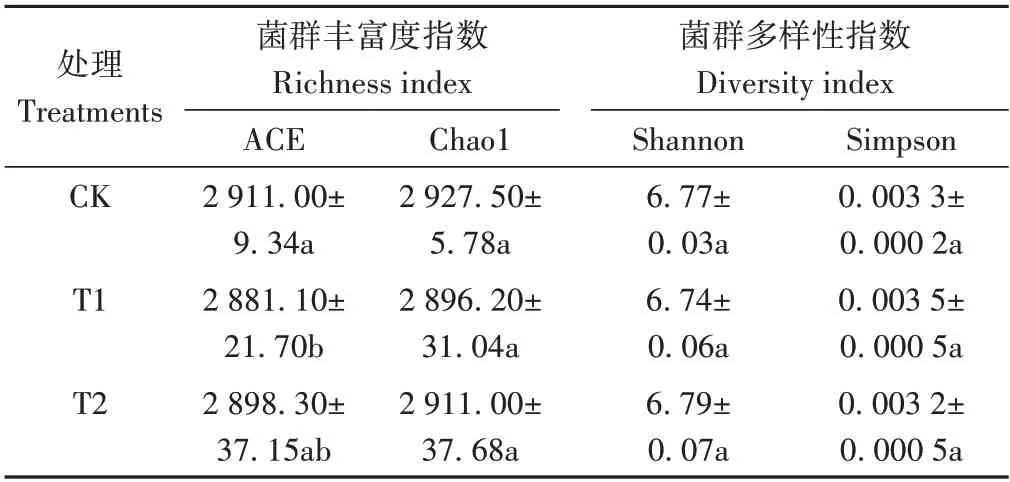
表2 不同处理下土壤细菌群落的Alpha多样性指数变化Table 2 Changes of Alpha diversity index of bacterial community under different treatments
2.4.2 不同处理对土壤真菌群落多样性的影响 如表3所示,从真菌群落丰富度指数角度分析,与CK 相比,T1、T2 的土壤真菌群落ACE 指数分别显著增加36.95%和22.16%;Chao1 指数分别显著增加36.76%和19.61%。从真菌群落多样性指数角度分析,T1 和T2 的土壤真菌群落Shannon 指数分别较CK 显著增加了22.52%和34.23%;Simpson 指数分别降低25.81%和54.84%。表明微生物菌剂的施用明显提高了土壤中真菌群落的丰富度和多样性。
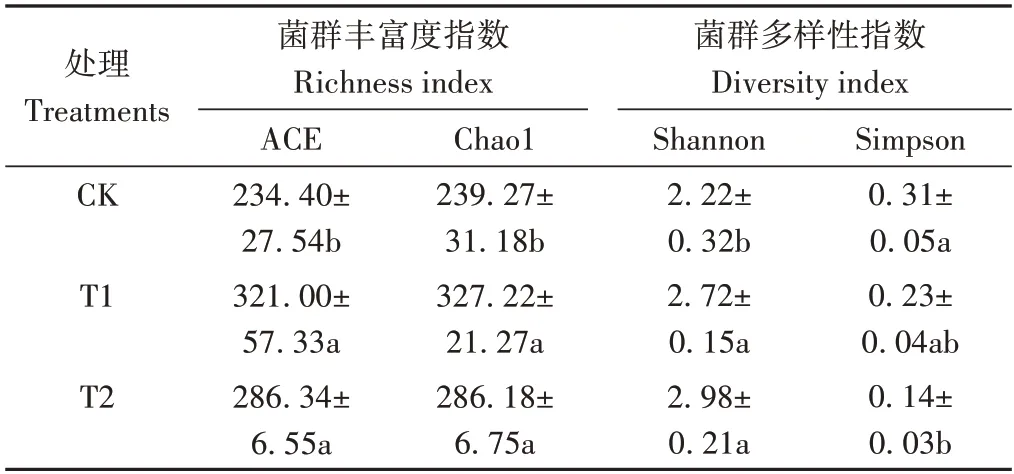
表3 不同处理下土壤真菌群落的Alpha多样性指数变化Table 3 Changes of Alpha diversity index of fungal community under different treatments
2.5 不同处理下草莓土壤微生物群落结构与土壤理化性质的相关性分析
将细菌和真菌群落中丰度排名前十的属与土壤环境因子pH值、电导率(EC)、碱解氮(AN)、有效磷(AP)、速效钾(AK)进行冗余分析。由图6可知,CK、T1、T2分布在不同的区域,表明不同处理对土壤理化性质和微生物群落结构具有较大的影响。T2与AP、AK、EC处于同一方向,与pH 值为相反方向,表明T2能够提高土壤速效养分含量,但会造成土壤EC值增加和pH值降低。
图6-A为细菌群落-土壤环境因子冗余分析图,其轴1 特征值为33.65%,轴2 特征值为20.20%,两轴共同解释了53.85%的信息。其中AN是影响细菌群落结构的主要土壤因子,鞘氨醇单胞菌属(Sphingomonas)相对丰度与AN 呈正相关,盖亚属(Gaiella)、清野氏菌属(Planifilum)、芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paenibacillus)、短芽孢杆菌属(Brevibacillus)相对丰度与AN 呈负相关。AP、AK、EC 对细菌群落结构影响较大,微小杆菌属(Microvirga)、链霉菌属(Streptomyces)、土杆菌属(Tumebacillus)相对丰度与AP、AK、EC呈正相关,解硫胺素芽胞杆菌属(Aneurinibacillus)与AP、AK、EC呈负相关。
图6-B为真菌群落-土壤环境因子冗余分析图,其轴1特征值为44.78%,轴2特征值为19.92%,两轴共同解释了64.70%的信息。其中AK、EC 是影响真菌群落结构的主要土壤因子,假霉样真菌属(Pseudallescheria)、端梗孢属(Acrophialophora)、嗜热链球菌属(Mycothermus)相对丰度与AK、EC 呈正相关,被孢霉属(Mortierella)、梭孢壳属(Thielavia)、曲霉属(Aspergillus)、青霉属(Penicillium)、踝节菌属(Talaromyces)、锥盖伞属(Conocybe)相对丰度与AK、EC呈负相关。其次对真菌群落结构影响较大的土壤因子为AN,根霉属(Rhizopus)相对丰度与AN呈负相关关系。大量致病真菌相对丰度与CK 呈正相关关系,而与T1、T2呈负相关关系,表明微生物菌剂施用能够有效改善土壤真菌群落结构。
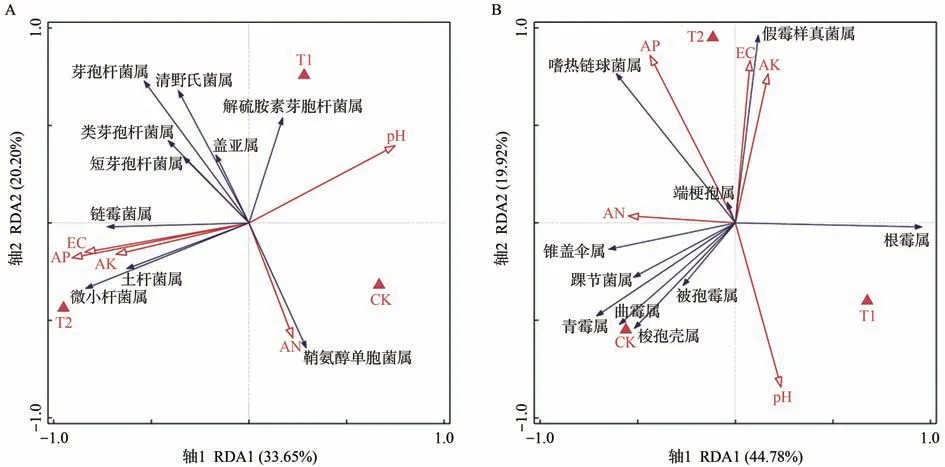
图6 土壤细菌群落-土壤环境因子(A)和真菌群落-土壤环境因子(B)冗余分析Fig.6 Redundancy analysis of soil bacterial community - soil environmental factors(A)and fungal community - soil environmental factors(B)
3 讨论
3.1 微生物菌剂对草莓生长和产量的影响
多年连作使得草莓长势变弱、抗病能力变差,虽然采用农药防治在一定程度上减少了病害发生,但植株恢复能力差,死苗率高,造成草莓减产问题突出[36]。连作造成的地下部土壤微生物组成和养分失衡和草莓病害是导致草莓死亡进而造成减产的重要原因。近年来,单一或复合微生物菌剂对不同作物生长、产量以及土壤性状影响的研究取得了较大进展[37-39]。如果菌种之间存在协同作用,两种或者多种抗病菌和促生菌混合制成的复合微生物菌剂将对土壤连作障碍的防治和植株生长具有更好的效果[39]。本研究发现,单独施用抗病菌解淀粉芽孢杆菌WSW1(T1)能够显著促进草莓植株的生长,提高草莓的存活率和产量,表明抗病菌解淀粉芽孢杆菌WSW1 在田间也具有良好的抑菌作用;复合施用抗病菌解淀粉芽孢杆菌WSW1 和促生菌阿耶波多氏芽孢杆菌JHIJ2-2(T2)能够进一步提高草莓的存活率和产量,表明促生菌阿耶波多氏芽孢杆菌JHIJ2-2能够为草莓提供更多的养分以促进草莓生长,提高草莓抗病性。综上,抗病菌解淀粉芽孢杆菌WSW1 和促生菌阿耶波多氏芽孢杆菌JHIJ2-2 之间可能存在协同作用,复合施用更有利于土壤连作障碍的防治和草莓的增产。
3.2 微生物菌剂对土壤养分的影响
微生物菌剂的施用会影响土壤养分循环过程,进而影响植物对养分的吸收和生长[40]。本研究中,复合微生物菌剂的施用能够显著增加土壤有效磷和速效钾含量,这可能是由于微生物菌剂中所使用的芽孢杆菌具有解磷和解钾的功能。目前已有大量具有解磷、解钾功能的芽孢杆菌从土壤中被筛选出来,且证实将其添加到土壤中能够显著提高土壤有效磷和速效钾含量[41-42]。本研究发现,与对照相比,施用微生物菌剂的土壤碱解氮含量显著降低,这可能是由于微生物菌剂的施用促进了植株的快速生长,植株吸收了大量碱解氮从而导致土壤碱解氮含量降低[43]。
3.3 微生物菌剂对土壤微生物群落的影响
土壤微生物是土壤生态系统的重要组成部分,能够促进土壤有机质的分解和养分的吸收、转化[44]。土壤微生物群落结构的失衡是导致草莓连作障碍的主要原因[45]。本试验表明,微生物菌剂处理能够很大程度地增加土壤真菌的丰富度和多样性,但对土壤细菌群落的影响较小,这与前人研究结果一致[19,32]。
大量研究发现,土壤细菌群落中的主要优势菌门通常为变形菌门和绿湾菌门,厚壁菌门所占的比例低于上述两个细菌门[12,32,46]。而本研究中厚壁菌门成为优势菌门,这可能是土壤中的芽孢杆菌属比例较高所致,其菌群组成差异可能与地域有很大关系。真菌群落中的优势菌门为子囊菌门,其在土壤中的比例远高于其他真菌门类,与大量关于土壤多样性的研究发现一致[28,46]。
本研究发现,微生物菌剂的施用增加了土壤中芽孢杆菌属的丰度,这可能是所施用微生物菌剂中的解淀粉芽孢杆菌WSW1 和阿耶波多氏芽孢杆菌JHIJ2-2在土壤中达到了良好定殖的体现。有研究发现,曲霉属的黄曲霉菌能够侵染农作物,导致相关农产品被黄曲霉毒素污染,危及食品安全和人类健康[47]。也有研究证实,曲霉属和青霉属均能分泌赭曲霉毒素A 等有毒次级代谢产物,具有强烈毒性[48]。本研究中,曲霉属是真菌群落中的优势属,微生物菌剂的施用减少了曲霉属以及青霉属的相对丰度,具有减少作物毒素积累的潜在能力。复合微生物菌剂处理(T2)能够增加土壤中嗜热链球菌属的丰度,这可能是由于T2使土壤pH 值显著降低,而嗜热链球菌属具有较强的耐酸性[49]。
4 结论
本研究发现,微生物菌剂特别是复合微生物菌剂的施用促进了草莓植株的生长,显著提高了草莓存活率和产量。复合微生物菌剂的施用能够有效改善土壤养分含量,使土壤有效磷和速效钾含量显著增加。同时,微生物菌剂提高了土壤真菌群落的丰富度和多样性,但对土壤细菌群落影响较小;微生物菌剂施用导致芽孢杆菌属丰度增加,真菌曲霉属和青霉属的丰度降低。综上,本研究使用的微生物菌剂特别是复合微生物菌剂对草莓生长、土壤养分和微生物群落具有良好的促进、改善作用,有利于草莓增产和连作障碍的防治。

