小豆五出复叶pcl突变基因的精细定位和转录分析
刘 震 邓 勇 赵超绮 星君宜 万 平 杨 凯
(北京农学院,植物科学技术学院/农业应用新技术北京市重点实验室,北京 102206)
小豆[Vigna angularis(Willd)Ohwi &Ohashi],别名红小豆、赤豆等,为一年生草本植物[1],隶属豆科(Leguminosae)豇豆属(Vigna)[2]。小豆是我国主要的食用豆类之一,已有上千年的栽培历史[3],种质资源极为丰富,但对小豆农艺性状的研究却很薄弱。2015年,Yang 等[4]完成了小豆全基因组测序,从基因组层次加快了对小豆农艺性状的研究分析。
叶片是小豆进行光合作用的重要器官,其在产量和品质的形成中发挥着重要作用[5]。多数豆科作物为复叶植物,其复叶形态能够直接影响光合特性和生物量积累。前人研究表明,绿豆多小叶复叶种质增加了叶面积指数,能更有效地吸收光能,同时绿豆七小叶复叶品系促进了产量提高[6];宗春美等[7-8]研究发现,大豆五小叶复叶品系牡5796-3具有较好的丰产性能。
突变体是开展作物遗传研究和育种的基础,具有优良性状的突变体可以为育种、科研和生产提供优质的种质资源。宗春美等[8]创制了一个多小叶大豆品系牡5796-3,初步得到了多小叶性状的遗传规律。Chontira 等[9]也通过辐射获得了绿豆多小叶性状的突变体。Wang 等[10]发现了一种起源于野生大豆的多小叶突变体,可创制抗病材料[11]。这些研究丰富了豆科多小叶突变体的种质资源,为探究豆科植物复叶调控模式提供了优质材料。
目前在豌豆(Pisum sativum)突变体中发现了uni单叶突变体[12]、cri异位小叶突变体[13]以及能够降低叶片复杂程度的stp突变体[14]。在蒺藜苜蓿(Medicago truncatula)中发现了sgl1单叶突变体[15]、palm1五出复叶突变体[16]、pinna1五出复叶突变体[17]。在绿豆(Vigna radiata)中发现了un单叶突变体[18]。在百脉根(Lotus japonicus)中发现了能够导致5 片小叶有不同程度融合,严重时5片小叶融合为1片叶的uml突变体[19]。但目前与小豆复叶发育相关的突变体研究还鲜有报道。
因此,北京农学院小豆课题组(本课题组)前期通过使用电子束射线在北京辐射中心对京农6 号供试种子进行辐射,在其辐射后代中筛选出一株五小叶复叶个体。该突变体较常规三小叶复叶小豆品种多了2 个小叶,经多代自交,获得了可稳定遗传的五出复叶叶型材料。本研究以小豆五出复叶突变体为材料,对小豆复叶发育调控基因进行遗传分析与图位克隆,确定五出复叶发育调控候选基因,并对野生型和突变体小豆进行转录组测序,分析突变性状关键候选基因可能的调控途径与功能,以期对小豆复叶发育的遗传调控提供研究方向。
1 材料与方法
1.1 试验材料
三出复叶小豆栽培品种GM635 与五出复叶突变体EB601 由北京农学院小豆课题组提供:使用300 Gy计量电子束处理小豆栽培品种京农6号,在后代中发现一株五出复叶突变体(图1),经过5 代自交获得遗传稳定的五出复叶材料(EB601),复叶性状基因暂定名为pcl(pentafoliate compound leaf)。

图1 三出复叶和五出复叶的表型特征Fig.1 Phenotypic characteristics of ternately and pentafoliate leaf
构建EB601×GM635 杂交组合,F1均为三出复叶表型,F2出现性状分离,收获F2单株,选用F2∶3株系用于遗传分析和基因初定位,F3∶4分离群体用于基因精细定位。
1.2 农艺性状分析
小豆农艺性状调查按照《小豆种质资源描述规范和数据标准》[20]进行。
1.3 突变体遗传分析与基因定位
1.3.1 突变体遗传分析 构建EB601×GM635杂交组合,调查F2∶3株系农艺性状并记录三出复叶和五出复叶表型,进行突变体遗传分析。
1.3.2 小豆基因组DNA 提取 采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法[21]提取小豆基因组DNA。
1.3.3pcl的初步定位 利用自主开发的小豆1 572对简单重复序列(simple sequence repeats,SSR)标记,对亲本和F2∶3株系差异性状个体基因组DNA 分别混池,并进行PCR 扩增筛选。找出与目标基因连锁的标记,再通过F2∶3家系对标记进行群体验证。PCR 反应体系共15 µL:5 U·µL-1TaKaRa Taq 0.25 µL,10 µmol·L-1正反引物各1 µL,1 mmol·L-1dNTPs 1.5 µL,1.5 mmol·L-1Mg2+1 µL,50 ng 小豆基因组DNA 2 µL,10×PCR Buffer 1.5 µL,ddH2O 6.75 µL;PCR 扩增程序:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,72 ℃终延伸10 min,35个循环。
1.3.4pcl的精细定位 提取F3∶4家系中个体和亲本的基因组DNA;三出复叶亲本和五出复叶亲本各取5 株DNA 样本分别等量混池,F3∶4家系中三出复叶个体和五出复叶个体各取50 株DNA 样本分别等量混池。通过高通量测序技术(“next-generation” sequencing technology,NGS)和集群分离分析法(super bulked segregant analysis,Super BSA)以及特异位点扩增测序技术(specific-locus amplified fragment sequencing,SLAF-seq)对亲本混池和差异个体混池进行测序分析,开发差异位点。基于数据结果使用Oligo 7.0 软件开发SSR 与单核苷酸多态性(single nucleotide polymorphisms,SNP)标记,构建三出复叶个体基因组DNA混池(10株)和五出复叶个体基因组DNA混池(10株),对亲本和2个差异性状个体基因组DNA混池进行引物筛选。反应体系与初定位相同,使用琼脂糖凝胶电泳检测PCR产物。通过SSR和SNP标记对初定位区间进行加密,缩小定位区间。
1.4 染色体步行
参考小豆基因组序列[4],对定位区间进行染色体步行。使用Oligo 7.0 软件设计克隆引物,引物合成由生工生物工程(上海)股份有限公司完成。使用2×Phanta®Max Master Mix(诺唯赞,南京)进行PCR 扩增,琼脂糖凝胶电泳回收PCR 产物,由深圳华大基因科技有限公司完成测序,使用启动区域元件分析网(http://bioinforma-tics.psb.ugent.be/webtools/plantcare/html)分析克隆结果中启动区域产生的突变位点。
1.5 转录组分析
1.5.1 RNA 提取和质量检测 采用TRIzol 试剂盒(赛默飞,美国)提取小豆三出复叶和小豆五出复叶幼叶样品的总RNA。通过Agilent 2100 Biognlyzer生物分析仪(安捷伦,美国)和NanoDrop 紫外分光光度计(赛默飞,美国)检测提取RNA 样品的质量、纯度及完整性,OD260/280在2.0~2.2 之间,RNA 分子完整数在6.6~8.5之间,可用于建库和测序。
1.5.2 cDNA文库构建、测序 选取3个生物学重复材料构建RNA-seq 文库。质量检测合格后,用Oligo(dT)磁珠富集样品中mRNA。加入打断试剂(fragmentation buffer)将mRNA 打断成短片段,反转录合成双链cDNA。利用AMPure XP beads 磁珠纯化双链cDNA,末端修复加A尾并连接测序接头。最后PCR扩增构建cDNA 文库。用Agilent 2100 Biognlyzer 生物分析仪和ABI StepOnePlus RealTime PCR System(赛默飞,美国)对文库的插入片段范围进行检测,对文库浓度进行定量,质检合格后,使用Illumina HiSeq 测序仪(Illumina,美国)进行测序。
1.5.3 原始数据组装 对测序所得原始数据进行过滤处理,去除包含测序接头的reads;去除未知碱基N含量大于10%的reads;去除低质量碱基(Q<5)含量大于50%的reads。统计clean reads 的数量、总长度、Q20、Q30、GC%等。将过滤后数据与Yang 等[4]的小豆参考基因组进行比对。
1.5.4 差异表达基因的筛选和功能注释 采用基于负二项分布模型的算法(DEGseq)进行差异表达分析。对差异基因进行筛选的阈值一般为Log2(Fold Change)>1 且P<0.05。通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,对差异表达基因进行通路分析,统计每个通路中包含的差异表达基因的个数,通过超几何检验找出显著富集的通路。
1.5.5 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)验证 采用TB Green®Premix Ex Taq™ II试剂盒(TaKaRa,日本),采用CFX96 实时荧光定量PCR 系统(Bio-Rad,美国)进行qRT-PCR 分析,qRTPCR 总体积为20 µL:TB Green Premix Ex Taq II(2X)9 µL,10 µmol·L-1正反引物各1 µL,100 ng cDNA 2 µL,ddH2O 7µL。反应条件:95 ℃预变性30 s;95 ℃变性10 s,58 ℃退火15 s,39 个循环;溶解曲线72 ℃ 30 s。以小豆β-Actin基因(Va03G001640)作为内参基因,每个样品分别设3次生物学重复和3次技术重复,以2-ΔΔCT法计算基因的相对表达量,并计算三出复叶野生型和五出复叶突变体之间的差异倍数Log2(Fold Change)。
1.6 数据分析
1.6.1 农艺性状分析 使用SPSS 19.0 和Excel 2007软件,对调查数据进行统计分析。
1.6.2 定位区间连锁图 使用Mapmaker 3.0 软件[22]构建基因连锁图,设置LOD=3.0,最大图距50.00 cM。
2 结果与分析
2.1 农艺性状分析
对EB601×GM635组合F2:3株系个体的株高、茎粗、主茎节数、单株荚数、荚长、荚宽、单荚粒数、单株产量、百粒重共9 个主要农艺性状进行调查统计分析,结果如表1所示。与三出复叶个体相比,五出复叶个体株高变高,茎变粗,主茎节数增多,豆荚和籽粒变大,单株荚数和单荚粒数增多,单株产量和百粒重提高;其中株高、茎粗、荚宽、单荚粒数和百粒重呈显著性差异(P<0.05),单株产量呈极显著性差异(P<0.01)。

表1 EB601×GM635 F2∶3株系农艺性状统计Table 1 Statistics of interesting agronomic traits of EB601×GM635 F2∶3 segregating population
对EB601×GM635 组合F2:3株系间9 个主要农艺性状进行了相关性分析。结果表明,在三出复叶和五出复叶表型之间,株高、茎粗、主茎节数、单株荚数之间的相关性显现出较好的一致性,均为极显著相关;而株高与荚长、单荚粒数、百粒重之间,单株荚数与荚长之间,单株产量与荚宽、百粒重之间,均未表现出共同的一致性。单株产量与各农艺性状之间,只有五出复叶个体在荚宽上表现为极显著相关(表2)。

表2 EB601×GM635 F2∶3各农艺性状相关性分析Table 2 Correlation analysis of agronomic traits in EB601×GM635 F2∶3 segregating population
综上,五出复叶突变基因对农艺性状有较大的影响,且会导致农艺性状之间的相关性发生变化。
2.2 小豆五出复叶调控基因的遗传分析
2016年种植的EB601×GM635 杂交组合F2群体单株收获,调查F2中三出复叶和五出复叶表型情况。2017年共种植了12 个EB601×GM635 杂交组合F2三出复叶个体的F2:3株系和3个F2五出复叶个体的F2∶3株系。3 个F2五出复叶个体的F3株系中个体没有复叶性状分离,均为五出复叶;12个F2三出复叶个体的F3株系中有7个株系出现复叶性状分离,对分离株系群体中个体复叶性状分离比(三出复叶个体数:五出复叶个体数)进行卡方检验,均符合3∶1的假设(表3)。
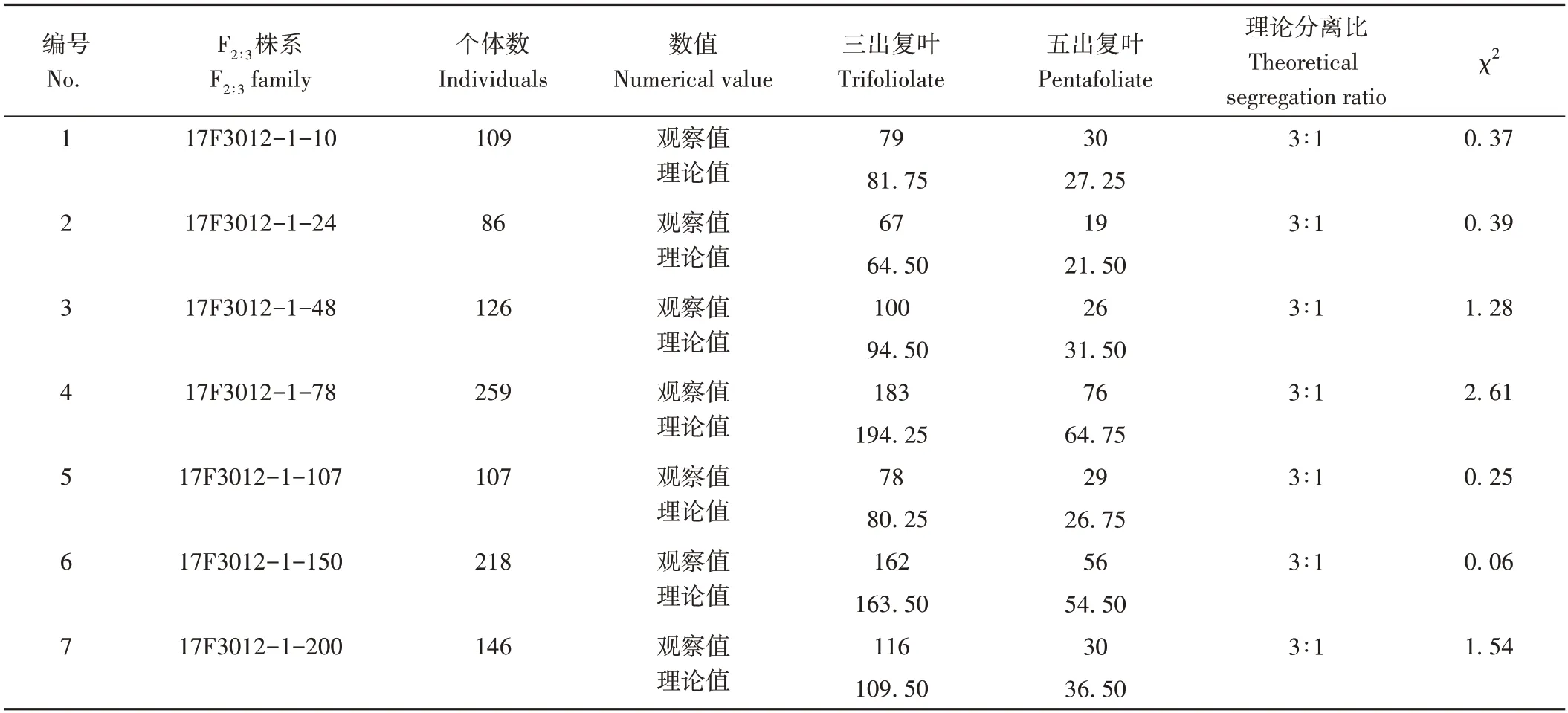
表3 EB601×GM635杂交组合F2∶3株系个体复叶性状分离统计Table 3 Segregation of pentafoliate and trifoliolate among F2∶3 family of EB601×GM635 populatuon
F2五出复叶个体的F2∶3株系中个体没有复叶性状分离,F2三出复叶个体的F2∶3株系中个体出现复叶性状分离现象,且三出复叶个体和五出复叶个体的分离比符合3∶1,表明小豆五出复叶个体由一对隐性基因控制,且符合孟德尔遗传。
2.3 五出复叶调控候选基因定位
随机选取GM635×EB601 F2:3株系三出复叶和五出复叶个体各10 株,将DNA 等量混合为三出复叶DNA混池和五出复叶DNA 混池。利用本课题组自主开发的1 572 对小豆基因组SSR 标记,筛选亲本和F2∶3差异个体DNA 混池间的差异标记,仅有BAgs369、BAgs802、BAgs1061这3对SSR标记扩增产物电泳带型满足pcl基因标记特征。使用这3 个SSR 标记进行群体验证,确定这3 个SSR 标记扩增位点与pcl基因存在连锁关系,标记均位于小豆参考基因组第5 号染色体的末端。根据参考基因组序列在定位区间内的SSR位点,开发了86 个SSR 标记。pcl基因定位在标记C5S207-5 和标记BAgs1061 之间13.4 cM 的候选区域内(表4、图2),标记C5S207-5 和BAgs1061 分别距pcl基因距离9.6和3.8 cM。
使用NGS 和Super-BSA 对GM635×EB601 F3∶4株系的三出复叶和五出复叶DNA 混池和亲本混池进行测序分析。获得的原始数据产量(Raw reads)平均值为15 500 821,过滤后有效数据量(Clean base)平均值为4.64 Gb,Clean reads 平均值为15 454 177,有效碱基率(Effective rate)平均值为99.70%,样品Q20 平均值为96.93%,GC 含量占比平均值为35.70%(表5)。上述结果表明,本研究测序质量符合要求。基于SLAF-seq技术发现,连锁区域内共有132 个SNP 位点,等距开发设计了23对SNP引物,并对亲本和F3:4群体254个单株进行验证,最终筛选出3 个SNP 标记88601FWR、15106FRM 和89739FMR 与pcl基因连锁(表4、图2)。进而将调控五小叶复叶的基因pcl定位到SNP 标记89739FMR 和SNP 标记15106FRM 之间,标记88601FWR、15106FRM 和89739FMR 距pcl基因距离分别为1.0、1.2和0.4 cM(图3)。

表5 Super-BSA 重测序数据统计Table 5 Basic date for samples by super-BSA

图2 部分EB601×GM635家系分离群体个体开发引物扩增电泳图谱Fig.2 Electrophoretic map of developed primer amplification for EB601×GM635 segregating populations individuals

表4 开发的部分标记和复叶发育相关基因表达分析引物Table 4 Some developed markers and quantitative primers of compound leaf development related genes
2.4 五出复叶定位区间染色体步行
依据京农6号参考基因组,对基因定位区间1.6 cM内的基因进行分析。连锁标记的遗传与物理位置排列顺序一致,对应小豆参考基因组5号染色体上约500 kb的区间,共有27个基因(表6)。通过染色体步行发现,定位区间内距VaTMK3基因前960 bp 位置的启动区存在一个突变碱基(A 变C)位于TATA-box 元件上,该突变位点分析与性状共分离(图3)。VaTMK3编码TMK类蛋白,参与细胞扩张、生长素转运。叶片细胞的增殖扩张与TMKs密切相关,TMKs通过调节生长素来控制植物的生长发育。

表6 500 kb定位区间基因注释Table 6 Gene annotation in 500 kb localized interval
2.5 转录组分析
2.5.1 基因表达量分析 三出复叶和五出复叶幼叶样本中检测到基因数量在24 800~25 529个之间,对样本中基因表达量进行统计,结果显示每个样本中有2 116(8.44%)~4 552(18.63%)个基因的FPKM(Fragments Per Kilobase per Million)>30,8 999(36.89%)~10 166(40.47%)个基因的FPKM 在5~30之间,占比最高。三出复叶和五出复叶在幼叶中有5 260个差异表达基因,相对于三出复叶幼叶,五出复叶幼叶中有3 411个基因表达上调,有1 849个基因表达下调(图4)。
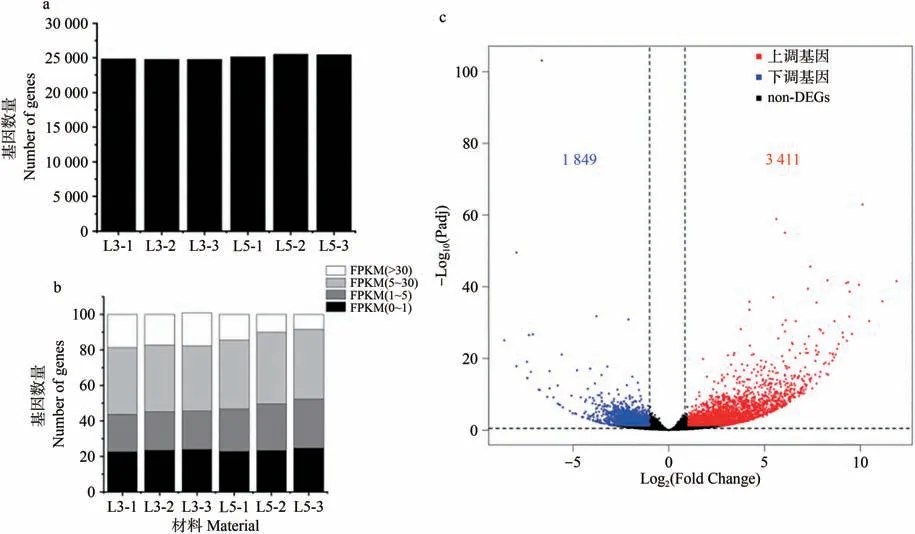
图4 差异表达基因分析Fig.4 Analysis of differentially expressed genes
2.5.2 差异表达基因Pathway 富集分析 KEGG 富集结果显示,在幼叶中差异表达基因被富集到133条通路中,其中显著富集的有14 条(P<0.05),主要包括植物MAPK 信号通路(MAPK signaling pathway-plant,ko04016)、植物病原互作(plant-pathogen interaction,ko04626)(表7)。植物MAPK 信号转导通路参与植物的生长发育,与植物激素的生物合成、运输和信号转导之间存在紧密联系。说明小豆五出复叶调控模式与植物激素合成运输信号转导有关。

表7 差异表达基因KEGG富集Table 7 KEGG enrichment of differentially expressed genes
2.5.3 五出复叶中相关生长素调控基因差异表达转录组测序与qRT-PCR 数据分析结果发现,相对于三出复叶中的表达情况,生长素信号传导相关基因在五出复叶中显著或极显著差异表达,如VaTMK3在幼叶中表达极显著上调;参与生长素转运与介导生长素梯度形成的VaPIN1a(auxin efflux carrier component 1-like)和VaPIN1b(auxin efflux carrier component 1-like)基因在五出复叶幼叶中均极显著上调表达;同时在五出复叶幼叶中参与质子驱动的生长素流入的载体蛋白编码基因VaLAX1(auxin transporter-like protein 1)、VaLAX3(auxin transporter-like protein 3)和VaLAX5(auxin transporter-like protein 5)均上调表达,这类基因可介导从发育中的叶片(生长素生物合成部位)到尖端的生长素梯度的形成;编码生长素转运抑制蛋白(transport inhibitor response 1-like protein)的基因Va07G049160和Va03G081560也呈现上调表达(图5)。说明生长素浓度与梯度分布可能参与小豆五出复叶突变体发育调控。

图5 转录组测序与qRT-PCR分析基因相对表达Fig.5 The relative expression of key genes by transcriptome sequencing and qRT-PCR analysis
2.5.4 五出复叶中叶片极性调控相关基因差异表达 转录组测序与qRT-PCR 数据分析发现,在五出复叶幼叶中能够调节叶片极性的YABBY 基因家族成员VaYAB5(axial regulator YABBY5)、VaYAB1(axial regulator YABBY1)和VaYAB4(axial regulator YABBY4)基因表达量显著上调(图5)。说明小豆YABBY基因家族基因过表达可能参与五出复叶突变体叶片极性调控。
3 讨论
本研究通过小豆五出复叶性状遗传分析发现,三出复叶性状为显性性状。五出复叶小豆较三出复叶小豆生长速度快,植株高,生长茂盛,说明pcl基因对植株的生长影响程度较大。在小豆五出复叶pcl的作用下,株高变高,茎变粗,而且主茎节数增多,说明小豆五出复叶突变体对小豆生长发育具有积极作用。由上述结果可知,研究小豆五出复叶突变体对阐述小豆复叶发育机理和小豆叶型遗传改良具有重要意义。
前人研究发现TMKs 基因家族通过调节细胞扩张和细胞增殖来协调植物生长[23]。同时TMKs还参与生长素信号转导调控途径TMK1-IAA32/34-ARFs 和TMK1/ABP1-ROP2/6-PINs。拟南芥中,TMKs的功能与在叶片起始和发育的早期增殖阶段直接调控细胞的生长有关[23];TMKs 家族基因表达下降导致拟南芥对生长素的敏感性下降,所以TMKs 家族似乎通过调节细胞扩张和增殖来参与植物叶片的生长,并作为生长素信号传导的一个组成部分影响植物中的生长素转运[23]。本研究对小豆复叶发育调控基因进行遗传分析与图位克隆,确定五出复叶发育调控候选基因为VaTMK3。VaTMK3属于TMKs 家族,编码的TMK 蛋白与生长素信号传导以及细胞生长发育密切相关[23]。故推测五出复叶突变体VaTMK3表达的上调可能会影响生长素信号转导。进一步分析发现,五出复叶突变体幼叶中参与质子驱动的生长素流入的载体蛋白基因VaLAX1、VaLAX3、VaLAX5表达均上调;同时编码生长素转运抑制蛋白的基因Va07G049160和Va03G081560基因也都上调表达,说明VaTMK3基因表达量的改变可能对调控生长素转运基因产生影响。
前人对番茄、碎米芥的复叶研究发现,复叶原基的叶边缘分裂区域中,存在高浓度生长素,其对小叶生长、叶原基发生均产生了影响,且单叶和复叶里生长素浓度变化与PIN(PIN-FORMED)基因密切相关[24]。已报道发现百脉根中PIN1同源基因UML的突变体会导致小叶原基融合,顶叶出现“杯子”、“雨伞”形态[19]。TMKs能够通过调控参与介导植物生长素运输的基因PIN(PIN-FORMED)来影响生长素的分布[25]。本研究在五出复叶突变体小豆幼叶中发现VaPIN1a、VaPIN1b均上调表达,表明五出复叶中VaTMK3表达量的上调可能调控了VaPIN1a和VaPIN1b的表达,从而影响了小豆复叶形态。
当前研究还发现,生长素外排转运体PIN3 和生长素内流载体LAX3 的连续作用能够间接激活MAPK 信号通路中MPK3/MPK6 级联反应,从而促进CWR基因的表达,导致侧根的产生[26]。而小豆五出复叶中MAPK 信号通路差异显著,推测小豆额外小叶的产生可能与侧根产生的模式相似,生长素的积聚可能起到关键作用。
在五出复叶突变体幼叶中,YABBY 家族基因VaYAB1、VaYAB4和VaYAB5表达量明显上调。有报道发现YAB1能够参与器官发生过程中远轴细胞形态的建立并调节胚胎芽顶端分生组织(shoot apical meristem,SAM)发育的起始[27],且转录因子YAB1在拟南芥中影响叶发育;YAB4对胚珠外珠被的形成和背面-正面不对称生长至关重要,同时促进近轴细胞特性[28];YAB5调节胚芽顶端分生组织的起始发育[29]。在叶器官发育起始时YAB1和YAB5在叶片远轴面表达,促进叶极性的确立[30]。在大豆(Glycine max)中,YAB1类基因GmFILa在拟南芥中过表达引起叶片近轴端表现为部分远轴化,导致叶片卷曲,生育期延长,同时影响自由态生长素含量[31]。由于生长素活性在叶片的近远轴间的差异对叶片形态发育产生影响[32],推测VaYAB1、VaYAB4和VaYAB5基因表达可能参与生长素浓度梯度分布的变化,进而影响小豆复叶发育过程,但YABBY 家族基因是否直接参与小豆复叶发育还需进一步验证。
综上所述,小豆复叶发育调控可能是由候选基因VaTMK3通过影响生长素跨膜转运相关基因VaPIN1a、VaPIN1b、VaLAX1、VaLAX3、VaLAX5,调控小豆叶片中生长素浓度梯度,导致分裂带发生生长素积累,从而调控异位小叶起始发育;同时,生长素浓度改变会导致YABBY 基因家族中VaYAB1、VaYAB4 和VaYAB5表达上调,致使小豆叶片远轴极性发生变化,即在YaTMK3和YABBY家族基因共同作用下导致五出复叶产生。
4 结论
本研究通过辐射诱变获得小豆五出复叶突变体pcl,相比于野生型小豆,其农艺性状均有所提高。遗传分析结果表明,五出复叶突变体pcl受一对隐性基因控制,定位区间内确定候选基因为VaTMK3,该基因参与生长素信号转导,其在突变体pcl幼叶中显著上调表达。突变体pcl幼叶中参与生长素跨膜转运载体蛋白基因VaPIN1a、VaPIN1b、VaLAX1、VaLAX3、VaLAX5均上调表达。由此推测VaTMK3可能是通过影响生长素浓度梯度导致小豆复叶的产生改变,以及YABBY家族可能参与了小豆复叶的发育过程。

