白蛋白结合型紫杉醇联合卡铂化疗对中晚期非小细胞肺癌患者免疫功能及预后的影响
刘伟辉,周益臣,杨倩,付江萍
紫杉醇联合顺铂方案作为无法行根治性切除术治疗的中晚期非小细胞肺癌患者一线治疗方案[1]。但该方案毒副反应较大,患者耐受性差,可导致患者生存质量降低。为此有研究提出了白蛋白结合型紫杉醇替代紫杉醇的化疗方案。白蛋白结合型紫杉醇是一种新型辅助型紫杉醇,其以人血白蛋白作为治疗载体,可降低化疗毒副反应,患者耐受度高,且可一定程度改善患者的生存质量[2]。相较于顺铂,卡铂对患者造成的胃肠道反应、肾毒性、耳毒性、神经毒性明显减轻,无需水化治疗。现观察白蛋白结合型紫杉醇联合卡铂化疗对中晚期非小细胞肺癌患者免疫功能、血气指标及预后的影响,报道如下。
1 资料与方法
1.1 临床资料 选取2019年10月—2021年9月达州市中心医院收治的106例中晚期非小细胞肺癌患者,按照随机数字表法分为对照组与研究组,各53例。对照组中男41例,女12例;平均年龄(42.50±4.40)岁;平均病程(2.11±0.73)年;临床分期:ⅢB期29例,Ⅳ期24例。研究组中男43例,女10例;平均年龄(43.50±4.37)岁;平均病程(2.20±0.69)年;临床分期:ⅢB期30例,Ⅳ期23例。2组临床资料比较,差异无统计学意义(P>0.05)。
1.2 病例选择标准 诊断标准:符合《中国间变性淋巴瘤激酶阳性、ROS1阳性非小细胞肺癌诊疗指南》[3]中的中晚期非小细胞肺癌诊断标准,即:(1)存在原发病灶相关症状,如咳嗽、痰血或咯血、呼吸困难或喘鸣、发热、体质量下降等;(2)存在胸内散播相关症状,如声音嘶哑、胸痛、胸腔积液、吞咽困难等症状;(3)影像学检查可见支气管壁增厚导致支气管管腔狭窄,肺门肿块、肺部阴影密度不均匀、形态不规则等。纳入标准:(1)年龄≤70岁,卡氏(KPS)评分≥60分;(2)无法行手术切除,且无研究中相关药物过敏史;(3)患者及家属知晓本研究并签署知情同意书。排除标准:(1)复发性晚期非小细胞肺癌或合并严重心脑血管疾病或其他严重内分泌系统疾病者;(2)合并认知障碍及其他精神疾病者;(3)临床资料缺失者;(4)不配合研究,态度极差或研究过程中退出者。
1.3 治疗方法 对照组采用紫杉醇联合顺铂化疗:紫杉醇注射液(扬子江药业集团生产)135~175 mg/m2,化疗第1天用药;注射用顺铂(齐鲁制药有限公司生产)75 mg/m2,化疗第1~3天用药。每21 d为1个化疗周期,共行6个化疗周期。研究组采用白蛋白结合型紫杉醇联合卡铂化疗:注射用紫杉醇(白蛋白结合型)(石药集团欧意药业有限公司生产)130 mg/m2,化疗第1、8天用药;卡铂(仁合煕德隆药业有限公司生产)5 mg/m2,化疗第1天用药。以21 d为1个化疗周期,共行6个化疗周期。
1.4 观察指标与方法 (1)免疫功能和血气指标:于化疗前及治疗6个月后清晨抽取患者血液样本,离心后放置在-40 ℃的环境中集中低温保存,应用流式细胞分析仪检测患者免疫球蛋白A(IgA)、免疫球蛋白M(IgM)水平。动脉血二氧化碳分压(PaCO2)和动脉血氧饱和度(SaO2)检测方法参考文献[4]。IgA、IgM水平越低表明患者机体免疫功能受损越严重[5];PaCO2越高、SaO2越低表明机体血液供氧不足。(2)化疗不良反应:观察并记录患者化疗期间发生白细胞减少、血小板减少、贫血、恶心呕吐、肝功能损伤、肾功能损伤、脱发及关节肌肉疼痛等发生情况。(3)生存质量:化疗结束后3 d,采用KPS评估患者体能状态,KPS分数越高表明患者的身体状况越好。(4)预后:在患者化疗结束后随访6个月,记录患者总生存时间(从治疗结束到患者死亡或随访截止日期)和无进展生存期(从治疗结束到疾病进展的时间阶段)。
1.5 疗效评定标准 以实体肿瘤的疗效评价标准1.1版进行本研究患者的疗效评价,以患者病灶完全消失且维持时间>4周为完全缓解(CR);患者基线病灶最大径总和缩小30%及以上且维持时间>4周为部分缓解(PR);患者基线病灶最大径总和缩小不足30%,或增大未超过20%,介于PR和进展(PD)之间为病情稳定(SD);患者基线病灶最大径总和增大20%及以上,或出现新病灶为PD。客观缓解率(ORR)=(CR+PR)/总例数×100%。

2 结 果
2.1 临床疗效比较 研究组中CR 10例(18.87%),PR 34例(64.15%),SD 9例(16.98%),PD 0例,ORR为83.02%(44/53);对照组中CR 5例(9.43%),PR 29例(54.72%),SD 17例(32.08%),PD 2例(3.77%),ORR为64.15%(34/53)。研究组ORR高于对照组(χ2=4.853,P=0.028)。
2.2 免疫功能及血气指标比较 化疗前,2组IgA、IgM水平及PaCO2、SaO2比较,差异无统计学意义(P>0.05)。化疗6个月后,2组IgA、IgM水平及SaO2高于化疗前,PaCO2低于化疗前,且研究组升高/降低幅度大于对照组(P<0.01),见表1。

表1 对照组与研究组化疗前后IgA、IgM水平及PaCO2、SaO2比较
2.3 不良反应发生率比较 研究组化疗期间白细胞减少、血小板减少、贫血发生率比较,差异无统计学意义(P>0.05)。研究组恶心呕吐、肝功能损伤、肾功能损伤、脱发、关节肌肉疼痛发生率低于对照组(P<0.05或P<0.01),见表2。
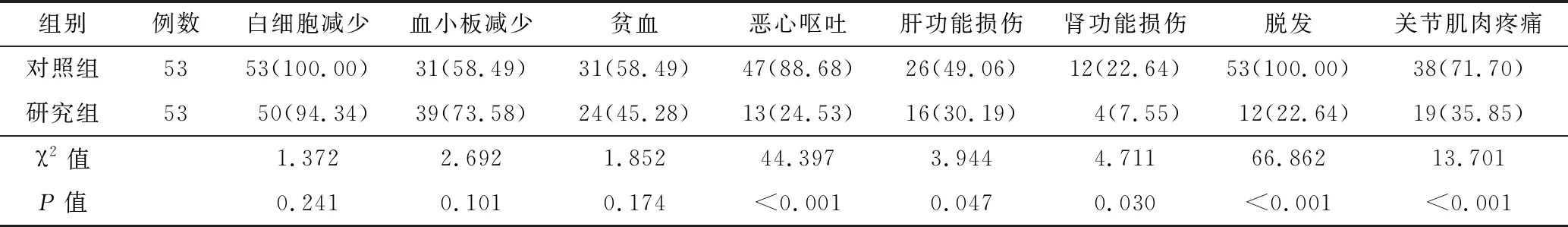
表2 对照组与研究组化疗不良反应发生情况比较 [例(%)]
2.4 KPS评分比较 化疗前,对照组与研究组KPS评分分别为(67.34±2.59)分、(67.21±2.55)分,组间比较,差异无统计学意义(t=0.260,P=0.795)。化疗6个月后,对照组与研究组KPS评分分别为(78.30±1.87)分、(84.92±2.99)分,分别高于同组化疗前(t/P=24.977/<0.001、32.809/<0.001),且研究组高于对照组(t=13.666,P<0.001)。
2.5 预后比较 研究组总生存时间、无进展生存期分别为(4.10±0.29)个月、(2.90±0.22)个月,分别长于对照组的(3.95±0.27)个月、(2.58±0.30)个月(t/P=2.756/0.007、6.262/<0.001)。
3 讨 论
紫杉醇作为一种从紫衫类植物中分离提取出的一种抗肿瘤药物,能够通过加强微管蛋白聚合作用抑制微管解聚,以破坏肿瘤细胞有丝分裂、抑制DNA结合,最终控制病情进展和肿瘤转移,延长患者的生存期。铂类的主要作用于能够直接破坏DNA双链间的碱基,导致DNA双链断裂,阻碍DNA复制、转录,属于细胞周期非特异性药物[6-7]。相较于顺铂,卡铂对患者造成的胃肠道反应、肾毒性、耳毒性、神经毒性反应较轻,无需水化利尿。紫杉醇联合顺铂化疗方案常被广泛用于治疗中晚期非小细胞肺癌,但由于传统溶剂型的紫杉醇具有高度疏水性,需使用聚氧乙烯蓖麻油作为临床溶剂,且顺铂需要水化治疗,这会增加患者化疗毒副反应发生风险,故该化疗方案受到限制[8]。戴冰等[9]提出将紫杉醇替换为白蛋白结合型紫杉醇。白蛋白结合型紫杉醇是以人血白蛋白为载体形成的白蛋白结合型紫杉醇颗粒,可与细胞膜上的白蛋白受体结合,激活细胞膜上的通道蛋白,借助血管内皮细胞进入肿瘤组织,进而杀灭肿瘤细胞,同时调节IgA、IgM等免疫因子,促进机体免疫功能恢复。IgA作为血清中含量较高的免疫球蛋白,对于诊断免疫缺陷、感染及自身免疫性疾病具有重要的临床意义,而血清IgM则是分子量最大的免疫球蛋白,主要由脾脏和淋巴结中的浆细胞分泌、合成,具有杀菌、激活补体、免疫调节和凝集的作用[10]。本研究结果显示,研究组总有效率及IgA、IgM水平高于对照组,不良反应发生率低于对照组,且KPS评分高于对照组,总生存时间和无进展生存期长于对照组,证实了卡铂联合白蛋白结合型紫杉醇化疗方案可有效提高中晚期非小细胞肺癌患者的免疫功能,改善身体状况,延长患者生存期,增强疗效,且可降低不良反应发生风险。此外,化疗6个月后研究组PaCO2低于对照组,SaO2高于对照组,表明卡铂联合白蛋白结合型紫杉醇化疗可有效改善晚期非小细胞肺癌患者的血气指标,分析原因为:该药物组合可与细胞膜白蛋白及其受体结合,增加药物成分与肿瘤细胞间的通透性,进而在破坏肿瘤细胞DNA合成、抑制肿瘤细胞增殖同时促进机体免疫功能恢复,进而提高肿瘤控制效果,改善患者预后及生存质量。由于本研究纳入样本量较少,后续仍需大样本量的多中心研究进行深入探索。
综上所述,中晚期非小细胞肺癌患者采用白蛋白结合型紫杉醇联合卡铂化疗的临床获益较大,可明显增强机体免疫功能,改善血气指标,延缓病情进展,进而改善患者预后,延长生存期,且可减少不良反应。
利益冲突:所有作者声明无利益冲突。

