lncRNA DNAJC3-AS1靶向miR-4319调控皮肤鳞状细胞癌增殖、迁移和侵袭
周 钰,黎晓红,段亚菊,汤舒玲,罗 咏,王 简
(华中科技大学 同济医学院附属梨园医院 皮肤美容科,湖北 武汉 430077)
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)是起源于人皮肤表皮角质形成细胞或皮肤附属器的非黑色素瘤皮肤癌,虽然多数CSCC通过手术切除可以治疗,但仍有部分患者在术后极易复发和转移,即使在接受强化治疗后转移性患者的长期预后仍较差[1-2]。探讨CSCC转移的潜在机制对开发有效的CSCC治疗策略意义重大。长链非编码RNA(lncRNA)在肿瘤中表达异常,并通过调控靶微小RNA(miRNA)表达影响肿瘤细胞生物学行为,参与调控肿瘤进展,是肿瘤治疗的潜在靶点[3-4]。研究发现,lncRNA DNAJC3反义RNA1(DNAJC3-AS1)在骨肉瘤中表达上调,DNAJC3-AS1高表达可增强骨髓瘤细胞的增殖、迁移和侵袭能力,促进顺铂耐药[5]。但DNAJC3-AS1在CSCC中的功能未见报道。miR-4319在结肠癌、食管鳞癌中表达降低,恢复其表达可抑制癌细胞增殖,改变细胞周期分布,抑制肿瘤形成[6-7]。lncRNA GNAS反义RNA1(GNAS-AS1)通过直接抑制miR-4319改变巨噬细胞M2极化,促进非小细胞肺癌细胞的迁移和侵袭[8]。靶基因预测到miR-4319是DNAJC3-AS1的潜在靶点,但DNAJC3-AS1是否靶向miR-4319调控CSCC进展尚未可知。本研究分析了CSCC组织中DNAJC3-AS1、miR-4319表达水平,并通过体外细胞实验验证DNAJC3-AS1靶向miR-4319在CSCC进展的功能。
1 材料与方法
1.1 材料
1.1.1 CSCC组织来源 随机选取2017年1月至2019年6月在我院确诊为CSCC并接受手术治疗的39例患者为研究对象。术前所有CSCC患者未接受任何抗肿瘤治疗。手术获得的CSCC组织和对应癌旁组织样本迅速置于液氮中冷冻,以后转移保存在-80℃冰箱直到使用。本研究方案经我院伦理委员会批准(NO:201601233),所有患者均签署书面知情同意书。
1.1.2 细胞和试剂 CSCC细胞系A431(中国科学院典型培养物保藏中心);总RNA提取试剂盒、cDNA第一链合成试剂盒、2×Taq PCR MasterMix(北京天根生化公司);si-DNAJC3-AS1、si-NC、miR-4319 mimics、miR-NC、pcDNA-DNAJC3-AS1、pcDNA、anti-miR-4319、anti-miR-NC、荧光素酶报告载体(上海吉玛制药公司);Lipofectamine 2000(美国Thermofisher公司);细胞计数试剂盒(CCK-8)、磷酸甘油醛脱氢酶(GAPDH)兔单抗(AF1186)、山羊抗兔IgG(A0208)、N-cadherin兔多抗(AF0243)、E-cadherin兔多抗(AF6759)均购自上海碧云天公司;Transwell小室(美国corning公司);双荧光素酶活性检测试剂盒(广州复能基因)。
1.2 方法
1.2.1 RT-qPCR检测DNAJC3-AS1和miR-4319表达 总RNA提取试剂盒分离CSCC组织和癌旁组织的RNA后,用cDNA第一链合成试剂盒进行逆转录,再用2×Taq PCR MasterMix进行RT-qPCR。DNAJC3-AS1引物序列(上游5′-TTG CTC TAA GGC AGG TAG GTA A-3′,下游5′-TTG CTC TAA GGC AGG TAG GTA A-3′)GAPDH引物序列(上游5′-GAC CTG ACC TGC CGT CTA G-3′,下游5′-AGG AGT GGG TGT CGC TGT-3′);miR-4319引物序列(上游5′-GCA CAG CTC CCT GAG CAA-3′,下游5′-CAG TGC GTG TCG TGG AGT-3′);U6引物序列(上游5′-CTC GCT TCG GCA GCA CAT-3′,下游5′-TTT GCG TGT CAT CCT TGC G-3′)。2-ΔΔCT法计算DNAJC3-AS1和miR-4319表达水平。
1.2.2 细胞培养和分组 A431细胞接种于含10%胎牛血清的DMEM培养基,置于37 ℃、5% CO2培养箱中培养。将对数生长期A431细胞按照2×104个/孔接种于24孔板,使用Lipofectamine 2000将40 nm/L的寡核苷酸或2 μg的质粒分别转染50%融合A431细胞。转染48 h收集细胞,RT-qPCR检测转染效果后进行体外实验。A431细胞共分为si-NC组、si-DNAJC3-AS1组、miR-NC组、miR-4319组、pcDNA组、pcDNA-DNAJC3-AS1组、si-DNAJC3-AS1+ anti-miR-NC组、si-DNAJC3-AS1+ anti-miR-4319组。
1.2.3 CCK-8法检测细胞活力 将各组A431细胞以1×104个/孔的密度接种96孔板,细胞贴壁后,按照培养基和CCK-8试剂体积比为10∶1加入CCK-8试剂,再孵育2 h后,用酶标仪在450 nm处测量光密度(OD)值以表示各组A431细胞活力。
1.2.4 平板克隆实验检测细胞克隆能力 将各组A431细胞以3×102个/孔接种于6孔板,置于37 ℃培养箱孵育10~12 d直到出现细胞集落。弃去细胞培养液,磷酸盐缓冲液洗涤3次,用4%多聚甲醛固定后,用1%结晶紫染色30 min。光镜下计数>50个细胞的集落数为克隆形成数。
1.2.5 划痕愈合实验检测细胞迁移 将各组A431细胞按照5×102个/孔接种在6孔板并生长至80%汇合。用无菌移液管尖端划伤细胞单层以产生划痕。用磷酸盐缓冲液冲洗2次去除分离细胞,加入新鲜培养基,孵育0 h和48 h分别将6孔板置于显微镜下拍照,测量划痕宽度。划痕愈合率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%
1.2.6 Transwell实验检测细胞侵袭 Matrigel基质胶稀释后,取50 μL包被Transwell小室。无血清DMEM培养基重悬各组A431细胞,每组取200 μL(含2×105个细胞)接种到Transwell小室上室,下室加入含有10%胎牛血清的DMEM培养基。于37 ℃培养箱孵育24 h后,清洗上室,用4%多聚甲醛固定侵袭细胞,用0.1%结晶紫染色,在显微镜下计数各组A431细胞侵袭数量。
1.2.7 Western blot检测N-cadherin、E-cadherin蛋白表达 RIPA法提取蛋白后进行定量。SDS-PAGE分离等量蛋白样品,然后湿转到PVDF膜上。5%脱脂牛奶封闭膜后,用一抗在4 ℃下孵育过夜。N-cadherin抗体1∶500稀释、E-cadherin抗体1∶800稀释,内参GAPDH抗体1∶1 000稀释。PBS洗涤后,用二抗室温孵育1 h。用增强化学发光法观察印迹,Quantity One软件测量N-cadherin、E-cadherin条带相对灰度值。
1.2.8 双荧光素酶报告实验 将A431细胞接种于24孔板,用Lipofectamine 2000将miR-NC与WT-DNAJC3-AS1、miR-4319 mimics与WT-DNAJC3-AS1、miR-4319 mimics与MUT-DNAJC3-AS1、miR-NC与MUT-DNAJC3-AS1分别转染A431细胞。转染48 h后,收集细胞裂解物,双荧光素酶检测试剂盒检测荧光素酶活性。将荧光素酶活性归一化为海肾荧光素酶活性。

2 结果
2.1 lncRNA DNAJC3-AS1和miR-4319在CSCC组织中的表达 CSCC组织中DNAJC3-AS1表达水平与癌旁组织比较显著升高(P<0.05),miR-4319表达水平与癌旁组织比较显著降低(P<0.05,表1)。CSCC组织中DNAJC3-AS1和miR-4319表达呈负相关关系(图1)。
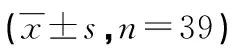
表1 lncRNA DNAJC3-AS1和miR-4319在CSCC组织中的表达
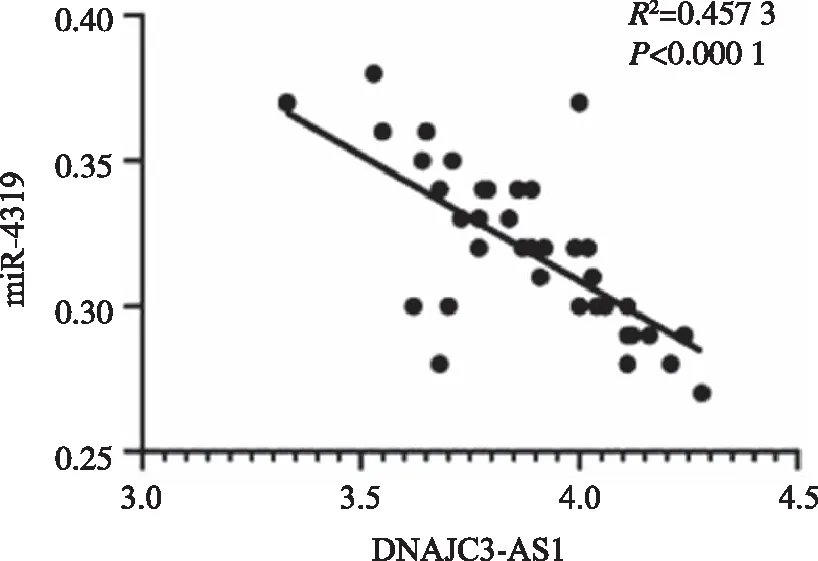
图1 lncRNA DNAJC3-AS1和miR-4319相关性分析
2.2 抑制lncRNA DNAJC3-AS1表达对A431细胞增殖、迁移和侵袭的影响 si-DNAJC3-AS1组A431细胞DNAJC3-AS1表达水平显著低于si-NC组(P<0.05),表明转染si-DNAJC3-AS1可抑制DNAJC3-AS1表达。与si-NC组比较,si-DNAJC3-AS1组A431细胞N-cadherin蛋白表达、细胞OD值、克隆形成数、侵袭数量显著降低(P<0.05),E-cadherin蛋白表达显著升高(P<0.05,图2、表2)。
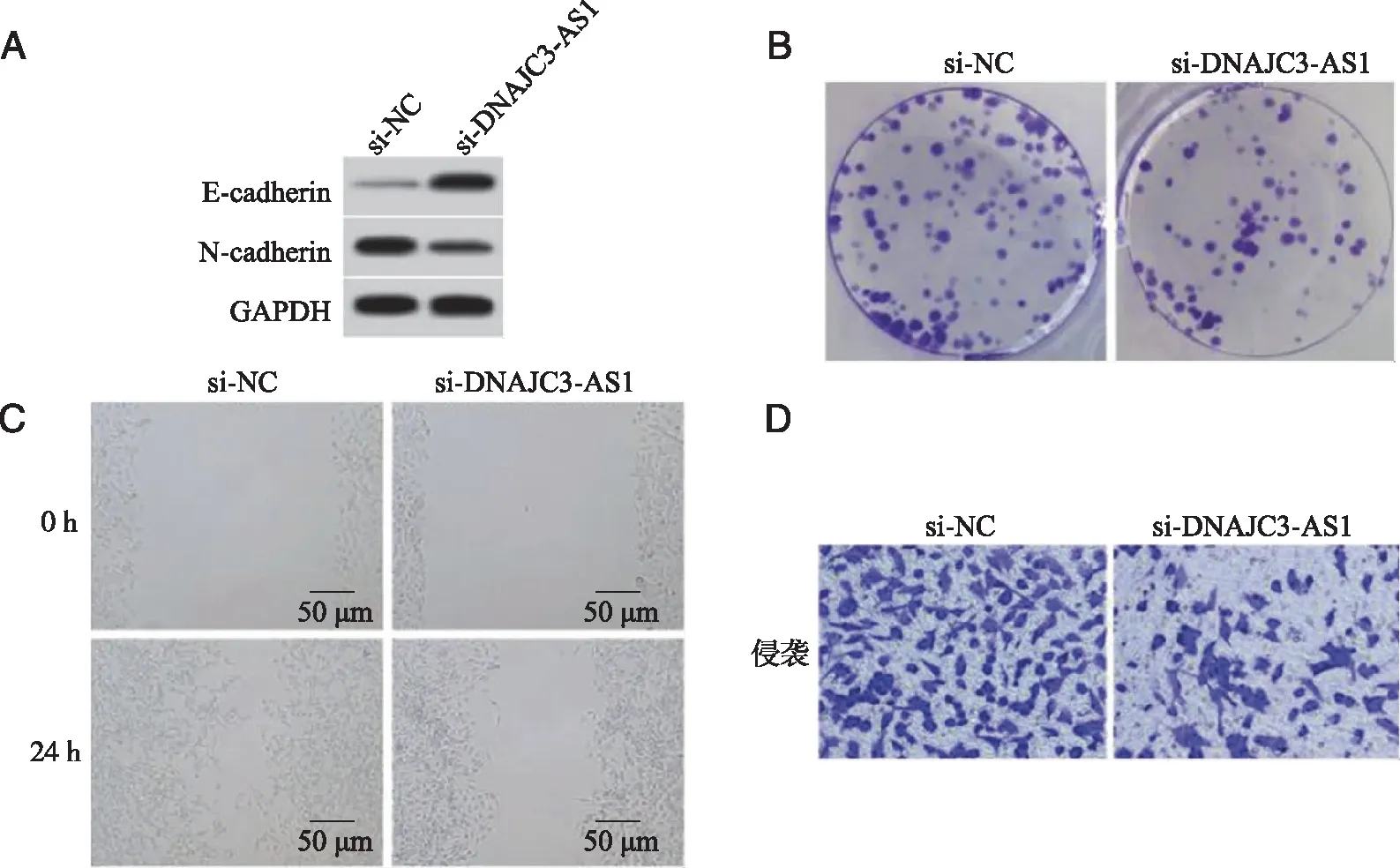
A:抑制lncRNA DNAJC3-AS1表达上调E-cadherin蛋白表达、下调N-cadhwein蛋白表达;B:抑制lncRNA DNAJC3-AS1表达抑制A431细胞克隆形成;C:抑制lncRNA DNAJC3-AS1表达抑制A431细胞划痕愈合;D:抑制lncRNA DNAJC3-AS1表达抑制A431细胞侵袭。图2 抑制lncRNA DNAJC3-AS1表达对A431细胞增殖、迁移和侵袭的影响

表2 抑制lncRNA DNAJC3-AS1表达对A431细胞增殖、迁移和侵袭的影响
2.3 过表达miR-4319对A431细胞增殖、迁移和侵袭的影响 miR-4319组细胞中miR-4319表达水平与miR-NC组比较显著升高(P<0.05),见表3,表明转染miR-4319 mimics可上调miR-4319表达。与miR-NC组比较,miR-4319组A431细胞N-cadherin蛋白表达、细胞OD值、克隆形成数、侵袭数量显著降低(P<0.05),E-cadherin蛋白表达显著升高(P<0.05,表3、图3)。

表3 过表达miR-4319对A431细胞增殖、迁移和侵袭的影响

A:过表达miR-4319上调E-caderin蛋白表达、下调N-cadherin蛋白表达;B:过表达miR-4319抑制A431细胞克隆形成;C:过表达miR-4319抑制A431细胞划痕愈合;D:过表达miR-4319抑制A431细胞侵袭。图3 过表达miR-4319对A431细胞增殖、迁移和侵袭的影响
2.4 lncRNA DNAJC3-AS1靶向调控miR-4319的表达 LncBase Predicted v.2预测结果见图4,DNAJC3-AS1与miR-4319存在互补的核苷酸序列。与miR-NC+WT-DNAJC3-AS1组比较,miR-4319+WT-DNAJC3-AS1组A431细胞的相对荧光素酶活性显著降低(P<0.05);miR-4319+ MUT-DNAJC3-AS1组A431细胞的相对荧光素酶活性与miR-NC+MUT-DNAJC3-AS1组比较差异无统计学意义(P>0.05,表4)。pcDNA-DNAJC3-AS1组A431细胞miR-4319表达水平显著低于pcDNA组(P<0.05);si-DNAJC3-AS1组A431细胞miR-4319表达水平显著高于si-NC组(P<0.05,表5)。

图4 lncRNA DNAJC3-AS1的序列中含有与miR-4319互补的核苷酸序列

表4 双荧光素酶报告实验

表5 lncRNA DNAJC3-AS1调控miR-4319的表达
2.5 干扰miR-4319表达逆转了抑制lncRNA DNAJC3-AS1表达对A431细胞增殖、迁移和侵袭的作用 与si-DNAJC3-AS1+anti-miR-NC组比较,si-DNAJC3-AS1+anti-miR-4319组A431细胞miR-4319表达水平显著降低,N-cadherin蛋白表达、细胞OD值、克隆形成数、侵袭数量显著升高(P<0.05),E-cadherin蛋白表达显著降低(P<0.05,图5、表6)。

A:干扰miR-4319表达逆转了抑制lncRNA DNAJC3-AS1表达对A431细胞迁移侵袭相关蛋白表达的作用;B:干扰miR-4319表达逆转了抑制lncRNA DNAJC3-AS1表达对A431细胞克隆形成的作用;C:干扰miR-4319表达逆转了抑制lncRNA DNAJC3-AS1表达对A431细胞划痕愈合率的作用;D:干扰miR-4319表达逆转了抑制lncRNA DNAJC3-AS1表达对A431细胞侵袭的作用。图5 干扰miR-4319表达逆转了抑制lncRNA DNAJC3-AS1表达对A431细胞增殖、迁移和侵袭的作用

表6 干扰miR-4319表达逆转了抑制lncRNA DNAJC3-AS1表达对A431细胞增殖、迁移和侵袭的作用
3 讨论
既往研究表明CSCC组织中lncRNA表达水平与正常组织比较明显升高或降低,lncRNA的差异表达与CSCC细胞过度增殖、凋亡抵抗、侵袭转移等恶性转化基本特征相关,可作为CSCC的诊断新型标记物和治疗靶点[9-10]。本研究结果显示,CSCC组织中DNAJC3-AS1的表达与癌旁组织比较显著增加,提示DNAJC3-AS1表达改变可能与CSCC相关。已有研究显示,DNAJC3-AS1高表达预示结直肠癌患者预后不良,DNAJC3-AS1通过表皮生长因子受体(EGFR)通路调控脂肪酸合酶能够促进结直肠癌进展[11]。DNAJC3-AS1在透明肾细胞癌中表达上调,沉默DNAJC3-AS1可减少可抑制透明肾细胞癌细胞增殖和侵袭并诱导细胞凋亡[12]。然而,DNAJC3-AS1对CSCC细胞功能的影响还有待证实。转染si-DNAJC3-AS1抑制DNAJC3-AS1表达后A431细胞活力显著降低,克隆形成、迁移和侵袭能力明显下降,这表明DNAJC3-AS1可能是正向调控CSCC细胞增殖、迁移和侵袭的关键因子,具有致癌基因功能。上皮-间质转化(EMT)是CSCC进展的一个重要过程,其意味着细胞极性、间隙连接和黏附连接丢失,获得间充质样表型,从而具有更强的迁移和侵袭能力[13]。Han等[14]报道下调DNAJC3-AS1表达能够抑制结肠癌细胞的EMT、迁移和侵袭。与上述结果类似,本研究发现抑制DNAJC3-AS1表达可抑制间质表型分子N-cadherin表达,促进上皮表型分子E-cadherin表达,表明抑制DNAJC3-AS1表达可能通过抑制EMT进而抑制CSCC细胞迁移和侵袭。
lncRNA对miRNA的调控是其在肿瘤中发挥功能的重要机制,例如DNAJC3-AS1通过与miR-144结合促进乳腺癌细胞增殖和顺铂耐药[15]。本研究证实miR-4319是DNAJC3-AS1的直接靶点,提示DNAJC3-AS1可能靶向miR-4319调控CSCC进展。先前研究表明miR-4319在甲状腺癌、三阴性乳腺癌中表现出抑癌功能[16-17]。miR-4319低表达与肝癌肿瘤大小和静脉侵犯相关,miR-4319靶向叉头框蛋白Q1(FOXQ1)可抑制肝癌细胞增殖,抑制EMT,抑制肝癌干细胞特性[18]。miR-4319可加速非小细胞肺癌细胞凋亡,抑制肿瘤生长[19]。沉默环状RNA ATXN7(circATXN7)可上调miR-4319表达,抑制胃癌细胞的增殖和侵袭,促进胃癌细胞凋亡[20]。此外,miR-4319分别作为TNK2反义RNA1(TNK2-AS1)、LINC00667的下游靶点参与调控骨肉瘤和鼻咽癌细胞的恶性表型[21-22]。本研究表明CSCC组织中miR-4319的表达与癌旁组织比较显著降低,miR-4319和DNAJC3-AS1表达呈负相关关系。过表达miR-4319可促进N-cadherin表达,降低A431细胞活力和N-cadherin表达水平,抑制克隆形成、迁移和侵袭能力,表明miR-4319在CSCC中发挥抑癌功能。抑制DNAJC3-AS1表达和过表达miR-4319的抗癌作用类似,且miR-4319表达受到DNAJC3-AS1负性调控,提示CSCC中可能存在DNAJC3-AS1/miR-4319分子轴。干扰miR-4319表达显著减弱抑制DNAJC3-AS1表达对A431细胞生物学行为的影响,表明DNAJC3-AS1通过靶向miR-4319调控CSCC细胞生物学行为。然而,本研究仅进行了体外实验,尚需开展体内实验进一步验证DNAJC3-AS1/miR-4319分子轴的作用。
综上所述,CSCC组织中DNAJC3-AS1表达上调,miR-4319表达下调。抑制DNAJC3-AS1通过靶向上调miR-431表达可抑制CSCC细胞A431增殖、迁移和侵袭。因此,靶向抑制DNAJC3-AS1/miR-4319分子轴可能成为抑制CSCC进展的潜在策略。

