水飞蓟宾对结直肠癌细胞DNA损伤应答的影响
梁国军,闫志鑫,唐钰梅,任来峰,薛耀勤
(1.山西中医药大学 第三临床学院,山西 晋中 030619;2.山西省肿瘤医院,中国医学科学院肿瘤医院山西医院,山西医科大学附属肿瘤医院 介入科,山西 太原 030000;3.山西省肿瘤医院,中国医学科学院肿瘤医院山西医院,山西医科大学附属肿瘤医院 免疫室,山西 太原 030000)
结直肠癌是消化道常见恶性肿瘤,据2020年全球癌症统计数据显示,结直肠癌发病率和死亡率分别位居第三和第二,且呈逐年上升趋势[1-2]。结直肠癌早期并无明显症状,大多数病人在确诊时病情已发展至中晚期,此时无论是治疗还是预后情况都十分不理想。就目前而言,直肠癌的治疗手段仍旧有限,主要以外科手术为主,辅以放化疗、免疫治疗、分子靶向治疗、全身系统治疗、局部治疗、中医辅助治疗等疗法,然其治疗效果却远不能满足人们的期望,其中治疗的耐药性和复发转移一直是阻碍癌症治疗的最大障碍[3-7]。因此,探寻新的治疗药物和方法一直都是研究人员研究的热点。
中医药有着悠久的历史传承,同时在癌症的治疗中也一直发挥着它独特的优势。相比于普通放化疗,中医药治疗的副作用较小,同时它还可以与其他治疗方法相结合,在治疗的过程中除了其本身直接的抗癌作用外,还有着增效减毒、调养身体的作用,对治疗的效果和生存预后都有着明显的提升[8-9]。水飞蓟宾(silibinin)是中药水飞蓟中提取出的一种天然植物多酚(一种黄酮类木脂素),具有以下生化特征:分子式C25H22O10,摩尔质量:482.44 g/mol,沸点793°C,具有极高的抗氧化和抗癌性能。水飞蓟宾的抗癌作用由多种细胞途径决定,包括诱导细胞凋亡、细胞周期停滞、抑制血管生成和转移等;此外,水飞蓟宾还控制异常miRNAs表达的调节、炎症反应以及与放化疗药物的协同作用[10-11]。同时初步实验发现,水飞蓟宾可使结直肠癌细胞发生DNA损伤。鉴于此,本研究拟探讨水飞蓟宾对结直肠癌细胞的抑制作用,并初步探讨其机制。
1 材料与方法
1.1 材料 人结直肠癌HCT116和HT29细胞株购自湖南丰晖生物公司。水飞蓟宾(批号:B21185,质量分数≥98%)购自上海源叶生物科技有限公司;二甲基亚砜(Dimethyl sulfoxide,DMSO)、McCoy's 5A培养基、青-链霉素溶液及胰蛋白酶购自武汉博士德生物工程有限公司,DAPI染液购自德国 Vector公司;CCK-8(HY-K0301)试剂盒购自美国MCE公司;抗α-Tubulin抗体、胎牛血清购自美国SIGMA公司; Phospho-Chk2、Aurora A、Cyclin B1、p21 Waf1/Cip1、HRP标记的山羊抗鼠/兔IgG二抗均购自美国CST公司。
1.2 细胞培养 将HCT116和HT29细胞培养在含有10%胎牛血清和1%青-链双抗的McCoy's 5A培养基中,置于37℃、5% CO2恒温培养箱(美国Thermo公司)中培养,1~2 d更换培养基1次,取对数生长期细胞用于实验。
1.3 cck8法检测水飞蓟宾对结直肠癌细胞增殖的影响 HCT116和HT29细胞分别以1×105个/mL接种于96孔板,100 μL/孔;培养24 h后,分别加入12.5、25、50、100、200 μg/mL的水飞蓟宾处理细胞(水飞蓟宾溶于DMSO配制成100 mg/mL的溶液,以含10%胎牛血清的McCoy's 5A培养基稀释至所需浓度,使DMSO最终浓度<0.5%),每组设置5个平行孔,同时设置对照组(加入不含药物的培养基)。培养48 h后每孔加入10 μL的CCK-8溶液,孵育4 h后,用酶标仪(奥地利Tecan公司)测定 450 nm处的吸光度(OD)值。细胞存活率(%)=实验组平均OD值/空白对照组平均OD值×100%。
1.4 IF法检测相关蛋白的表达 取对数生长期的HCT116和HT29细胞,以2×104个/mL接种于6孔板中的爬片,加入水飞蓟宾100 μg/mL分别处理6、24 h后(同时设空白对照组),弃掉培养基,PBS清洗1次,以4%多聚甲醛固定,加入0.3% Triton通透10 min,封闭液封闭30 min。一抗孵育40 min,PBS清洗,荧光素标记的二抗孵育25 min,PBS清洗, DAPI染液封片,用指甲油固定爬片,避光保存,使用荧光显微镜(日本Olympus公司)观察细胞染色情况。
1.5 流式细胞术检测细胞周期 取对数生长期的HCT116细胞,以1×105个/mL接种于6孔板,2 mL/孔,培养24 h。分别给予水飞蓟宾(0、25、50、100 μg/mL)处理细胞48 h后,收集细胞,PBS清洗,消化、1 000 r/min离心5 min,收集细胞沉淀,弃上清,用预冷PBS洗涤2次,加入冰75 %乙醇,于4 ℃固定4 h以上。细胞染色:1 000 r/min离心5 min,弃上清,以3 mL的PBS洗涤1次,加入400 μL溴化乙锭(PI,50 μg/mL),100 μL RNaseA(100 μg/mL ),4 ℃避光孵育20 min。流式细胞仪(美国ACEA艾森公司)检测,上机前要以50 um尼龙网膜或35 μm细胞过滤器过滤细胞,因为PI具有很强的粘附性,容易使细胞聚团。
1.6 Western blotting检测DNA损伤、细胞周期相关蛋白 将细胞接种于6孔板,24 h后,分别给予水飞蓟宾(0、25、50、100 μg/mL)处理细胞;给药48 h后,吸去原有培养基,PBS洗涤,加入含磷酸酶抑制剂的细胞裂解液,冰上裂解,之后将细胞溶液离心取上清,用BCA法进行蛋白含量检测。蛋白定量后,加入SDS上样缓冲液并煮沸10 min,样品置于-20 ℃保存。用SDS-PAGE分离胶电泳分离蛋白条带,转膜,5%的脱脂奶粉室温封闭1 h,4 ℃下一抗孵育过夜,TBST洗膜。HRP标记的二抗在室温下孵育1 h,TBST洗膜,加化学发光液后用凝胶成像仪(广州博鹭腾)分析结果。

2 结果
2.1 水飞蓟宾对HCT116、HT29细胞生长状态和细胞活力的影响 给药48 h后,在HCT116和HT29细胞中,与空白对照组相比,给药组随着给药浓度的增高,对细胞的作用愈加明显。在12.5、25 μg/mL时,细胞状态无明显变化,药物对细胞仅产生轻微的抑制作用,形态和大小正常;50 μg/mL时,抑制作用显著,增殖缓慢,细胞死亡率在70%以上,细胞形态发生改变,形态不一;100 μg/mL 时,细胞死亡率在90%以上,细胞失去原有形态;200 μg/mL时,细胞完全死亡(图1A、1B)。在细胞活力检测中,与空白对照组相比,各加药组对 HCT116 和HT29细胞活力在作用48 h 后均受到显著抑制,且呈剂量依赖性,差异有统计学意义(图1C、1D)。
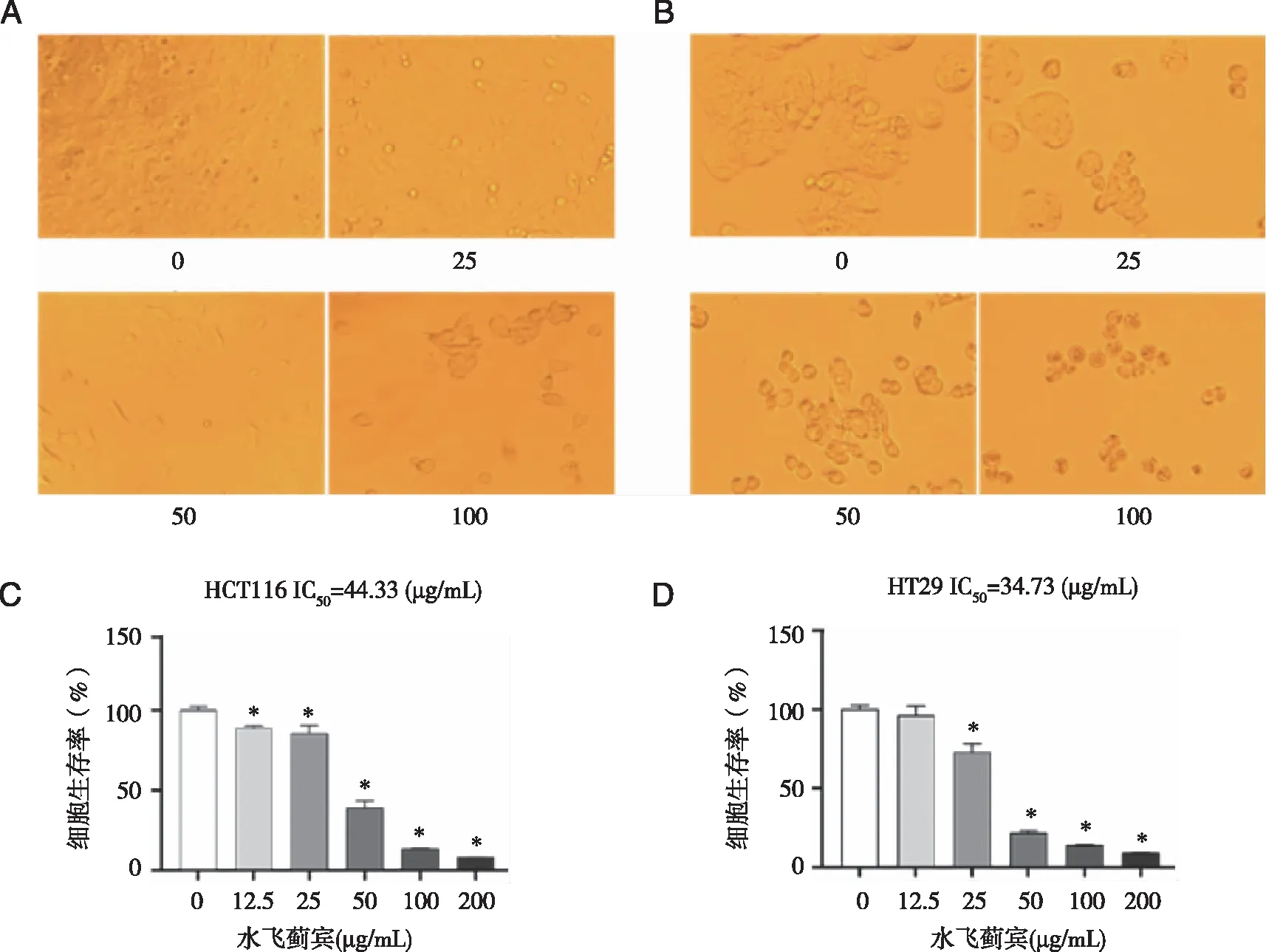
A:不同药物浓度(μg/mL)下HCT116细胞的生长状态;B:不同药物浓度下HT29细胞的生长状态;C:不同药物浓度下HCT116细胞的活力变化;D:不同药物浓度下HT29细胞的活力变化。*:与空白对照组比较,P<0.05;200×。图1 水飞蓟宾对结直肠癌细胞HCT116、HT29生长状态和细胞活力的影响
2.2 水飞蓟宾对结直肠癌细胞 HCT116和HT29细胞的DNA损伤作用 免疫荧光结果显示,与空白对照组相比,加药 (100 μg/mL) 处理后,γ-H2Ax的表达显著升高,表明此时细胞DNA发生明显的损伤。且在药物作用24 h与药物作用6 h的比较中,作用24 h的细胞发生DNA损伤的数量比例和单个细胞的DNA损伤程度均显著高与作用6 h,表现出作用时间的依赖性(P<0.05,图2)。
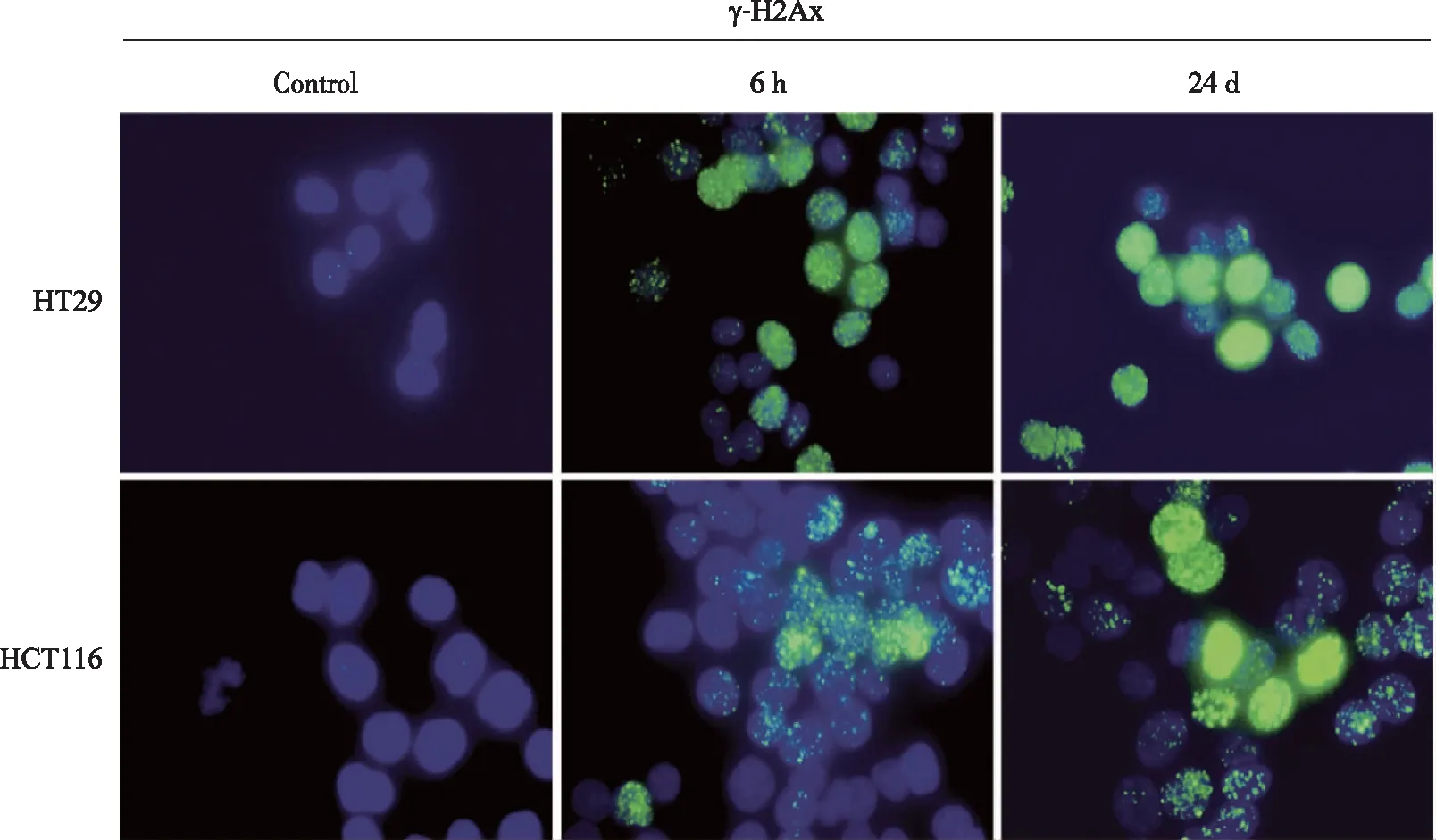
蓝色DAPI,绿色γ-H2Ax;1 000×。图2 水飞蓟宾对结直肠癌细胞 HCT116和HT29的DNA损伤作用
免疫印迹实验结果显示,与空白对照组相比,细胞加药处理(25、50、100 μg/mL)培养2 d后,γ-H2Ax的表达显著升高,细胞DNA受损,且损伤程度随着药物浓度的增加而升高,表现出药物浓度的依赖性(P<0.05,图3)。
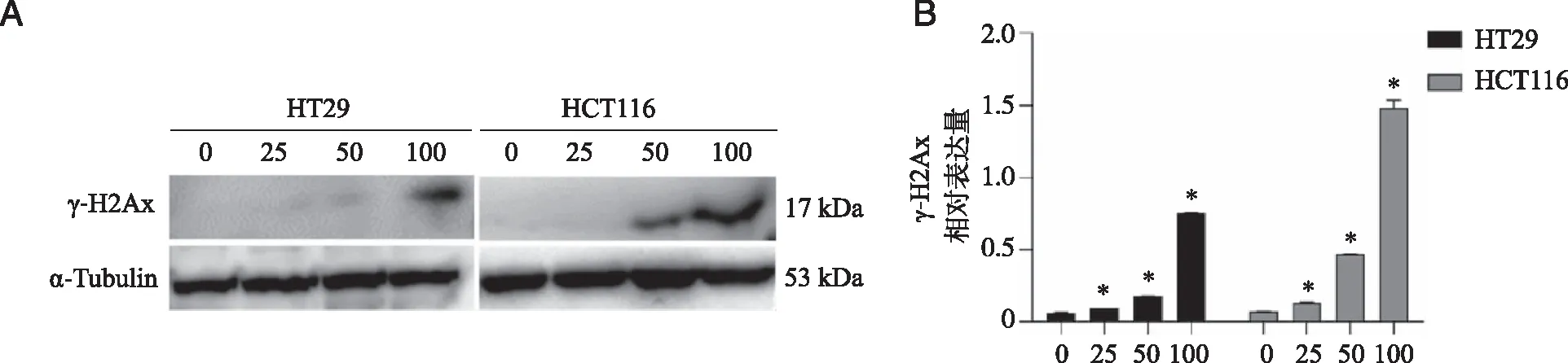
A:γ-H2Ax 免疫印迹实验结果; B: 免疫印迹实验结果统计分析;*:与对照组相比,P<0.05。图3 水飞蓟宾对结直肠癌细胞 HCT116和HT29的DNA损伤作用
2.3 水飞蓟宾对结直肠癌细胞周期的影响
2.3.1 IF法检测细胞周期相关蛋白的表达情况 免疫荧光检测结果显示,在HCT116和HT29细胞中,与对照组相比较,经加药处理6 h和24 h后,细胞周期蛋白CyclinB1在细胞中的表达明显下调,呈且随着作用时间的延长其表达逐渐降低(P<0.05,图4A、B)。在HCT116细胞中,p21和P-Chk2的表达明显上调,表现出作用时间的依赖性;Aurora A在细胞中的表达明显下调,随着作用时间的延长其表达逐渐降低(P<0.05,图4C、D)。
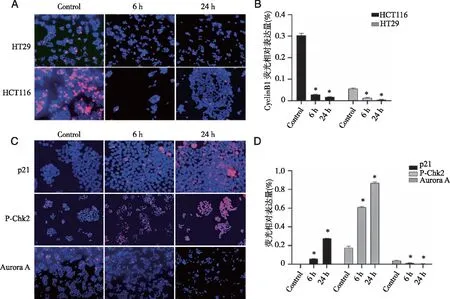
A:细胞周期蛋白CyclinB1在HCT116和HT29细胞中的表达情况(200×);B:CyclinB1荧光结果统计分析; C:p21、P-Chk2和Aurora A在HCT116细胞中的表达情况; D:p21、P-Chk2和Aurora A荧光结果统计分析(p21 400×,P-Chk2和Aurora A,200×)。*:与对照组相比;P<0.05。图4 IF法检测细胞周期相关蛋白的表达情况
2.3.2 WB 法检测细胞周期相关蛋白的表达情况 免疫印迹法检测细胞周期相关蛋白表达情况,与空白对照组相比,CyclinB1的表达随着药物浓度的增高明显下调,p21的表达随着药物浓度的增加而上调(P<0.05,图5)。
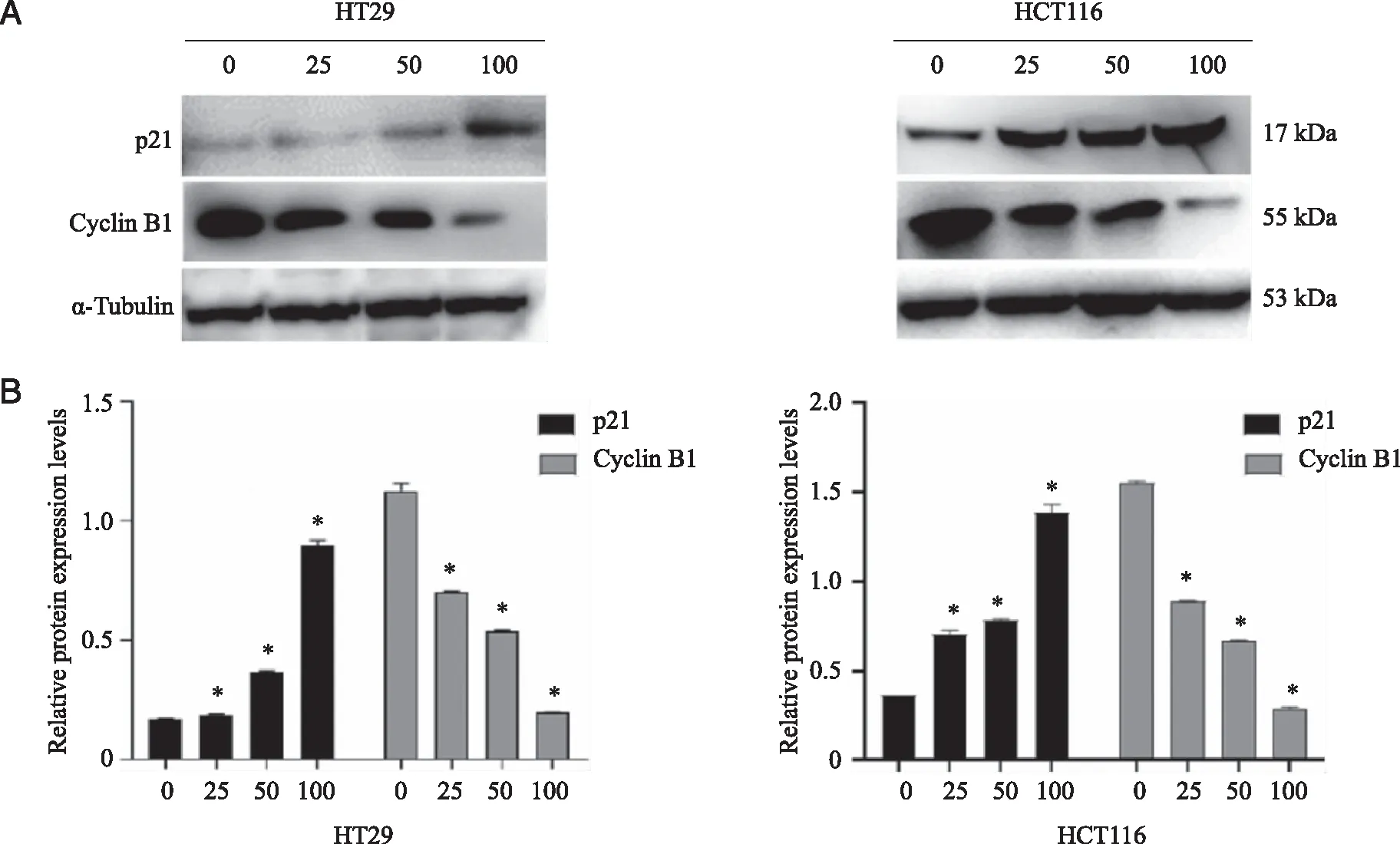
A:各给药组(μg/mL)细胞周期相关蛋白的表达;B:免疫印迹结果统计分析;*:与对照组相比,P<0.05。图5 WB法检测细胞周期相关蛋白的表达
2.3.3 流式细胞术检测细胞周期分布 在各组细胞周期分布比较中,药物作用48 h,各组细胞G2期比例组间比较,差异有统计学意义(P<0.05);与对照组相比,25 μg/mL剂量组、50 μg/mL剂量组和100 μg/mL剂量组G2期细胞比例增加,并且呈现出剂量依赖效应(P<0.05),详见表1、图6。

表1 各组细胞周期分布比较

A、B、C、D:不同药物浓度分组,0、25、50、100 μg / mL。图6 流式细胞术检测细胞周期分布
3 讨论
结直肠癌是消化道常见的恶性肿瘤,严重威胁着结直肠癌患者的生存和预后。因此,寻找更加高效的治疗方法已是迫在眉睫。近年来,中医药在癌症的治疗中发挥的作用愈加突出,且中药药食同源,其副作用较低甚至是无毒副作用[12]。随着现代分子生物学技术的发展,利用中医基础理论和中药基本功效,通过单味中药、中药复方制剂、中药有效成分提取物来探索新的治疗方法已取得较大的成果,诸多中药及其有效成分在癌症的治疗中发挥着重要作用,是癌症治疗的热门领域。而水飞蓟宾则有望成为一种新的化疗药物之一。
水飞蓟宾具有广谱的抗癌作用,通过在多种细胞和分子途径调节多种细胞功能,包括抑制生长、细胞周期停滞、抗增殖和诱导细胞凋亡等,可作为抗癌和化学预防药物应用于癌症的预防或治疗,目前已有大量关于水飞蓟素体内外不同抗癌作用的报道。许多实验研究表明,水飞蓟宾可以延缓不同部位的恶性肿瘤的进展,如乳腺癌、前列腺癌、肺癌、结直肠癌、胰腺癌以及肝癌等。大量的体外和体内工作强调了水飞蓟宾在靶向多个细胞分子和影响不同的信号转导途径中的多效性抗癌作用,最终导致抑制细胞周期进展和增殖、促进凋亡死亡以及抑制血管生成和转移过程[10,13]。同时,有研究表明,水飞蓟宾在癌症中的治疗和化学预防作用与DNA损伤密切相关,在正常细胞中,水飞蓟宾对DNA损伤起着保护作用从而预防癌变,例如在人血细胞中,水飞蓟宾具有抗遗传毒性作用,调节与细胞DNA损伤保护相关的基因表达,并显著下调Bax的表达,从而发挥阻止细胞凋亡和化学保护剂的作用[14];在非黑色素瘤皮肤癌中,水飞蓟宾通过介导P53延长细胞周期,修复紫外线诱导的DNA损伤,减少非黑色素瘤皮肤癌的发病率[15]。在癌组织中,水飞蓟宾对DNA损伤起着增敏和抑制修复的作用,从而发挥其抗癌活性,在前列腺癌中,水飞蓟宾可以对放射治疗起着增敏的作用,从而加强疗效,这一疗法目前已进入临床试验阶段[16]。
基因组不稳定性是癌细胞最普遍的特征之一。癌细胞相对于正常细胞具有DNA修复缺陷,癌细胞在受到DNA损伤时,细胞周期受到干扰,从而进入DNA修复过程;当DNA损伤超过其修复能力,癌细胞则会诱发死亡[17]。基于DNA损伤的死亡反应可分为两类:一是因损伤修复失败而死亡,另一个则是因为高水平的DNA损伤导致的细胞死亡[18-19]。放化疗治疗癌症也是基于DNA损伤,通过DNA损伤反应(DDR)而导致细胞衰老或死亡。γ-H2AX 在DNA损伤中的特异性可作为评估 DNA 损伤、相关的 DNA 损伤蛋白和 DNA 修复的水平。H2AX 是 H2A 蛋白家族的变体,是核小体中组蛋白八聚体的组成部分。H2AX在其C末端的尾巴上含有一个丝氨酸,在细胞经过电离辐射[20]或细胞毒剂等诱导后,H2AX 被 PI3K 通路中的共济失调毛细血管扩张症突变 (ATM) 和 ATM-Rad3 相关 (ATR) 等激酶磷酸化,迅速形成γ-H2AX 病灶[21-22]。γ-H2AX是DNA损伤反应中最早的标志之一,每一个病灶都代表着一个DNA双链断裂,在DNA损伤的感知和修复中起着关键作用。在本实验研究中,发现水飞蓟宾对结直肠癌细胞HCT116和HT29产生明显的抑制作用,诱导细胞发生DNA损伤反应,最终导致细胞增殖受限和死亡。在实验中,随着药物浓度的增加和药物作用时间的延长,DNA损伤蛋白γ-H2AX的表达上调,表现出药物浓度和作用时间的依赖性。
G2/有丝分裂特异性细胞周期蛋白-B1(Cyclin B1) 对于控制 G2/M(有丝分裂)过渡的细胞周期至关重要, Cyclin B1与细胞周期蛋白依赖性激酶1(CDK1)结合并磷酸化CDK1 Thr160/Thr161形成异源二聚体CCNB1/CDK1,即细胞成熟促进因子(MPF),从而促进细胞从G2期进入M期,确保细胞有丝分裂正常进行[23]。 Aurora A (AIK) 是一个细胞周期调控丝氨酸/苏氨酸蛋白激酶,在有丝分裂过程中中心体和纺锤体等事件中发挥着关键作用,在多种癌细胞系中过表达 。Aurora-A 在 Cdc2-cyclin B 下游被激活,并在有丝分裂进程和 G2 检查点控制中起关键作用。同时有研究表明,DNA 损伤抑制了 G2/M 过渡时的 Aurora-A 激活,进而导致细胞周期阻滞[24-25]。丝氨酸/苏氨酸蛋白激酶 Chk2,是介导的细胞周期停滞、激活 DNA 修复和响应 DNA 双链断裂细胞凋亡的关键蛋白。在DNA损伤后,通过磷酸化 CDC25A、CDC25B 和 CDC25C 来调节细胞周期检查点停滞,从而抑制它们的活性,进而影响细胞周期进程[26-27]。细胞周期蛋白依赖性激酶(CDK)抑制剂p21是在细胞周期进程中起到抑制作用的一种蛋白,发生DNA损伤后活化,在控制细胞周期进程和 DNA 损伤诱导的 G2 期阻滞中发挥重要作用,同时可能参与细胞凋亡,可能参与 p53/TP53 介导的细胞增殖抑制,以响应 DNA 损伤[28-29]。本研究中,WB和IF 实验结果表明,水飞蓟宾处理后的结直肠癌细胞内,Cyclin B1和Aurora-A 蛋白的表达随着作用时间和药物浓度的增加而表达下调,p-chk2和p-21蛋白的表达随着作用时间和药物浓度的增加而上调,这可能与水飞蓟宾将结直肠癌细胞阻滞于G2/M期有关。
综上所述, 水飞蓟宾对结直肠癌细胞HCT116和HT29具有明显的抗癌活性,其机制可能是通过对细胞的DNA损伤反应,阻滞细胞周期,促进细胞的凋亡,从而抑制结直肠癌细胞的增殖。本实验研究为治疗结直肠癌新药的研发提供了新的思路,丰富了水飞蓟宾治疗结直肠癌的理论成果。

