透明质酸合成酶2通过调控TGF-β/SMAD4信号通路对肾细胞癌发生发展的影响
刘 军,冉 灿,曾定胜,奉友刚
(遂宁市中心医院 泌尿外科,四川 遂宁 629000)
肾细胞癌(renal cell carcinoma,RCC)约占恶性疾病的3%,是泌尿系统恶性肿瘤相关死亡的第二大原因[1]。由于RCC发病机制不明,临床表现无特异性,早期诊断困难,肿瘤转移风险高[2]。到目前为止,手术切除仍然是唯一的治疗方法。对于晚期肾细胞癌患者,使用干扰素-α、IL-2、舒尼替尼和索拉非尼等药物进行全身免疫调节治疗具有一定的疗效。但是,肿瘤对这些药物的长期反应性较差,患者的存活率仅略有提高[3]。尽管在对该病的认识、诊断和治疗方面取得了显著的进展,但肾细胞癌患者的预后仍不令人满意。因此,仍需开发具有更好功效的新药,同时了解RCC肿瘤发生的机制将有助于药物的开发。透明质酸(hyaluronic acid,HA)是细胞外基质的重要组成成分,其调节组织硬度,维持基质稳态,并在许多类型的细胞中充当信号传导成分[4]。HA的生物合成受3种HA合成酶(HAS1、HAS2和HAS3)调节,其中透明质酸合成酶2(hyaluronic acid synthase 2,HAS2)途径是调控细胞恶性行为的主要信号通路[5-6]。HAS2先前已被证明在多种恶性肿瘤组织中表达上调,并且在肿瘤的进展和转移中起重要作用。例如,在乳腺癌细胞中,过表达HAS2可显著促进细胞迁移和侵袭能力[7]。HAS2在胰腺癌组织和细胞中显著上调,HAS2过表达可能是胰腺癌预后的重要标志[8]。HAS2表达升高与浸润性星形细胞瘤患者总生存期降低相关,是其独立预后因素[9]。然而,HAS2在RCC中的作用尚未见报道。因此,本研究将探讨HAS2在RCC细胞发生发展中的作用及其相关机制,为RCC的诊断和治疗提供生物标志物和潜在靶标。
1 材料与方法
1.1 试剂和仪器 人肾小管上皮细胞HK-2和RCC细胞系A498、786-O、Caki-1购自中国科学院细胞库;细胞计数试剂盒-8(CCK-8)购自上海翌圣生物科技有限公司;Annexin V-FITC/PI细胞凋亡双染试剂盒购自北京利维宁生物科技有限公司;Trizol试剂购自美国Invitrogen公司;逆转录试剂盒购自日本TaKaRa公司;SYBR Green PCR Master试剂盒购自北京索莱宝科技有限公司;上皮钙黏附素(epithelial cadherin,E-cadherin)、神经型钙黏蛋白(neural cadherin,N-cadherin)、波形蛋白(vimentin)、B细胞淋巴瘤/白血病-2(B-cell lymphoma/Leukemia-2,Bcl-2)、Bcl-2相关X蛋白基因(Bcl-2 associated X protein,Bax)、天冬氨酸特异性半胱氨酸蛋白酶(cysteine-containing,aspartate-specific proteases-3,caspase-3)、转化生长因子-β1(transforming growth factor-beta1,TGF-β1)、p-SMAD4抗体购自美国Cell Signaling Technology公司;NC-siRNA、HAS2-siRNA购自上海吉玛制药技术有限公司。流式细胞仪购自德国Partec公司;多功能酶标仪购自美国Thermo Fisher Scientific公司;实时荧光定量PCR仪购自广州誉维生物科技仪器有限公司。
1.2 方法
1.2.1 临床标本 所有涉及到人体标本的方案均经过我院伦理审查委员会批准,批准号为LLSLH2022076。所有参与者均已获得书面知情同意。收集我院从2019年8月至2021年7月收治的RCC患者接受手术切除的30例RCC组织(RCC组)和30例癌旁组织(normal tissues adjacent to the tumour, NAT组)。所有组织标本经病理检查确诊为RCC。在RCC患者中,男性21例,女性9例,年龄21~76岁,平均年龄(54.31±8.14)岁,RCC患者在手术前均未接受任何其他治疗。肾癌的临床分期:Ⅰ期:20例;Ⅱ期:4例;Ⅲ期:3例;Ⅳ期:3例。所有组织标本在切除后立即在液氮中快速冷冻,然后保存在-80°C冰箱用于后续实验。
1.2.2 细胞培养与转染 人肾小管上皮细胞HK-2、RCC细胞系A498、786-O和Caki-1分别在RPMI-1640培养基(含有终浓度为10%FBS、100 U/mL青霉素和100 mg/mL链霉素)在37 ℃、5%CO2的细胞培养箱中培养。每隔1 d更换培养基。将细胞接种到6孔板中,待细胞融合度达到80%,使用Lipofectamine 2000转染试剂将NC-siRNA、HAS2-siRNA转染至细胞中继续培养,48 h后收集细胞进行接下来的实验。
1.2.3 实时荧光定量PCR(RT-qPCR)检测 使用Trizol试剂提取细胞中的总RNA。根据制造商的说明,使用TaKaRa逆转录试剂盒将1 μg总RNA逆转录为cDNA。使用SYBR Green PCR Master试剂盒在ABI 7500 Fast系统中进行PCR实验。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,使用2-ΔΔCT方法分析目的基因的相对表达量。引物系列如下:HAS2,上游:5′-TGAACAAAACAGTTGCCCTTT-3′,下游:5′-TTCCCATCTATGACCATGACAA-3′。GAPDH,上游:5′-GCCAAGGTCATCCATGACAACTTTGG-3′,下游:5′-GCCTGCTTCACCACCTTCTTGATGTC-3′。
1.2.4 蛋白免疫印迹检测 用含蛋白酶抑制剂的裂解缓冲液孵育制备细胞裂解液。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离细胞裂解液中的蛋白质,并将其转移到聚偏二氟乙烯膜上。将膜在5%脱脂牛奶中封闭2 h,与一抗在4 ℃下孵育过夜。PBS洗涤3次后,将膜与二抗孵育1 h。使用增强型化学发光试剂盒检测免疫反应条带,并使用Image J软件进行定量分析。
1.2.5 细胞活力测定 根据制造商的说明,使用CCK-8试剂盒检测肾细胞癌细胞的活力。将1×104个细胞接种到96孔板中,然后每孔加入10 μL CCK-8溶液,在细胞培养箱中孵育2 h。随后,使用酶标仪在450 nm处测量吸光度。
1.2.6 流式细胞术 使用Annexin V/PI试剂盒检测肾细胞癌细胞的凋亡情况。将转染后的细胞置于6孔板中,每孔含1×106个细胞,将细胞悬浮在1 mL的结合缓冲液中。再孵育24 h后,将细胞与FITC-Annexin V和PI在常温下避光孵育15 min。最后使用流式细胞仪和FACSDiva软件对细胞进行评估。
1.2.7 细胞划痕实验 肾细胞癌细胞接种于6孔板,每孔2×105个细胞。然后,使用10 μL移液管尖端在融合的单层细胞上形成创口,并用PBS洗涤细胞碎片和悬浮细胞。随后,单层细胞在新鲜培养基中孵育24 h,通过“伤口愈合”速率测量细胞迁移。在特定时间点(0、24 h)在光学显微镜下对6孔板进行拍照,并使用Image J软件计算伤口愈合面积。
2 结果
2.1 HAS2在RCC组织和细胞中的表达 结果显示,与NAT组的癌旁组织比较,RCC组织中HAS2 mRNA和蛋白水平均显著升高(P<0.05);与人肾小管上皮细胞HK-2比较,RCC细胞系A498、786-O和Caki-1中HAS2 mRNA和蛋白水平均显著升高(P<0.05),且在786-O细胞中表达最高。因此,本研究选择786-O细胞用于后续实验(图1)。
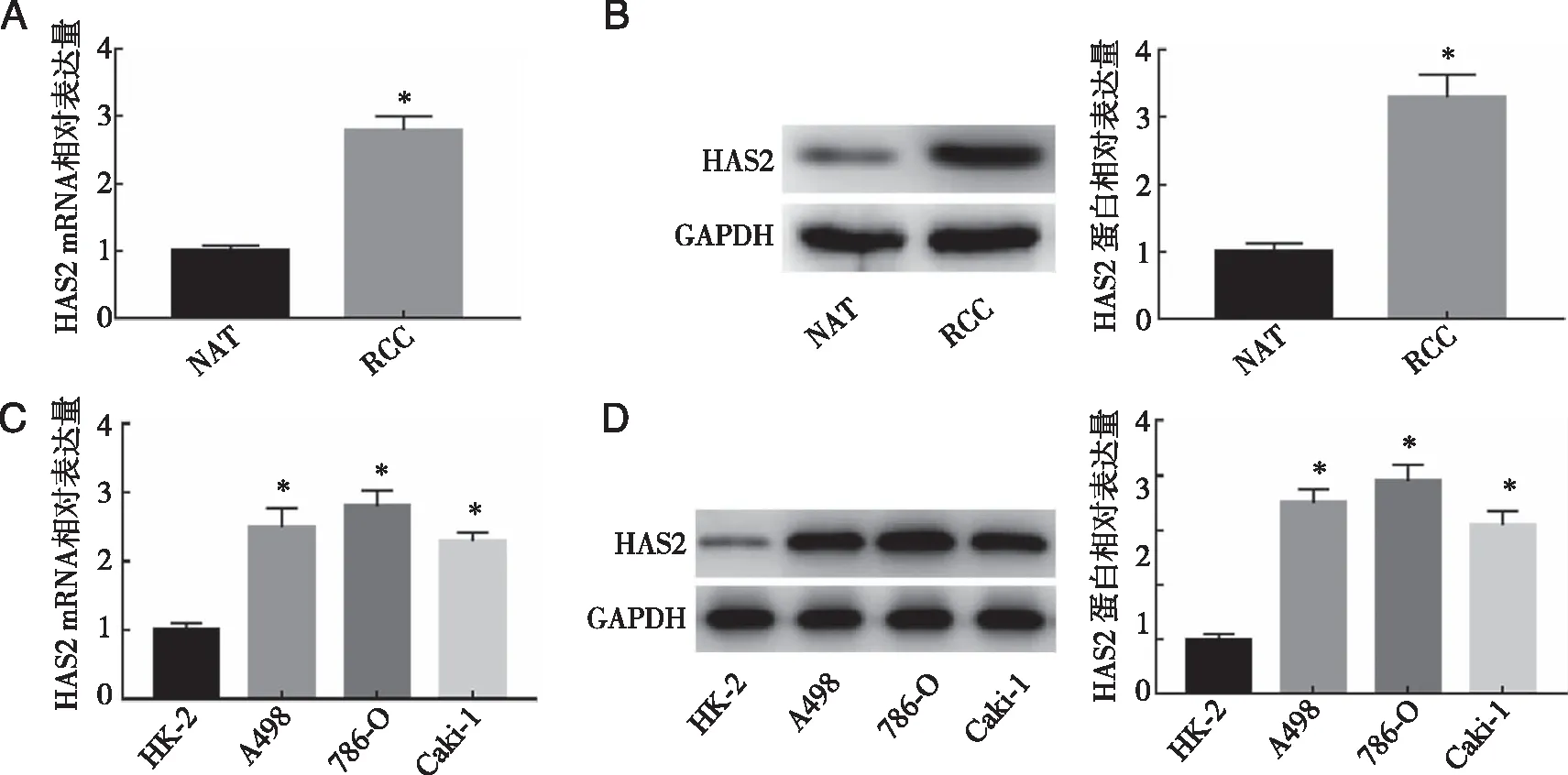
A: RT-qPCR实验检测RCC组织中的HAS2 mRNA表达水平;B: Western blot检测RCC组织中HAS2蛋白表达水平;C: RT-qPCR实验检测RCC细胞中的HAS2 mRNA表达水平;D: Western blot检测RCC细胞中HAS2蛋白表达水平。*:与NAT组和HK-2组比较, P<0.05。图1 HAS2在RCC组织和细胞中的表达
2.2 沉默HAS2对RCC细胞增殖的影响 结果显示,与Control组比较,HAS2-siRNA组细胞中HAS2 mRNA水平显著降低,细胞增殖能力显著降低,差异均具有统计学意义(P<0.05);NC-siRNA组与Control组比较差异无统计学意义(P>0.05,图2)。

A:RT-qPCR实验检测细胞中的HAS2 mRNA表达水平;B:CCK-8实验检测细胞增殖;*:与Control组比较,P<0.05。图2 沉默HAS2对RCC细胞增殖的影响
2.3 沉默HAS2对RCC细胞迁移的影响 细胞划痕实验结果显示,与Control组比较,HAS2-siRNA组细胞迁移能力显著降低(P<0.05);NC-siRNA组与Control组比较差异无统计学意义(P>0.05,图3)。
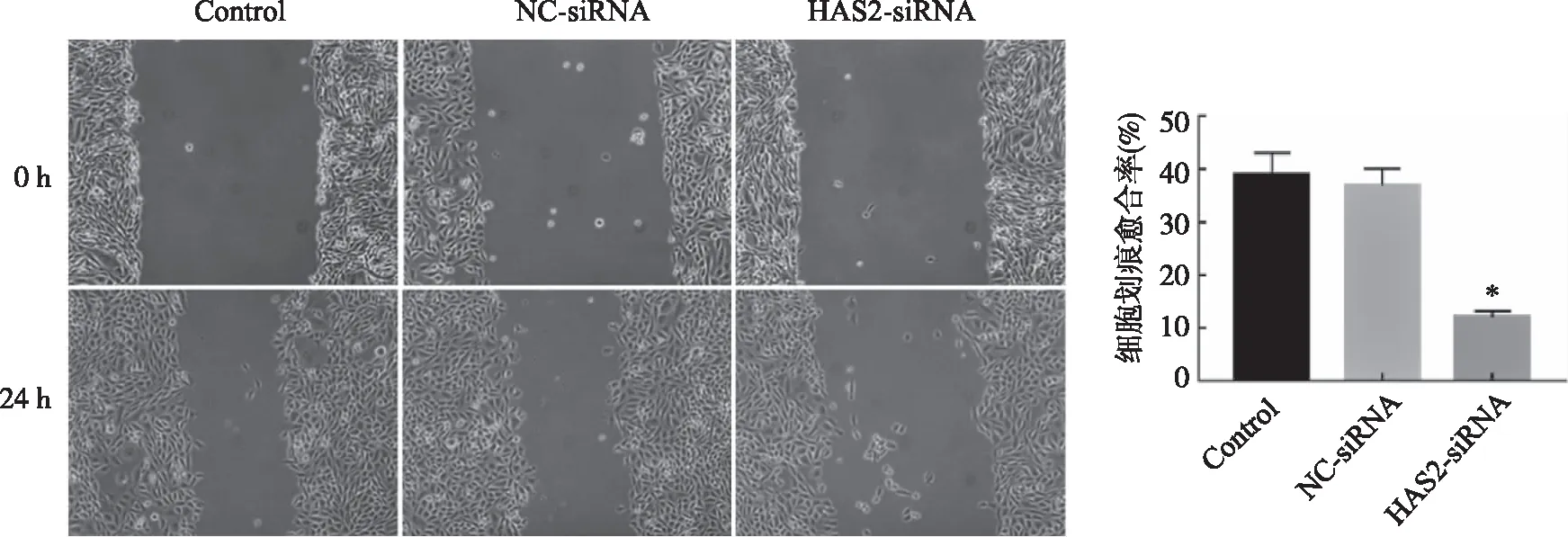
*:与Control组比较,P<0.05。图3 沉默HAS2对RCC细胞迁移的影响
2.4 沉默HAS2对RCC细胞EMT的影响 结果显示,与Control组比较,HAS2-siRNA组细胞中E-cadherin蛋白水平显著升高,N-cadherin和Vimentin蛋白水平显著降低,差异均具有统计学意义(P<0.05);NC-siRNA组与Control组比较差异无统计学意义(P>0.05,图4)。
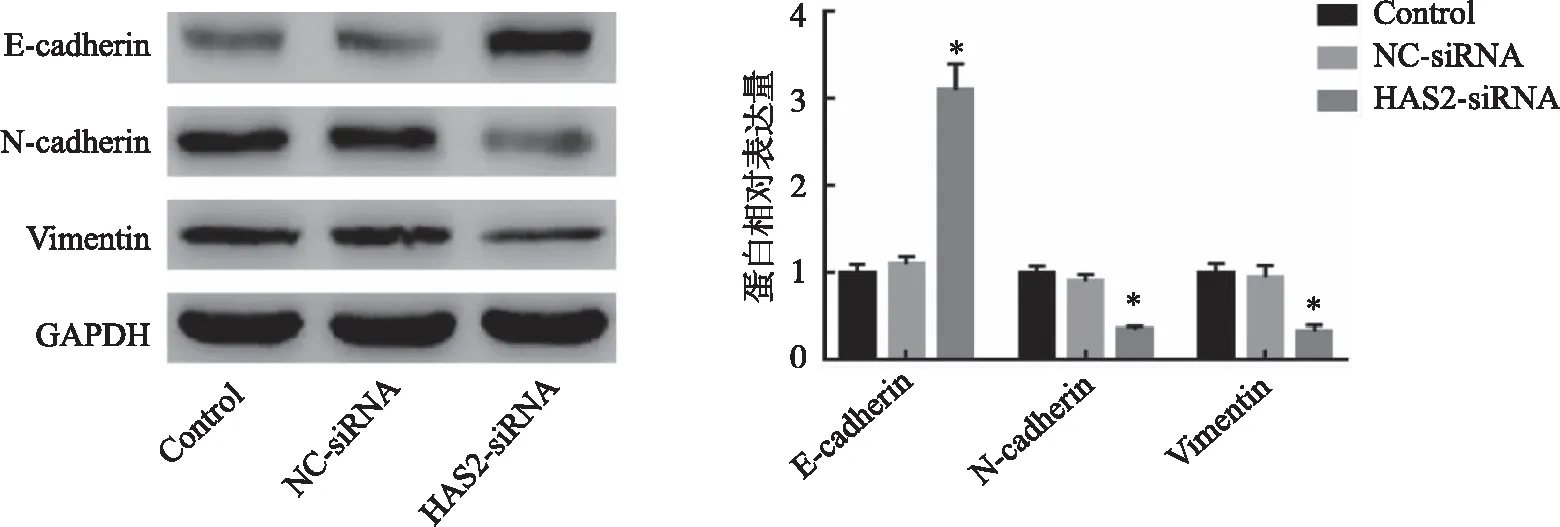
*:与Control组比较,P<0.05。图4 沉默HAS2对RCC细胞EMT的影响
2.5 沉默HAS2对RCC细胞凋亡的影响 流式细胞术结果显示,与Control组比较,HAS2-siRNA组细胞凋亡率显著升高,Bax和Caspase-3蛋白水平显著升高,Bcl-2蛋白水平显著降低,差异均具有统计学意义(P<0.05);NC-siRNA组与Control组比较差异无统计学意义(P>0.05,图5)。

A:流式细胞术检测细胞凋亡;B:Western blot检测Bax、Caspase-3、Bcl-2蛋白的表达;*:与Control组比较, P<0.05。图5 沉默HAS2对RCC细胞凋亡的影响
2.6 沉默HAS2对TGF-β/SMAD4信号通路的影响 结果显示,与Control组比较,HAS2-siRNA组细胞中TGF-β1、p-SMAD4蛋白水平均显著降低,差异均具有统计学意义(P<0.05);NC-siRNA组与Control组比较差异无统计学意义(P>0.05,图6)。
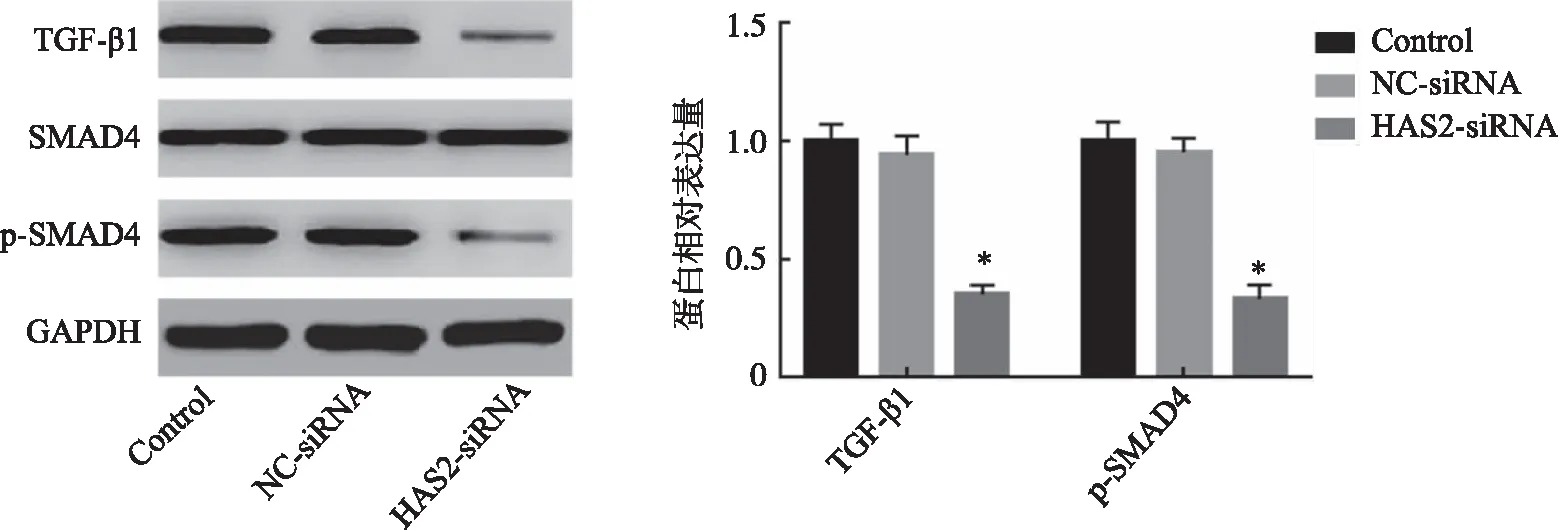
*:与Control组比较, P<0.05。图6 沉默HAS2对TGF-β/SMAD4信号通路的影响
3 讨论
尽管对RCC肿瘤的治疗策略已取得了一些进展,包括手术、放疗和化疗等[10],但RCC的预后仍然很差,其确切的机制仍不清楚。HA是细胞外基质的重要组成部分,也是许多细胞过程的调节因子,如细胞迁移、增殖和分化[11-12]。研究报道,在恶性肿瘤组织中,HA可促进癌细胞的侵袭转移[13]。研究发现HAS2作为透明质酸合成酶在许多癌症中高表达,在癌症的发生发展中发挥重要作用,包括乳腺癌、子宫内膜癌[14-15]。然而,HAS2是否参与RCC的发生发展尚未被研究。因此,本研究通过RT-qPCR和Western blot实验发现HAS2mRNA和蛋白在RCC组织和细胞中的表达均增加。
众所周知,肿瘤细胞的发育过程,包括细胞的增殖、凋亡、迁移和侵袭,在癌症的研究中具有重要意义[16-17]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是将上皮来源的恶性细胞转化为具有间充质表型且具有迁移和侵袭能力的细胞的重要生物学过程,EMT在癌症转移中具有重要作用[18]。EMT的特点是上皮标志物的丢失和间充质标志物增加。E-cadherin被广泛认为是上皮细胞的分子标志物,而N-cadherin被认为是间充质细胞的标志物[19]。Vimentin是EMT的标志分子之一,参与细胞运动、细胞形态维持和定向迁移。研究报道,Vimentin表达异常与肿瘤侵袭、增殖和转移有关[20]。因此,为了探讨HAS2在RCC中的作用,本研究主要观察其在细胞进展和EMT中的作用。功能丧失实验表明,沉默HAS2可显著抑制RCC细胞的增殖和迁移能力,促进RCC细胞凋亡能力。此外,沉默HAS2后,N-cadherin和Vimentin蛋白表达降低,E-cadherin蛋白表达升高,即沉默HAS2会抑制RCC细胞EMT进展,以上结果表明沉默HAS2表达可能会抑制RCC的发生发展。
然而,细胞内HAS2在RCC中致癌作用的分子机制仍然是复杂的。TGF-β是细胞和组织行为(如稳态、伤口愈合、纤维化、血管生成和分化)的主要调节因子之一。TGF-β配体和受体复合物使下游调节蛋白SMAD磷酸化。磷酸化的SMAD与co-SMAD形成复合物并进入细胞核作为基因转录激活因子[21]。既往研究表明,TGF-β信号通路在促进恶性肿瘤进展中发挥重要作用[22-23]。此外,TGF-β通常与癌症侵袭和转移的风险增加和预后不良有关。SMAD4是TGF-β信号传导途径的介质。SMAD4过表达后导致基质金属蛋白酶9的表达上调并促进肝癌进展[24]。因此,靶向TGF-β/SMAD4信号通路对于癌症治疗具有重要作用。本研究观察到沉默HAS2后,RCC细胞中TGF-β1、p-SMAD4蛋白水平均显著降低,提示HAS2对RCC细胞的调控作用可能与TGF-β/SMAD4信号通路有关。
因此,本研究结果发现HAS2在RCC组织和细胞中高表达,沉默HAS2会抑制RCC细胞的生长、迁移和EMT,促进RCC细胞凋亡,其作用机制可能与TGF-β/SMAD4信号通路有关,以上研究结果表明HAS2在RCC发生发展中的关键作用,这可能为进一步了解RCC的发病机制提供帮助,并为RCC提供新的治疗靶点或生物标志物。

