超声法提取小叶苦丁茶多糖及其抗氧化活性研究
秦桂芳,李 刚,张 凤,鲜小菊,匡菊香,朱 蕾,肖世基,李思慧,刘 超,王 刚
(遵义医科大学 药学院,贵州 遵义 563099)
苦丁茶最早记于东汉,距今已有近2000多年的历史,因其资源丰富、价格低廉,已成为我国一种常见的天然饮品[1],其种类主要包括大叶冬青和小叶苦丁茶。本研究所使用的苦丁茶为贵州余庆小叶苦丁茶。小叶苦丁茶是木犀科女贞属植物粗壮女贞(Ligustrumrobustum)的叶,是我国传统的植物代用茶和药食同源植物,主要分布于我国贵州、云南、四川等地[2]。现代药理研究表明,小叶苦丁茶有抗氧化、抗炎、抗衰老、降低血压等作用[3-6]。另外,小叶苦丁茶中含有矿物质、维生素、氨基酸等多种营养成分[7],近年来,越来越多学者关注到了小叶苦丁茶中的活性物质,有望将其开发成为保健药品和食品加工的重要原料。
植物多糖是一种通过醛糖或酮糖键连接的天然高分子聚合物,其来源广泛、药理活性多样、毒副作用小,在肿瘤生长、病毒繁殖、氧化平衡和免疫系统调节中起着重要作用[8-11]。植物多糖提取方法较多,包括酶辅助提取、热回流提取、超声波提取、超音波提取、微波提取等方法。常规提取方法是热回流提取[12],这种方法对温度要求较高且比较耗时,会引起多糖降解并降低药理活性[13]。因此,在选择植物多糖合适的提取方法时,需同时考虑多糖的生物活性和提取率这2个重要参数。超声提取法是一种通过超声的空化作用、热作用和机械作用的相互作用破坏植物细胞,使药材中的有效成分快速溶出的方法。研究发现,超声提取法较传统提取方法在提取速度及提取效率方面有所提升[14-15]。孙永杰等[16]采用3种不同的方法提取淫羊藿的多糖,结果表明,超声法(4.5 %)较微波法(3.01 %)和水酶法(2.62 %)提取率更高。
小叶苦丁茶中含有多酚、黄酮、萜类、多糖等多种有效成分[17-18]。目前,关于小叶苦丁茶的研究主要集中在苯乙醇苷类化合物。有研究表明,小叶苦丁茶中分离出的苯乙醇苷类化合物可显著抑制肝微粒体脂质过氧化产物MDA生成[19]。关于小叶苦丁茶多糖抗氧化活性的研究甚少,鉴于此,本研究在确定了对多糖提取率影响较大的几个因素后,采用响应面优化设计确定水提多糖的最佳提取工艺,并通过自由基清除实验考察小叶苦丁茶多糖的抗氧化活性,为小叶苦丁茶后续在食品及医药领域的开发利用奠定理论基础。
1 材料与方法
1.1 材料 余庆小叶苦丁茶(贵州省余庆县绿野茶叶加工厂);葡萄糖(天津市科密欧化学试剂有限公司);苯酚、无水乙醇(成都市科隆化学品有限公司);浓硫酸[重庆川东化工(集团)有限公司];维生素C(成都瑞芬思生物技术有限公司);1,1-二苯基-2-三硝基苯肼(DPPH)、磷酸氢二钠(上海阿拉丁生化科技股份有限公司);槲皮素(上海麦克林生化科技有限公司);磷酸二氢钠、菲洛嗪(百灵威科技有限公司); FeCl2· 4H2O(国药集团化学试剂有限公司);ABTS(上海碧云天生物技术有限公司)。
1.2 仪器 超声细胞破碎仪(浙江洛尚仪器有限公司);酶标仪(MICROPLATE公司);722可见分光光度计(上海菁华科技仪器有限公司);油浴锅、旋转蒸发仪(上海爱朗仪器有限公司);低温冷却液循环泵(上海豫康科教仪器设备有限公司);循环水式多用真空泵(郑州长城科工贸有限公司);电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂);真空冷冻干燥机(宁波市双嘉仪器有限公司)。
1.3 方法
1.3.1 标准曲线的建立 采用苯酚-硫酸法测定多糖含量。以C6H12O6· H2O为标准物质,配制成 0.02、0.04、0.06、0.08、0.10、0.12 mg/mL的C6H12O6· H2O标准溶液,移取上述溶液400 μL于试管中,再加入400 μL蒸馏水、400 μL 5 %苯酚溶液、2 mL浓硫酸混合均匀,反应30 min后在494 nm波长处测定反应溶液吸光度值,根据吸光度值建立的葡萄糖的标准曲线为:y=5.2518x + 0.0205(y为吸光度值,x为浓度),其中R2=0.9993。
1.3.2 样品制备及含量测定 小叶苦丁茶粉碎过筛后干燥至恒重;称取20 g药材,根据实验设计工艺方案用水提取多糖。将多糖提取液浓缩至500 mL,加入2 000 mL 95 %乙醇,产生灰色絮状沉淀,静置12 h,即得小叶苦丁茶多糖粗提物。将多糖粗提物用蒸馏水重新溶解,以1∶4的比例加入Sevage试剂(三氯甲烷∶正丁醇=5∶1)。然后用力摇匀20 min,离心10 min(3 500 r/min),去除有机相和蛋白层,收集上清液[20]。用0.1 % 氢氧化钠调节上清液至pH 8~9,加入H2O2后在40 ℃条件下反应10 min脱色。再用3 500 Da的透析袋透析72 h去除多酚、黄酮等小分子杂质,浓缩、冷冻干燥得小叶苦丁茶多糖提取物[21]。取经上述处理后得到的精制多糖提取物适量按1.3.1的方法测定吸光度,根据建立的标准曲线计算多糖提取率。
1.3.3 方法学考察 根据文献[22-24],开展了小叶苦丁茶提取物中多糖的含量测定方法研究。
1.3.3.1 精密度实验 取10 mg冻干后的多糖提取物溶于10 mL蒸馏水中,精密量取0.4 mL的样品溶液,按照1.3.1项下的操作,在同一条件下测定吸光度值,重复测定6次,算相对标准偏差值(relative standard deviation, RSD)。
1.3.3.2 稳定性实验 取10 mg冻干后的多糖提取物溶于10 mL蒸馏水中,精密量取0.4 mL的样品溶液,按照1.3.1项下的操作,每0.5 h测一次吸光度值,连续测定6次,计算RSD值。
1.3.3.3 重复性实验 制备6份1 mg/mL的样品溶液,每份精密量取0.4 mL,按“1.3.1”项下分析方法测定吸光度,计算RSD值。
1.3.3.4 加样回收率 制备1 mg/mL的样品溶液9份,分别精密加入低、中、高 3 个质量浓度 (80 %、100 %、120 %)的样品溶液,每一质量浓度3份,按“1.3.1”项下分析方法测定吸光度,计算回收率和RSD值。
1.3.4 多糖提取的单因素实验 设置超声时间、超声功率、液固比3个因素,进行单因素考察。提取时间固定为40 min、提取温度固定为25 ℃,液固比固定为30 mL/g后分别设置时间梯度为30、40、50、60、70 min,功率梯度为160、200、240、280、320 W, 液固比梯度为10∶1、20∶1、30∶1、40∶1、50∶1 mL/g,考察3个因素对小叶苦丁茶多糖提取率的影响,确定响应面试验的提取时间、提取温度和液固比取值范围。
1.3.5 响应面优化设计 基于上述单因素实验结果,挑选对多糖提取率有显著影响的3个因素,即提取时间、提取功率、液固比,利用软件Design-Expert 8设计如表1所示分析方案,矩阵组成17组随机试验以探究最佳提取条件。
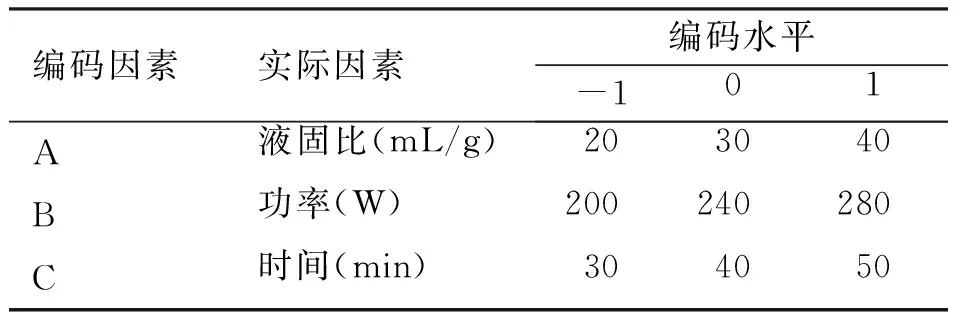
表1 Box-behnken因素水平设计
1.3.6 多糖提取物体外抗氧化实验 将采用最佳提取工艺提取的小叶苦丁茶多糖配制成0.02、0.04、0.06、0.08、0.10 mg/mL的多糖样品溶液。
1.3.6.1 DPPH自由基清除能力测定 参照宋佳敏等[25]的试验方法并作适当修改,以测定多糖提取物对DPPH自由基的清除能力。以槲皮素、维生素C为对照品。准确称取3.94 mg DPPH粉末于50 mL棕色容量瓶中,加无水乙醇溶解,定容,摇匀,即得到0.2 mmol/L的DPPH溶液,避光保存备用。在试管中加入2 mL不同浓度的样品溶液和对照品溶液后加入2 mL DPPH溶液,充分摇匀,暗处反应30 min后,用无水乙醇调零,在波长为517 nm处测定吸光度,样品与DPPH溶液反应后吸光度计为(Ax),溶液与DPPH溶液反应后测得的吸光度计为(A0)。每个浓度平行测定3次,取平均值,同时计算每个样品清除自由基的IC50值(IC50为半抑制浓度,浓度越低表示抗氧化效果越好)。
DPPH清除率 (%) = (A0-Ax/A0) × 100%
1.3.6.2 ABTS自由基的清除能力 参照He等[26]的试验方法并作适当修改,以测定多糖提取物对ABTS自由基的清除能力。以槲皮素、维生素C为对照品。精密称取38.4 mg ABTS粉末于10 mL的棕色容量瓶中,用蒸馏水溶解,定容,摇匀,即得7 mmol/L的ABTS储备液。精密称取6.623 mg 过硫酸钾粉末,用蒸馏水溶解后定容至10 mL,即得2.45 mmol/L过硫酸钾溶液。将ABTS储备液与过硫酸钾溶液等体积混合,暗处反应16 h后,用约20倍体积的磷酸缓冲液稀释,使其在波长为734 nm处的吸光度在0.7 ± 0.02,即得ABTS+母液。分别量取2 mL不同浓度的样品溶液和对照品溶液与2 mL ABTS+母液在暗处反应6 min,在波长为734 nm下测定样品的吸光度(Ax),以无水乙醇代替样品溶液为空白对照(A0),每个浓度平行测定3次,取平均值,同时计算每个样品清除自由基的IC50值。
ABTS清除率(%) = (A0-Ax/A0) × 100 %
1.3.6.3 金属离子螯合测定 参照郑义等[27]的试验方法并作适当修改,以测定多糖提取物对金属离子的螯合能力。以槲皮素、维生素C为对照品。精密称取2.46 mg菲啰嗪于50 mL的棕色容量瓶中,用蒸馏水溶解,定容,摇匀,即得0.1 mmol/L的菲啰嗪溶液。精密称取12.7 mg氯化亚铁粉末于50 mL的棕色容量瓶中,用蒸馏水溶解,定容,摇匀,即得2 mmol/L的氯化亚铁溶液。分别取1 mL 样品及对照品溶液加入到1.7 mL蒸馏水中,再与0.5 mL氯化亚铁溶液和1 mL菲啰嗪溶液均匀混合,静置反应10 min后,用无水乙醇调零,在波长为562 nm处测定吸光度,样品与ABTS反应的吸光度值计为(Ax),无水乙醇与ABTS反应后吸光度计为(A0),每个浓度平行测定3次,取平均值,同时计算每个样品清除自由基的IC50值。
螯合率 (%) = (A0-Ax/A0) × 100%

2 结果
2.1 葡萄糖标准曲线的建立 葡萄糖在浓度为0.02~0.12 mg/mL呈直线关系,如图1所示。以最小二乘法计算其回归方程为:y=5.251 8x+0.020 5,相关系数R2=0.999 3具有显著相关性。

图1 葡萄糖标准曲线
2.2 方法学考察 方法学验证结果表明,精密度实验RSD值为1.04 %<2 % (n=6), 表明该方法精密度良好;稳定性实验RSD值为1.47 %<2 %(n=6),表明样品稳定;重复性实验RSD值为1.32 %<2 %(n=6),表明该方法可重复;加样回收率实验的高、中、低各个水平的回收率的平均回收率为97.86 %,RSD值为1.16 %;该方法回收率较好。
2.3 多糖提取的单因素实验结果 从图2A可看出小叶苦丁茶多糖提取率与超声时间密切相关。超声时间在30~40 min,多糖提取率呈现不断上升的趋势,超声时间在40 min后,多糖的提取率在不断下降,由此可判定提取时间为40 min时提取率最高,此时提取率为14.54 %。考虑到小叶苦丁茶多糖的得率和能源节约2个方面因素,初步确定最佳超声时间在40 min。
多糖提取率的高低与液固比密切相关,充足的溶剂是样品充分浸没和溶质溶出的保证。从图2B可看出,液固比在10 ~ 30 mL/g,多糖提取率呈现不断上升的趋势,液固比在大于30 mL/g时,多糖的提取率在不断下降,由此可判定液固比为30 mL/g时提取率最高,此时提取率为14.59 %。综合各方面因素,初步确定最佳提取液固比在30 mL/g。
从图2C可看出小叶苦丁茶多糖得率与超声功率密切相关。超声功率在160~240 W,多糖提取率呈现不断上升的趋势,超声功率大于240 W时,多糖的提取率在不断下降,由此可判定提取功率为240 W时提取率最高,此时提取率为14.64 %。考虑到小叶苦丁茶多糖的得率和能源节约2个方面因素,初步确定最佳超声功率在240 W。

图2 超声时间、液固比、功率对提取率的影响
2.4 响应面优化设计
Box-Behnken实验结果如表2,提取率(W)数据使用 Design-Expert 11软件进行线性回归方程拟合,得到小叶苦丁茶多糖提取率(W)响应面模型的二次多元线性回归方程:W=0.15+2.261E-003A+7.735E-004B+1.964E-003C+1.904E-003AB+4.760E-004AC+1.547E-0.03BC-0.014A2-4.677E-003 B2-0.015C2
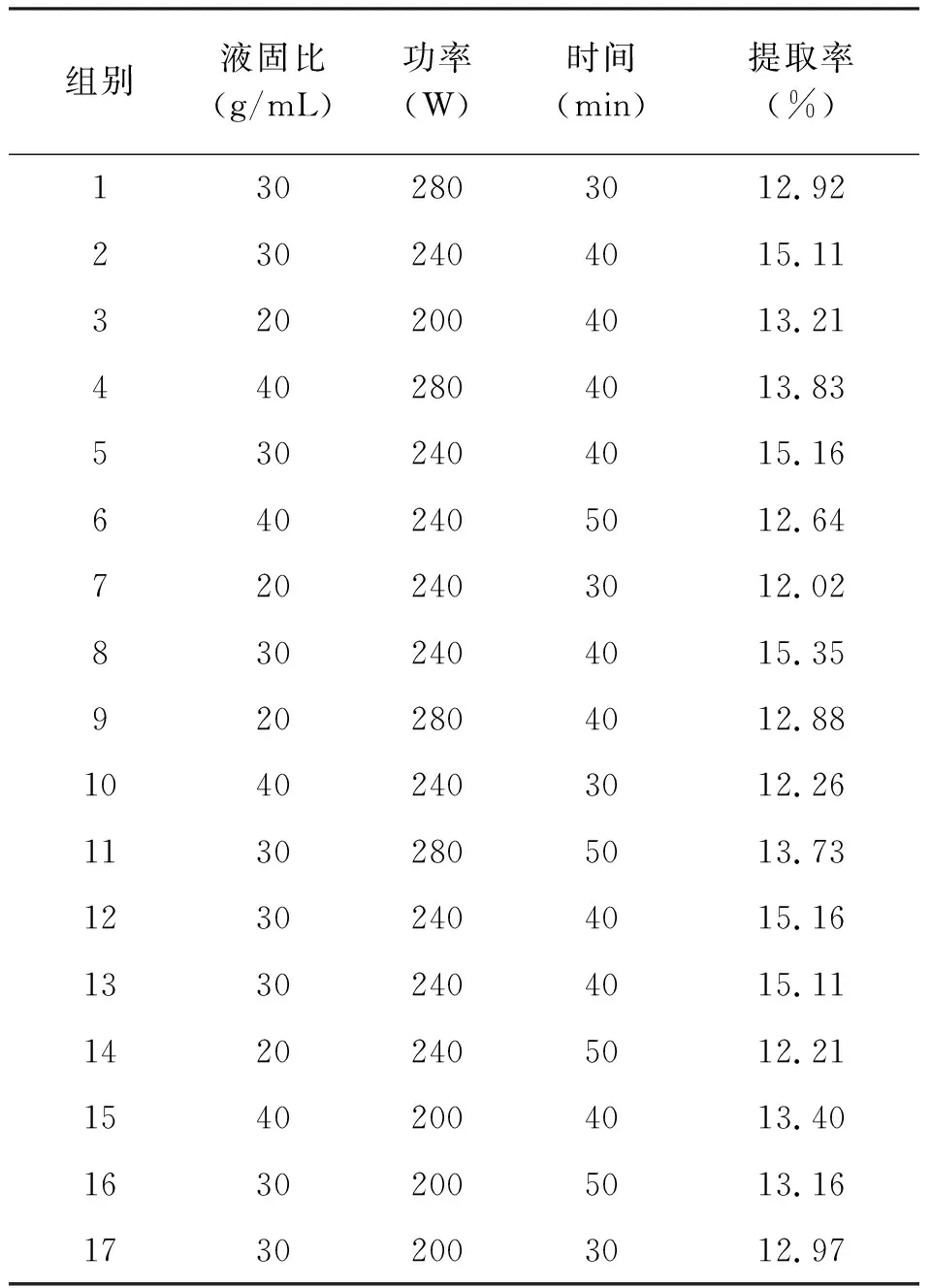
表2 Box-Behnken实验结果
W响应值二次回归模型方差分析:由表3响应面模型的方差分析与显著性检验可知,该模型相关系数R2= 0.994 7,说明该模型方程线性关系良好,具有较好的响应值;模型F值为147.05,P<0.000 1,可知该模型显著,失拟项P=0.194 9(P>0.05)差异不显著,表明其无统计学意义,从而说明该模型可以对小叶苦丁茶提取物中的多糖提取率(W)进行准确的分析及预测。由表3可知影响实验响应值综合评分的F值分别为F(A)=25.30、F(B)=2.96、F(C)=19.08,由此可知对多糖提取率影响因素的大小依次为液固比、提取功率、提取时间;各影响因素的交互作用间的显著程度依次为AB、BC、AC。
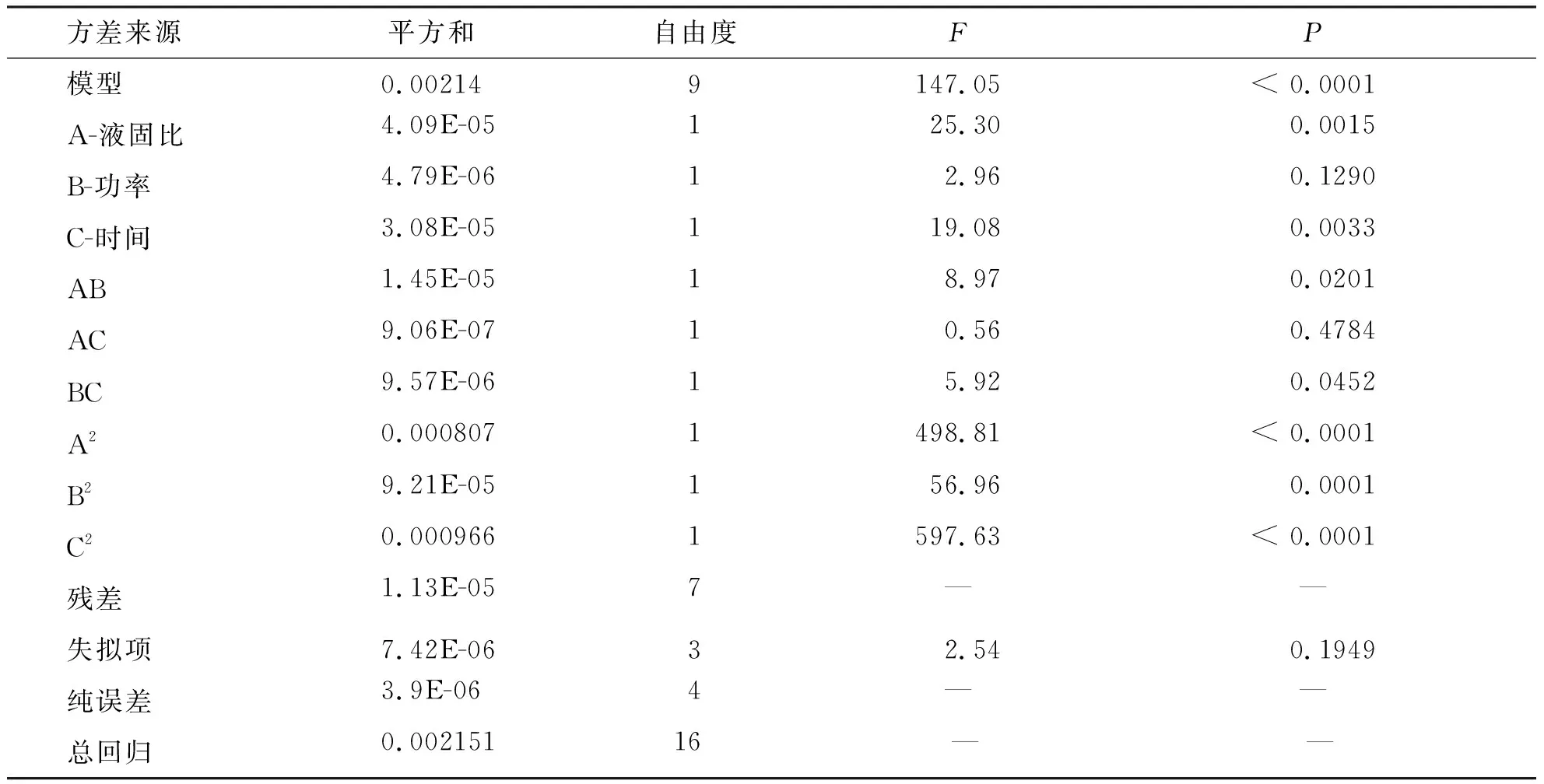
表3 回归方程方差分析
根据Design-Expert 11软件绘制所得二维轮廓图(图3)和3D响应曲面(图4)如下。从等高线图可看出,3个二维轮廓图均呈椭圆形,说明3个因素中任意两个的交互作用对小叶苦丁多糖提取率的影响显著。响应面结果用Design Expert软件优化后可知,小叶苦丁茶多糖提取的最佳工艺条件为提取时间41 min,提取功率240 W,液固比31 mL/g,此时最佳提取率为15.20 %。为验证BBD实验的可靠性,采用上述最优提取条件进行小叶苦丁茶多糖提取,通过6次平行测定,测得小叶苦丁茶多糖的得率分别为15.16 %、15.19 %、15.17 %、15.20 %、15.19 %、15.18 %,该得率与模型预测最大值15.20 %接近,两者相对误差小于1 %,说明本响应面试验优化小叶苦丁茶多糖的提取工艺是可行的。
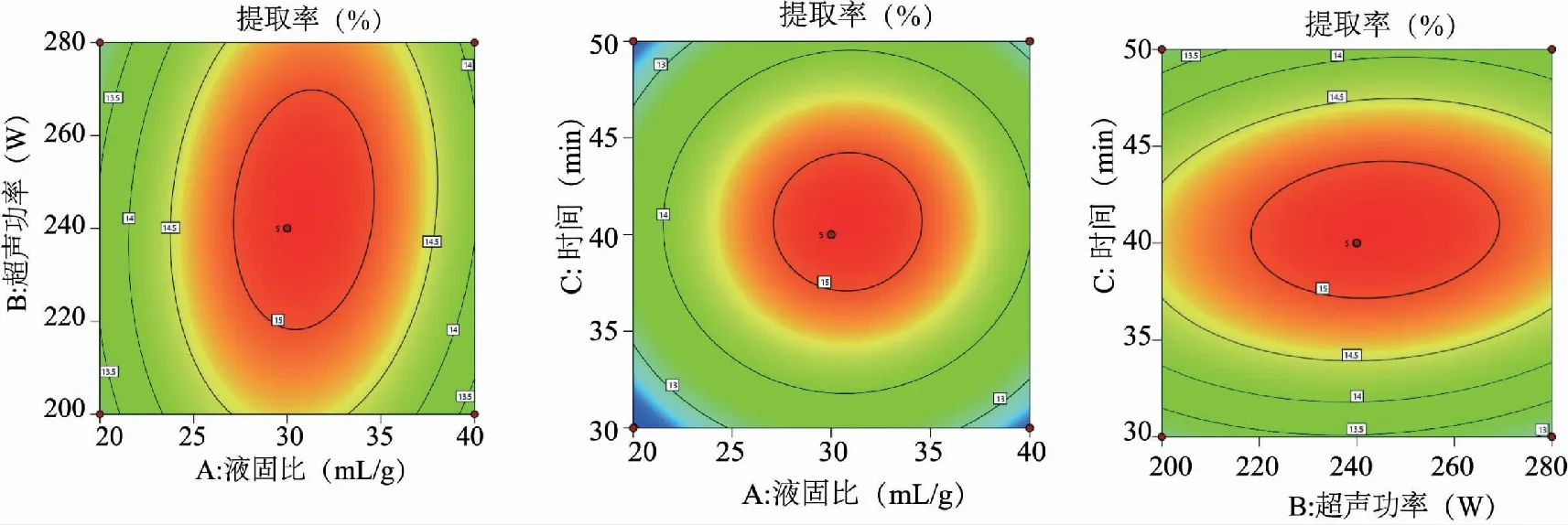
图3 影响多糖提取率的响应面影响因素之间相互作用的二维轮廓

图4 响应面影响因素之间的交互作用对多糖提取率的三维曲面
2.5 多糖提取物体外抗氧化实验 DPPH自由基极其稳定,其甲醇溶液呈紫色,抗氧化剂可以通过供氢体将DPPH自由基还原成黄色的二苯肼,导致其在最大波长处的吸光度发生变化,因此,DPPH自由基清除率通常用于评估该物质的抗氧化活性。图5为多糖提取物及对照品对DPPH自由基的清除率曲线。从图中可以看出,随着多糖提取物浓度的增加,其对DPPH自由基的清除率也呈现出不断上升趋势,在浓度为0.12 mg/mL时达到平衡,此时清除率最大,最大值为83.56 %,对应的IC50值为47.22 μg/mL。而此时维生素与槲皮素的清除率分别为94.13 %、88.06 %,说明多糖提取物对DPPH自由基清除效果明显,多糖提取物有明显的DPPH自由基清除能力。
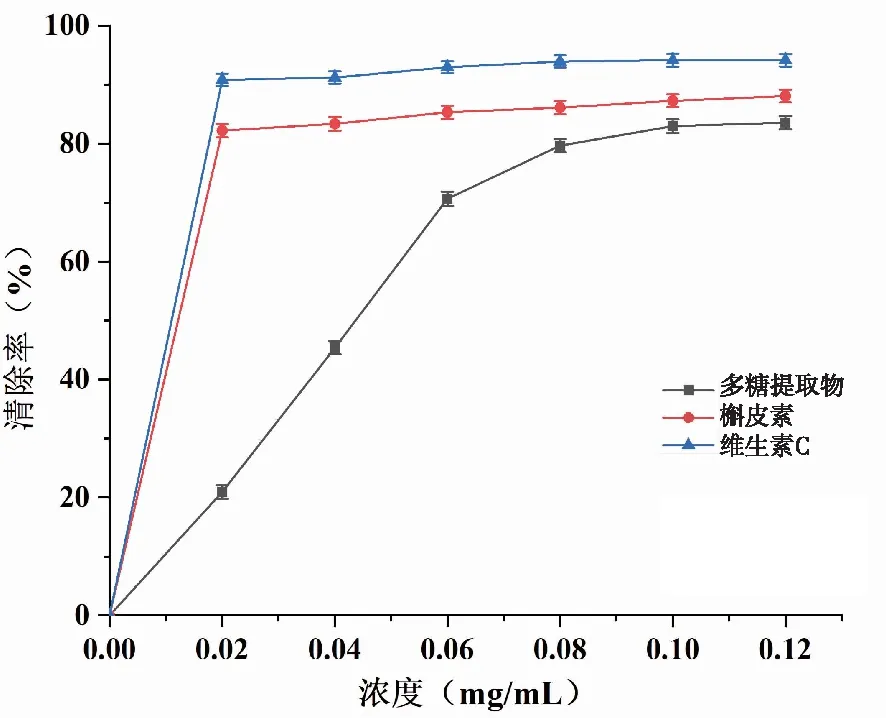
图5 小叶苦丁茶多糖提取物对DPPH自由基的清除率
图6为多糖提取物及对照品对ABTS自由基的清除率曲线。从图中可以看出,随着多糖提取物浓度的增加,其对ABTS自由基的清除率也呈现出不断上升趋势,在浓度为0.12 mg/mL时达到平衡,此时清除率最大,最大值为81.31 %,对应的IC50值为12.74 μg/mL。其对ABTS自由基的清除率最终保持在80 % 以上,表明多糖提取物具有一定的清除 ABTS 自由基能力,具有较好的体外抗氧化活性。

图6 小叶苦丁茶多糖提取物对ABTS自由基的清除率
图7为小叶苦丁茶多糖提取物及对照品对金属离子的螯合率曲线。由图可知,在0.2~1.2 mg/mL,多糖提取物对金属离子的螯合能力不断增强,在0.12 mg/mL时清除率达到最大,最大值47.49 %,其IC50值为125.54 μg/mL。

图7 小叶苦丁茶多糖提取物对金属离子的螯合能力
3 讨论
目前,用于评价天然药物抗氧化活性的方法较多,主要分为体内抗氧化活性和体外抗氧化活性研究。相比于体内抗氧化研究,体外抗氧化测试操作简单,成本较低,适用于多种样品同时分析。但是,体外抗氧化法无法模拟人体的真实生理环境,且都只测定了抗氧化能力中的某一方面,故无法模拟生理条件下的多种抗氧化途径。另外,对于复杂样品,抗氧化物质的抗氧化效果无法用单一的机制解释[28]。
超声提取法利用超声波的空化效应、热效应及机械效应,使多糖分子的运动速度加快,溶剂的穿透力增强,进而增大了多糖提取率。应用此方法提取小叶苦丁茶多糖,具有效率高、节约时间的优点。但是,超声时间过长,超声功率过大时,多糖的分子键会被超声波的剪切作用破坏,多糖的提取率会下降[29-30]。此外,适当的液固比对于多糖提取率也很重要。多糖属于水溶性成分,当水被用作溶剂时,多糖分子将继续扩散到水中。随着溶剂用量的增加,多糖的溶解度达到平衡。过高的液固比会使得杂质增加,不利于多糖的溶出,从而降低多糖的提取率[31-32]。后期课题组将深入研究,分离纯化多糖提取物,以期得到若干高纯度的均一多糖,并评价它们的抗氧化活性。本研究将为天然抗氧化剂的筛选以及小叶苦丁茶这一药食两用植物的综合利用提供依据。
本研究以贵州余庆小叶苦丁茶为原料,利用超声法对小叶苦丁茶多糖进行提取,通过单因素和响应面实验优化试验得到其最佳提取工艺为:提取时间41 min,提取功率240 W,液固比31 mL/g。在此条件下,多糖的提取率为15.20 %,相比其他传统提取方法提取率明显增加[33]。通过体外抗氧化实验发现,其对DPPH、ABTS自由基的清除能力以及金属离子的螯合率均随小叶苦丁茶多糖提取物浓度的增加而上升,这表明其具有一定的抗氧化活性,有开发成天然抗氧化剂的潜能。

