烟草根黑腐病拮抗菌的分离鉴定和生防作用特性研究
黄婉媛,李彩斌,彭 宇,李章海,黄衍章,丁 婷,*
(1.安徽农业大学 植物保护学院,植物病虫害生物学与绿色防控安徽普通高校重点实验室,作物有害生物综合治理安徽省重点实验室,安徽 合肥 230061; 2.贵州省烟草公司毕节市公司,贵州 毕节 551700; 3.中国科学技术大学 烟草与健康研究中心,安徽 合肥 230061)
近年来,随着贵州烟区烟草连作增多、栽培制度的变化,由根串珠霉(Thielaviopsisbasicola)引起的烟草根黑腐病在贵州毕节不同烟区均有不同程度的发生,且危害持续加重,已成为毕节烟区主要的土传病害之一[1]。目前化学防治是防控该病害的主要方法,但化学农药的长期施用易导致病原菌产生抗药性,造成环境污染等问题。生物防治因其绿色、无残留和长效性等优点,在烟草根黑腐病害防治中占有越来越重要的地位[1]。以烟草根黑腐病菌为靶标,相继筛选获得了多个芽孢杆菌属及木霉属的微生物并应用于生产[2-4]。
功能菌要充分发挥其在促进植物生长及防治病害中的作用,接种至土壤中的菌株能否在植物根部成功定殖至关重要[5]。菌株的定殖特性已成为筛选、评价功能菌的一个重要指标。了解菌株的定殖特性,可以最大程度地发挥菌株的防病效果,实现生防菌的合理利用。本研究以烟草根黑腐病菌为靶标,对从贵州毕节烟区根际土壤中分离得到的多株根际微生物进行拮抗菌株筛选,开展高效功能菌脂肽抑菌活性及编码基因的检测。研究毕节烟区主栽烟品种K326根系分泌物及其产生的有机酸对功能菌趋化及生物膜形成的影响,以明确功能菌的定殖特性。本研究旨在从毕节烟区分离的根际微生物中筛选出生物胁迫下烟株根系分泌物表现出更强趋化性和生物膜形成能力的拮抗菌株,为开发效果稳定的微生物农药提供理论基础。
1 材料与方法
1.1 试验材料
供试烟草品种为贵州烟区主栽品种K326,烟草根黑腐病菌由安徽农业大学植物保护学院植病教研室提供。2020年5月从贵州省毕节市金沙、大方等烟区采集健康烟草根际土壤22份,其中拮抗菌S2-1和SNSY15-5均分离自贵州毕节大方烟区。
拮抗菌的分离和培养采用NA培养基,拮抗菌脂肽的培养采用Landy培养基,拮抗菌生物膜的培养采用Msgg培养基。
1.2 试验设计
1.2.1 菌株的筛选和分离
称取除杂过筛后的烟草根际土样5.00 g(精确到0.01 g),无菌水定容至50 mL,28 ℃、200 r·min-1充分振荡30 min,即成母液菌悬液,用无菌移液管吸取1.0 mL上述母液,加入9 mL无菌水,按10n进行系列稀释,依次得到10-2~10-6稀释倍数的菌悬液。每个样品取3个连续适宜的稀释度,分别吸取不同稀释度菌悬液0.1 mL,加至预先制备好的NA固体培养基平板上,用涂布棒在培养基表面将菌液来回推散涂抹均匀。每一稀释度重复3次,于28 ℃恒温培养1~2 d。挑取生长形状不同的单菌落,多次平板培养和纯化,直至获得纯化的单菌落,甘油保存。
1.2.2 抑菌活性检测
采用平板对峙培养法,打孔器打取直径为6 mm的烟草根黑腐病菌(T.basicola)菌饼接种至PDA空白培养基中央,于25 ℃恒温箱中培养3 d后形成菌落,在距菌落中心25 mm处等距离接种拮抗细菌,以只接种T.basicola菌的PDA培养基作空白对照(CK),每个处理设4次重复,置于25 ℃恒温箱中培养,逐日观察记载病原菌菌落直径,计算拮抗指数。
此外,拮抗菌与T.basicola对峙培养第7天,挑取与拮抗菌对峙培养面的T.basicola菌丝,镜检,以只接种病原菌的PDA培养基作空白对照。
1.2.3 拮抗菌的分子生物学鉴定
拮抗细菌基因组提取参见谢永丽等[6]方法。16S rDNA扩增上游引物:5′-AGAGTTTGATCMTGGCTCAG-3′;下游引物:5′-GGYTACCTTGTTACGACTT-3′。PCR扩增条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。将16S rDNA扩增产物回收纯化及测序,利用BLAST软件进行同源性比较,初步确定其所在地属。在此基础上,对上述已通过16S rDNA测序的拮抗菌株进一步开展GyrB鉴定,GyrB扩增上游引物:5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTC-3′;下游引物:5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTY-
GA-3′。PCR扩增条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。测序结果在NCBI数据库进行比对分析,利用MEGA 10.0软件构建系统发育进化树。
1.2.4 拮抗菌脂肽粗提物对烟草根黑腐病菌的抑制活性
根据不同的地质条件、潮汐风浪等环境因素,对具有相同建设条件、有代表性的灯桩进行设计(包括基础选择、选材、作用、尺寸、楼梯设计),以此为依据编制灯桩标准化设计施工图纸。
拮抗菌脂肽粗提物的制备。采用Hsieh等[7]的HCl沉淀法提取拮抗物质,挑取拮抗菌单菌落至NA液体培养基,28 ℃,200 r·min-1培养24 h,获得拮抗菌培养液。按照3%的接种量,将拮抗菌培养液接种于150 mL Landy培养液中,30 ℃、200 r·min-1条件下培养38 h后,离心去除菌体细胞,上清液加入HCl(6 mol·L-1)调pH值至2.0,4 ℃静置过夜后收集沉淀,加入适量色谱级甲醇,用无菌棒搅拌溶解,4 ℃静置8 h,上清液旋转蒸发冻干,即为拮抗菌脂肽粗提物。脂肽粗提物用无菌水溶解,配制成10 mg·mL-1备用。
拮抗菌粗脂肽对烟草根黑腐病菌生长的影响。融化后的PDA培养基降温至45 ℃,15 mL PDA培养基倒入培养皿,滴加脂肽粗提物母液充分混合,使PDA含粗脂肽提取物终浓度为0、0.8、1.6、2.4、3.2、4.0 mg·mL-1,制成含毒培养基。将培养好的T.basicola用打孔器打成直径0.6 cm的菌碟,接种至平板中央,待空白对照(即皿内粗脂肽提取物终浓度为0 mg·mL-1)长至满皿后,测量各浓度培养基上的菌落直径,计算菌丝生长抑制率。
绘制标准曲线,计算出拮抗菌脂肽粗提物对烟草根黑腐病菌的毒力回归方程,相关系数和EC50及EC90。
拮抗菌脂肽合成基因的鉴定。用于鉴定脂肽合成基因bmyB、fenD、ituC、srfAA、srfAB、bioA、yngG和yndJ的8对特异引物均由安徽通用生物公司合成,引物序列见表1,扩增条件参考杨瑞先等[8]方法。将扩增产物回收纯化后测序,所得序列通过NCBI数据库进行BLAST比对。

表1 用于鉴定脂肽合成基因的引物Table 1 Primer sequences for amplification of lipopeptide functional genes
1.2.5 烟草根系分泌物及有机酸对拮抗菌定殖特性的影响
烟草根系分泌物制备。烟草根系分泌物收集参考吴凯等[9]方法,将K326烟草种子播种在装有营养基质的盆钵中,置28~30 ℃条件下培养(16 h光照/8 h黑暗交替),待烟草长至4~5片叶时,取出烟草植株,在自来水下冲洗干净根系,蒸馏水润洗3次后,将其转入盛有150 mL无菌双蒸水的烧杯中,所有根系都浸入水中培养48 h(28~30 ℃,16 h光照/8 h黑暗交替),收集培养液并冷冻干燥备用。
烟草根系分泌物及有机酸对拮抗菌生物膜形成的影响。采用六孔板培养拮抗菌,每孔加6 mL NA液体培养基、500 μL K326 根系分泌物(终浓度为10 mg·mL-1)或500 μL有机酸溶液(终浓度为10 mg·mL-1的苹果酸、草酸、柠檬酸及100 mg·mL-1琥珀酸)、10 μL拮抗菌S2-1和SNSY15-5菌悬液(1×108CFU·mL-1),以在NA液体培养基培养的S2-1和SNSY15-5为对照,30 ℃静置培养72 h后,观察生物膜的形成。
参照Hamon等[12]的方法,利用96孔板法定量生物膜,测定K326根系分泌物及其有机酸对拮抗菌S2-1和SNSY15-5生物膜形成的影响。96孔板上每孔加150 μL NA液体培养基、50 μL K326根系分泌物(终浓度为10 mg·mL-1)或50 μL有机酸标样(终浓度为10 mg·mL-1的苹果酸、草酸、柠檬酸及100 mg·mL-1琥珀酸)、20 μL拮抗菌S2-1和SNSY15-5菌悬液;对照组每孔加150 μL NA液体培养基、50 μL无菌水、20 μL拮抗菌S2-1和SNSY15-5菌悬液。30 ℃条件下静置培养72 h,缓慢吸出生物膜下面的培养液,用PBS缓冲液反复冲洗3~4遍后洗净培养液,室温静置,自然风干。在30 ℃条件下用1%的结晶紫染色15 min后,再用PBS缓冲液反复冲洗至无色,再加入200 μL 90%乙醇静置30 min,使用分光光度计在570 nm波长下测定拮抗菌生物膜量。
K326根系分泌物及其有机酸对拮抗菌生物膜成膜基因的表达影响。分别将6 mL拮抗菌S2-1及SNSY15-5的液体培养物(均为1×108CFU·mL-1)和5 mL K326根系分泌物(终浓度10 mg·mL-1)或不同有机酸类物质(终浓度10 mg·mL-1的苹果酸、草酸、柠檬酸及100 mg·mL-1琥珀酸)接种至200 mL NA无菌培养液中,以接种至200 mL NA无菌培养液中正常生长的S2-1及SNSY15-5为对照,30 ℃、200 r·min-1,每个处理设置3个重复。根据RNA提取试剂盒(购于TaKaRa)说明书提取RNA,随后利用反转录试剂盒(艾科瑞生物工程,湖南)根据说明书将RNA样品进行反转录,得到的cDNA利用核酸定量仪Thermoscientific NANODROP 1000进行定量。
1.3 数据处理
测得的各项数据采用DPS (Data Processing System) 数据处理系统进行差异显著性分析,Duncan新复极差法处理,在0.05水平上分别分析差异显著性。
2 结果与分析
2.1 烟草根际拮抗菌的分离筛选
经稀释涂布平板法,从22份烟草根际土样中分离得到67株菌株。以烟草根黑腐病菌T.basicola为靶标,经平板对峙培养法进行初筛和复筛,得到12个对T.basicola有较好拮抗活性的根际微生物。其中SNSY15-5和S2-1对T.basicola拮抗指数分别达到61.56%和52.78%,与正常生长的T.basicola菌落相比,上述两株拮抗菌可明显抑制病原菌的菌丝生长。光学显微镜观察发现,拮抗菌S2-1和SNSY15-5与T.basicola对峙培养7 d,均可造成T.basicola菌丝分枝增多、膨大变粗、扭曲畸形,对照菌丝生长均匀,光滑,无畸形膨大现象(图1)。
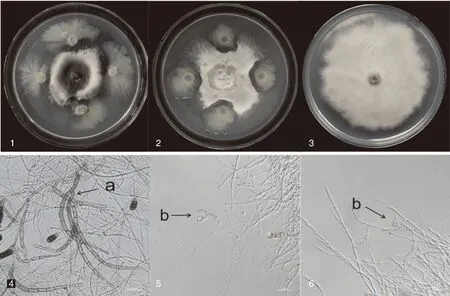
1,SNSY15-5与烟草根黑腐病菌对峙培养7 d;2,S2-1生防菌与烟草根黑腐病菌对峙培养7 d;3,烟草根黑腐病菌培养10 d;a,烟草根黑腐病原菌正常菌丝形态;b,接种拮抗菌对峙培养7 d后的烟草根黑腐菌丝形态。1, SNSY15-5 and Thielaviopsis basicola were cultured in confrontation for 7 days; 2, S2-1 and Thielaviopsis basicola were cultured in confrontation for 7 days; 3, Thielaviopsis basicola were cultured separately for 10 days respectively; a, Normal mycelium morphology of Thielaviopsis basicola; b, Mycelial morphology of Thielaviopsis basicola treated with antagonistic bacteria for 7 days.图1 拮抗菌对烟草根黑腐病菌的抑制作用Fig.1 Inhibitory effect of antagonistic bacteria on Thielaviopsis basicola
2.2 拮抗菌SNSY15-5和S2-1的分子生物学鉴定
以烟草根际拮抗菌SNSY15-5和S2-1的基因组DNA为模板进行16S rDNA扩增测序,在明确SNSY15-5和S2-1皆为芽孢杆菌属的基础上,进一步对上述两个菌株开展GyrB鉴定,同源性比对后采用MEGA7.0软件的最大似然法建系统发育树(图2)。在SNSY15-5和S2-1的GyrB系统发育树中,菌株S2-1与Bacillusvelezensis(MT081105.1)聚类为同一分支,同源性达到95%,而菌株SNSY15-5与Bacillussubtilis(JQ579620.1)同源性为92%(图2)。结合系统发育分析,可知菌株S2-1和SNSY15-5均为芽孢杆菌属细菌。

图2 拮抗菌的 GyrB基因系统发育树Fig.2 Phylogenetic tree of GyrB sequence of antagonistic bacteria
2.3 拮抗菌SNSY15-5和S2-1脂肽粗提物对T. basicola的抑菌活性
将T.basicola接种至含不同浓度拮抗菌SNSY15-5和S2-1脂肽粗提物的PDA固体培养基培养7d,观察T.basicola在含不同浓度拮抗菌脂肽粗提物的PDA培养基中的生长情况,发现T.basicola在脂肽粗提物终浓度0 mg·mL-1的培养基上长满整个平板,而经拮抗菌SNSY15-5和S2-1不同浓度粗脂肽提取物处理的T.basicola菌生长均受到一定程度的抑制,且随着SNSY15-5和S2-1粗脂肽提取物浓度的增加,对T.basicola生长的抑制作用越明显(图3)。测量T.basicola在含拮抗菌SNSY15-5和S2-1脂肽粗提取物不同浓度的PDA培养基中的菌丝直径,计算T.basicola的菌丝生长抑制率,绘制毒力回归方程,计算出相应的EC50、EC90值(表2)。拮抗菌S2-1和SNSY15-5脂肽粗提物对T.basicola的EC50分别为1.93和2.56 mg·mL-1, EC90分别为4.43和4.41 mg·mL-1,比较可知,拮抗菌S2-1粗脂肽对T.basicola的毒力较强。
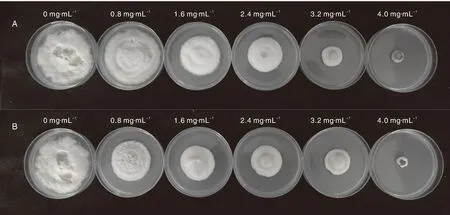
A, SNSY15-5; B, S2-1.图3 拮抗菌粗脂肽提取物对烟草根黑腐病菌生长的抑制情况Fig.3 Effects of crude lipopeptide extracts of antagonistic bacteria on Thielaviopsis basicola

表2 拮抗菌脂肽粗提取物对烟草根黑腐病菌生长的影响Table 2 Antagonistic effect of crude lipopeptide extracts of antagonistic bacteria on Thielaviopsis basicola
2.4 拮抗菌SNSY15-5和S2-1脂肽合成基因的扩增
利用8对脂肽合成基因的特异引物,通过PCR检测拮抗菌SNSY15-5和S2-1的部分脂肽合成基因。发现SNSY15-5含有参与脂肽类家族细菌素(bacteriocin)、生物素操纵子(operon)和假定蛋白(yngG)合成的基因;S2-1含有参与脂肽类家族生物素操纵子(operon)合成的基因,图4表明,菌株SNSY15-5和S2-1可能具有产生上述生防物质的能力。将扩增获得的特异条带回收纯化,克隆测序获得序列,利用BLASTX将获得的序列与NCBI数据库中相关蛋白质序列进行比对,发现SNSY15-5和S2-1与贝莱斯芽孢杆菌或枯草芽孢杆菌生防功能基因的蛋白质序列同源性在95%以上,证明本试验利用特异性引物所扩增到的基因片段为相应的生防功能基因序列(图5)。

M, DL 2000 marker; 1表示S2-1的功能基因bioA;2、3、4分别表示SNSY15-5的功能基因bioA、bmyB、yngG。M, DL 2000 marker; 1 represent the functional gene bioA of S2-1; 2, 3, 4 represent the functional genes bioA,bmyB and yngG of SNSY15-5, respectively.图4 拮抗菌S2-1和SNSY15-5脂肽相关基因扩增结果Fig.4 Amplification results of functional genes coding lipopeptides of the S2-1 and SNSY15-5
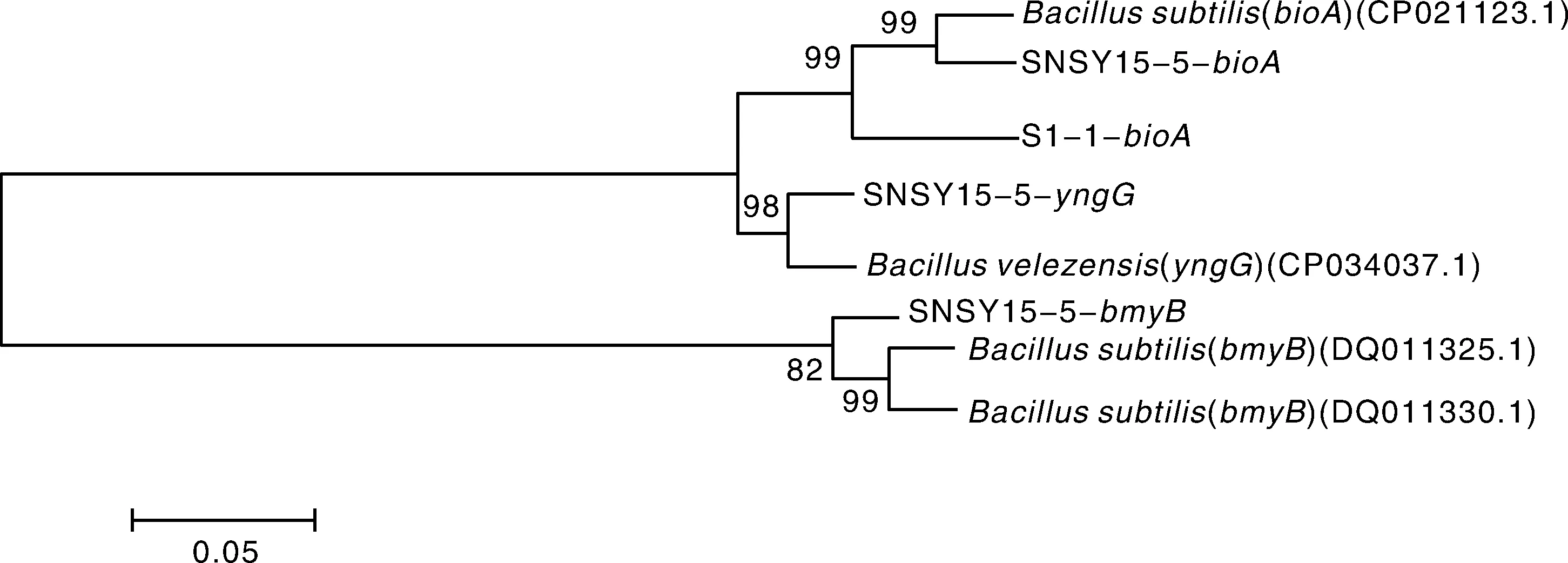
图5 拮抗菌S2-1和SNSY15-5脂肽相关基因的进化分析Fig.5 Evolutionary analysis of functional genes coding lipopeptides of S2-1and SNSY15-5
2.5 烟草根系分泌物及有机酸对拮抗菌趋化特性的影响
前期试验证实,烟草品种K326根系可分泌草酸、苹果酸、柠檬酸和琥珀酸这4种有机酸[10]。利用趋化性试验,探究K326烟草根系分泌物及所产生的各种有机酸对拮抗菌S2-1和SNSY15-5根部定殖的影响。结果如表3所示,拮抗菌S2-1和SNSY15-5均可不同程度利用K326烟草根系分泌物及产生的有机酸。苹果酸对S2-1和SNSY15-5均具有较强的吸引作用,分别达到了63.35×104CFU·mL-1和42.35×104CFU·mL-1;琥珀酸对S2-1吸引作用最弱,仅为12.30×104CFU·mL-1,柠檬酸对SNSY15-5吸引作用最弱,为17.35×104CFU·mL-1。两种拮抗菌的趋化特性依次为,S2-1:苹果酸>草酸>柠檬酸>K326根系分泌物>琥珀酸>CK;SNSY15-5:苹果酸>K326根系分泌物>琥珀酸>草酸>柠檬酸>CK。
表3 拮抗菌对烟草根系分泌物和有机酸的趋化反应Table 3 The chemotactic response of antagonistic bacteria to the K326 tobacco root exudates and organic acid
2.6 烟草根系分泌物及有机酸对拮抗菌生物膜成膜能力的影响
拮抗菌株在NA液体培养基中30 ℃静置培养72 h后,观察生物膜形成状态,发现拮抗菌S2-1在NA液体培养基,以及添加了根系分泌物及有机酸的培养基中均能形成白色的生物膜,但柠檬酸和苹果酸处理组形成的生物膜与根系分泌物及琥珀酸等处理组相比,较稀疏,分散呈小斑块状;SNSY15-5在NA液体培养基,以及添加了根系分泌物及琥珀酸、柠檬酸的培养基中均能形成明显的生物膜,呈白色云雾状团集,草酸、苹果酸对SNSY15-5生物膜的形成无明显促进作用(图6)。从外观可以初步看出,根系分泌物处理后对拮抗菌生物膜的形成具有促进作用。经结晶紫染色,在570 nm下测定拮抗菌生物膜量。添加K326根系分泌物、草酸及琥珀酸对S2-1生物膜形成具有促进作用,添加上述3种物质后的D570均高于对照组;柠檬酸和苹果酸对S2-1生物膜形成没有作用。草酸、琥珀酸、苹果酸对SNSY15-5生物膜的形成无促进作用,其D570均低于对照组;K326根系分泌物及柠檬酸对SNSY15-5生物膜的形成具有明显促进作用(表4)。上述结果与拮抗菌生物膜定性分析结果一致。

图6 K326根系分泌物及有机酸对拮抗菌生物膜成膜能力的影响Fig.6 Effect of the K326 tobacco root exudates and organic acid on the biofilm formation of antagonistic bacteria

表4 K326根系分泌物及有机酸对拮抗菌生物膜成膜能力的定量检测Table 4 Quantitative detection of the effect of K326 root exudates and organic acids on the biofilm formation of antagonistic bacteria
2.7 烟草根系分泌物及有机酸对拮抗菌生物膜成膜基因表达的影响
明确了K326根系分泌物、柠檬酸、草酸、苹果酸、琥珀酸等均可促进拮抗菌S2-1和SNSY15-5生物膜的形成。选用K326根系分泌物、柠檬酸、草酸、苹果酸、琥珀酸5种物质研究其对拮抗菌S2-1和SNSY15-5生物膜合成相关基因epsD、yqxM、kinC等表达的影响。实时荧光定量PCR检测不同处理组的S2-1和SNSY15-5的epsD、yqxM、kinC基因的表达,结果发现,K326根系分泌物均可促进拮抗菌S2-1和SNSY15-5生物膜成膜基因epsD、yqxM、kinC的表达,K326根系分泌物处理后的S2-1生物膜成膜基因epsD、yqxM、kinC表达分别上调1.13、1.21、1.31倍,而K326根系分泌物处理后的SNSY15-5生物膜成膜基因epsD、yqxM、kinC的表达量分别上调1.32、1.28、1.38倍。此外,加入草酸可促进S2-1生物膜成膜相关基因kinC、yqxM表达,表达量比对照组分别高出1.31、1.40倍;柠檬酸和苹果酸对S2-1生物膜成膜基因表达均呈负调控趋势。与此同时,柠檬酸对SNSY15-5成膜基因yqxM、kinC表达呈正调控,而草酸、苹果酸、琥珀酸均对SNSY15-5生物膜成膜基因表达呈负调控趋势。该结果也在一定程度上表明拮抗菌S2-1和SNSY15-5在K326烟草植株根际具有较好的定殖能力,草酸和柠檬酸分别对促进S2-1和SNSY15-5生物膜成膜起到促进作用(图7)。

CK,对照组;W1,拮抗菌添加K326根系分泌物处理组;W2,拮抗菌添加柠檬酸处理组;W3,拮抗菌添加苹果酸处理组;W4,拮抗菌添加草酸处理组;W5,拮抗菌添加琥珀酸处理组。CK, Control group; W1, Antagonistic bacteria treated with K326 root exudates; W2, Antagonistic bacteria treated with citric acid; W3, Antagonistic bacteria treated with malic acid; W4, Antagonistic bacteria treated with oxalic acid; W5, Antagonistic bacteria treated with succinic acid.图7 K326根系分泌物及有机酸对拮抗菌生物膜形成相关基因表达的影响Fig.7 Effects of K326 root exudates and organic acids on gene expression related to antagonistic biofilm formation
3 讨论
在植物病害生物防治中,芽孢杆菌属微生物是应用较广泛、生防效果较好的一类细菌,目前利用芽孢杆菌属微生物防治青枯病的研究已有大量报道[13-14]。研究表明,芽孢杆菌可通过产生表面活性素、伊枯草菌素等多种抗菌物质,以及诱导寄主植物形成对病原菌的抗性等直接或间接途径对植物病原菌生长形成抑制作用[15]。本研究发现,SNSY15-5含有参与脂肽类家族细菌素 (bacteriocin)、生物素操纵子 (operon) 和假定蛋白 (yngG)合成的基因;S2-1菌株中含有参与脂肽类家族生物素操纵子合成的基因。细菌素作为核糖体合成的天然抑菌产物,具有安全、高效、特异性强等特点,可以作为抗生素的一种有效代替产物来解决耐药性细菌的产生、增殖和传播[16];生物素操纵子和假定蛋白则在芽孢杆菌合成生物素以及相关抑菌蛋白的过程中发挥重要作用[17-18];上述结果表明,S2-1和SNSY15-5产生的抑菌物质在生物防治领域具有一定的应用潜力。但芽孢杆菌产生的抗菌物质较多,S2-1和SNSY15-5对T.basicola的抑菌作用仅是脂肽类物质的作用结果,还是脂肽物质和其他抗菌蛋白共同防病作用,仍需做进一步研究。
植物在其生长过程中,可通过根系向周围环境分泌大量的光合产物,如糖、有机酸和次生代谢产物来影响根际微生物的生存环境和基因表达。根际细菌不仅会受到植物种类的调控,还会受到同种植物不同品种的影响[19]。功能菌要充分发挥其在促进植物生长及防治病害中的作用,释放至土壤中的菌株能否在植物根部成功定殖至关重要[5]。细菌趋化性和生物膜形成能力被认为是评判其定殖能力的两个重要指标[20]。细菌趋化性作为定殖过程中的重要步骤,可对植物根系分泌物中的特定物质进行信号响应[20]。Rudrappa等[11]指出,拟南芥根系分泌物中的苹果酸可强烈诱导芽孢杆菌的趋化性;番茄根系分泌物中的苹果酸和柠檬酸均可诱导解淀粉芽孢杆菌在根际的趋化性[21]。本研究结果表明,烟草根系分泌物及其分泌的草酸、苹果酸、柠檬酸和琥珀酸均对芽孢杆菌S2-1和SNSY15-5具有正趋化性。其中苹果酸对芽孢杆菌S2-1和SNSY15-5的趋化性影响最大,该结果与之前的研究结果一致[9]。究其原因,有机酸引起的细菌趋化性可能是有机酸在作为营养物质影响细菌趋化性的同时,作为三羧酸循环的中间产物,如苹果酸及柠檬酸,又影响细菌自身的三羧酸循环[22]。
生物膜是细菌借助自身产生的多糖、蛋白质和DNA等胞外基质的黏附力而在液体、固体等介质的接触面形成的多细胞群体。生物膜中的细菌能够共享水分、氧气和营养物质,比游离状态的细菌具有更强的环境适应性,有利于细菌自身抵御外界不良环境,保持其生防能力。枯草芽孢杆菌生物膜形成能力越强,防治植物病害效果越显著[23]。本研究发现,加入K326根系分泌物均可明显促进S2-1和SNSY15-5生物膜成膜基因epsD、yqxM、kinC表达,而草酸和柠檬酸分别对S2-1和SNSY15-5生物膜成膜起到促进作用。系列研究结果表明,植株根系分泌物可促进芽孢杆菌生物膜形成,如番茄根系分泌物通过依赖于传感器组氨酸激酶KinD,从而显著促进Bacillussubtilis生物膜的形成[24]。另一方面,根系分泌物中的苹果酸和柠檬酸可诱导芽孢杆菌属微生物成膜基因的表达[21],Rudrappa等[11]发现,根系分泌物中的苹果酸可诱导BacillussubtilisFB17菌株的yqxM基因的表达,进而影响了生物膜形成中多聚物的生成;0.5~5 mmol·L-1的L-苹果酸主要通过影响芽孢杆菌KinD-SpoOA通路,间接影响芽孢杆菌的生物膜形成[24];柠檬酸也能较好地促进BacillusamyloliquefaciensSQR9的生物膜形成[25]。本研究结果再次证明了烟草根系分泌物及其分泌的柠檬酸对根际部分芽孢杆菌生物膜的形成具有正调控作用。
本研究还发现草酸对生防细菌趋化、生物膜成膜起到促进作用,已有研究结果表明,草酸可作为提供给细菌的营养物质和信号分子,对贝莱斯芽孢杆菌S3-1[26]和烟草青枯病菌R.solanacearum[27]呈现较强的吸引作用;但Anang等[28]的研究结果指出,草酸有毒的特性会减少细菌的数量,从而表现为草酸对细菌的吸引作用并不很强。本研究结果与Wu等[27]的研究结果一致,证明了草酸可促进部分芽孢杆菌在植株根际的定殖。
4 结论
本试验分离得到两株对烟草根黑腐病菌T.basicola有较高拮抗活性的烟草根际芽孢杆菌S2-1和SNSY15-5,其脂肽粗提物对T.basicola毒力较强;SNSY15-5含有参与脂肽类家族细菌素(bacteriocin)、生物素操纵子(operon)和假定蛋白(yngG)合成的基因;S2-1菌株中含有参与脂肽类家族生物素操纵子(operon)合成的基因;烟草根系分泌物产生的苹果酸对S2-1和SNSY15-5有较强吸引作用;烟草品种K326根系分泌物及其草酸可促进S2-1生物膜形成,而K326根系分泌物及其柠檬酸则促进SNSY15-5生物膜形成;综合说明芽孢杆菌S2-1和SNSY15-5具有较好的生防应用潜力。

