急性缺血性脑卒中取栓术后平板CT 扫描对出血的预测价值
刘邦勇 潘晓虎 朱发勇 陈雪梅 刘增辉 刘圣 施海彬
机械取栓因其较高的血管再通率和显著改善临床预后,已成为合并大血管闭塞的急性缺血性脑卒中(acute ischemic stroke,AIS)的一线治疗策略[1]。然而,出血作为机械取栓的常见并发症,发生率为21.4%~65.6%,可能会抵消机械取栓的获益甚至导致严重不良预后[2,3]。此外,既往研究表明约80%的出血发生在再灌注治疗的12 h 内[4]。鉴于机械取栓后的早期管理(例如积极的血压控制)有机会改善临床结局,因此尽早确定机械取栓术后出血的高危患者显得尤为重要。
基于DSA 机器的平板CT 扫描可用于在血管内介入后立即检测围手术期并发症,而无需将患者转移到CT 室[5]。尽管平板CT 的分辨率不及多排探测器,但临床实践证明,平板CT 同样能够提供质量足够好的图像来区分高密度病变[6]。然而,这项技术在判断机械取栓术患者出血时遭遇了挑战,因为高密度的存在可能是单独的对比剂渗出和/或伴出血。既往的小样本研究表明,平板CT 上高密度征存在可以预测出血,具有较高的阴性预测值,然而阳性预测值和特异性较低[7,8]。除此以外,先前的研究仅关注到平板CT 上是否存在高密度征对出血的预测价值及高密度病变影像学特征(包括CT 值、是否存在占位效应)等,是否能进一步提高平板CT 扫描对出血的预测价值仍未可知。本研究旨在评估机械取栓术后即刻平板CT 扫描高密度征及其影像学特征对AIS 患者出血的预测价值。
资料与方法
1.一般资料
回顾性收集2019 年1 月~2021 年12 月接受机械取栓治疗的AIS 患者临床资料。纳入标准:(1)术前CTA 证实存在颅内大血管急性闭塞(包括颈内动脉、大脑中动脉M1/M2 段、椎基底动脉);(2)年龄超过18 岁;(3)美国国立卫生研究院脑卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分超过6 分;(4)发病6 h 内能够进行血管内治疗或6~24 h 头颅CT 灌注图像提示存在大片“不匹配”[1,9];(5)取栓后立即接受平板CT 和后续随访头颅CT 或MRI 检查。由于运动或其他伪影而导致平板CT 图像质量较差的患者被排除在外。记录流行病学信息、中风严重程度、平板CT 影像学特征和后续随访影像学数据。
2.机械取栓
机械取栓治疗在局部麻醉或镇静下进行。取栓技术包括:支架取栓(Solitaire AB 支架,美国ev3)、大腔抽吸导管抽吸取栓(6F Sofia Plus 导管,日本Terumo;6F Navien 导管,美国ev3)以及联合抽吸和支架取栓。当多次(>3 次)取栓尝试后,闭塞血管仍未实现成功再通时,取栓医师根据判断可进行补救性球囊血管成形术、支架置入术;位于6 h 动脉溶栓时间窗内的患者,还可给予5~20 mg重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)/10~40 万单位尿激酶溶栓治疗。术毕进行血管造影以评估靶血管最终再通结果。使用脑梗死改良溶栓(modified thrombolysis in cerebral infarction,mTICI)评分,成功再通定义为闭塞血管再通达到2b 或3 级[10]。对比剂使用同前CTA 检查,采用碘克沙醇(320 mg I/ml,GE 医疗)。
3.平板CT 图像采集
平板CT 图像是基于单板探测器DSA 系统(Siemens)上获得,在机械取栓手术结束后基于DSA系统即刻行CT 扫描。使用以下参数获得CT 图像:电压84 kV;管电流253 mA;采集时间11.6 毫秒/帧;投影在48 cm 大小的平板上;角度和帧速:每帧0.4°,每秒30 帧;总角度196°;曝光时间20 s。
4.影像学随访及观察指标
选取平板CT 高密度征最亮层面作为兴趣区(region of interest,ROI)勾画层面。采用圆形ROI(1 cm2),放置于待测高密度征的中心区域,记录ROI 内CT 值,重复测量3 次取其平均值作为最终CT 值。根据欧洲急性卒中合作研究(European Cooperative Acute Stroke Study,ECASS)的 标 准[11],脑实质内出血包括:出血性梗死(hemorrhagic infarction,HI)1 定义为梗死边缘的小瘀点;出血性梗死2(HI2)为梗死区域内融合的斑片状,但无占位效应;实质血肿(parenchymal hematoma,PH)1,梗死区域内边缘锐利的血肿,不超过梗死体积的30%,并有轻微的占位效应;实质血肿2(PH2)梗死区域内边缘锐利的较大血肿,超过梗死体积的30%,并有显著的占位效应。高密度征定义为在平板CT 扫描显示脑实质区域内存在异常高密度征。占位效应:高密度征导致局部脑沟、脑池、脑室变窄或闭塞,中线结构向对侧移位。本研究参照上述出血的分类,平板CT 上的介入后脑内高密度(postinterventional intracerebral hyperdensity,PCHD)被分为PCHD-1、PCHD-2、PCHD-3 和PCHD-4。PCHD-3 和PCHD-4 指的是实质性高密度病变,且具有占位效应。术后24 h、72 h 及5~7 d 常规行头颅CT 检查,当出现神经功能恶化时,即刻复查头颅CT,以判断有无颅内出血等并发症。如果在取栓术后的第一次头颅影像学检查上存在高密度征,则在接下来的24 h 内重复CT 扫描,与对比剂外渗鉴别[12]。出血的观察时间窗为术后5~7 d,依据头颅CT 平扫结果判断。临床预后:依据90 d 改良Rankin 量表(modified Rankin scale,mRS)评分,良好预后定义为卒中后90 d 上述评分0~2 分[13]。
5.统计分析
采用SPSS 26.0 软件对两组患者资料进行统计学分析。符合正态分布的连续变量显示为均数±标准差,两组间比较采用独立样本t 检验。不符合正态分布的连续变量描述为中位数(四分位数)[M(P25,P75)],组间比较采用Mann-Whitney U 进行统计分析。分类变量采用频率和百分比描述,组间采用卡方检验进行统计分析。评估平板CT 预测出血的总体准确度,包括敏感度、特异度、阳性预测值和阴性预测值。此外,采用受试者工作特征(receiver operating characteristic,ROC)曲线评估平板CT 高密度征对出血的预测价值。曲线下面积(area under curve,AUC)代表预测准确度的测量值,并计算95%可信区间(confidence interval,CI)。双侧检验P<0.05 被认为具有统计学差异。
结果
1.一般资料
研究期间内共纳入108 例患者。平均(68.2 ±12.3)岁,男61 例(56.5%)。中位基线NIHSS 评分15(10~22)分,34 例(31.5%)患者于血管内治疗前接受了静脉溶栓治疗。就血管闭塞部位而言,5 例(4.6%)颈内动脉串联大脑中动脉闭塞、26 例(24.1%)颈内动脉颅内段闭塞、70 例(64.8%)大脑中动脉M1 段闭塞以及7 例(6.5%)大脑中动脉M2 段闭塞。术毕,闭塞血管成功再通98 例(90.7%)。39 例(36.1%)经随访头颅CT 检查证实发生出血。在90 d 的随访,53 例(49.1%)获得良好预后,11 例(10.2%)死亡(表1)。
2.两组患者特征比较
根据平板CT 检查结果,其中58 例(53.7%)出现高密度征。除基线阿尔伯塔卒中项目早期CT评分(Alberta Stroke Program Early CT Score,ASPECTS)(P=0.010)、血管闭塞部位(P=0.039)和成功再通率(P=0.037)外,两组的基线特征无显著差异。平板CT 高密度征组中34 例(58.7%)通过随访头颅影像学检查证实发生出血,显著高于平板CT 非高密度征组患者(10.0%,5/50)(P<0.001)。同时,在共计39 例出血患者中,绝大部分位于平板CT高密度征组(34/39,87.2%),非高密度征组仅5 例(5/39,12.8%)。平板CT 高密度征预测出血的敏感度87.2%,阴性预测值90.0%。图1~4 展示了4 例机械取栓术后即刻平板CT 和后续头颅CT 检查的患者图像。
3.平板CT 高密度征与出血相关性分析
进一步将平板CT 上具有高密度征的患者按照后续是否发生出血,分为出血组和非出血组。出血组高密度征的CT 值显著高于非出血组(125 HU 比93 HU,P=0.002)。基于ROC 曲线,高密度征预测出血的CT 值最佳截断值为96.5 HU,敏感度76.5%,阳性预测值72.2%,AUC 0.74(95%CI:0.61~0.87)。此外,出血组中高密度征的占位效应比例同样高于非出血组(67.6%比12.5%;P<0.001)。并且,高密度征的占位效应预测出血时,其AUC 0.78(95%CI:0.66~0.90)。在高密度征患者中,使用CT 值联合占位效应预测出血时,AUC 0.83(95%CI:0.72~0.93)。CT 值大于96.5 HU 和占位效应的联合评估增加了预测出血的特异度和阳性预测值。假阳性从仅使用平均CT值大于96.5 HU 时的34.8%降低到使用联合评估的8.3%(表2,图5)。
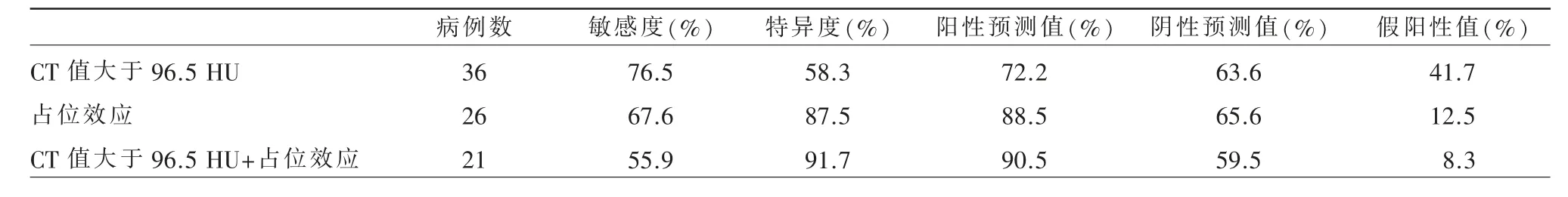
表2 平板CT 参数对出血的预测能力

图5 采用ROC 曲线评估平板CT 高密度病变影像学特征预测出血的准确度。单独CT 值(AUC=0.74)或占位效应(AUC=0.78)与联合CT 值和占位效应(AUC=0.83)
讨 论
机械取栓术能够快速高效地开通闭塞血管从而显著改善患者临床预后,已被列为AIS 患者的一线治疗方法[1]。取栓术后出血是AIS 患者再灌注治疗后常见的并发症,并且与患者不良预后明确相关[2,3]。早期识别机械取栓术后出血高风险患者将对指导治疗方案及改善临床预后至关重要。
AIS 患者接受机械取栓术后的随访CT 检查中经常可见高密度征,且高密度征提示出血的风险增加[14,15]。然而随访CT 检查不利于早期识别出血高风险患者。基于DSA 机器的平板CT 图像质量足够高,可用于即刻检测血管内介入后的并发症,而无需将患者转移到CT 室。既往的小样本研究表明,术后即刻平板CT 上高密度征的存在可以预测机械取栓术后出血,具有较高的阴性预测值[7,8],然而特异度和阳性预测值较低。考虑到既往研究仅关注到平板CT 上是否存在高密度征对出血的预测价值及高密度病变影像学特征(包括CT 值、是否存在占位效应)等,能否进一步提高平板CT扫描对出血的预测价值,尚无相关研究报道。
本研究同样发现平板CT 高密度征预测机械取栓术后AIS 患者的出血,具有较高的敏感度(87.2%)和阴性预测值(90.0%)。作为血液循环系统与神经系统之间的动态界面,血脑屏障支配着神经细胞功能所需的生物物质的流入和流出[16]。当发生缺血性卒中,血脑屏障损伤在靶血管闭塞后立刻出现,同时血脑屏障破坏程度与AIS 的时间长短和严重程度有关[16]。当血脑屏障破坏相对轻微时,由于渗透性增加,对比剂开始外渗,但是随着缺血、再灌注损伤的进展,血脑屏障损伤进一步加重,导致对比剂和血液成分大量外渗[17,18]。这些病理变化代表了梗死大脑区域中微血管通透性和完整性的不同程度的损伤[19]。虽然对血脑屏障的有限损伤会导致不合并出血的单纯对比剂外渗,但血脑屏障的功能退化可能代表随后发生实质出血的风险更高[20]。因此,不难解释为什么在平板CT 上出现高密度征的患者比没有高密度征的患者发生出血的概率更高。在本研究中,绝大多数出血(87.2%,34/39)是发生于高密度征组患者。相对应的,只有12.8%(5/39)的出血发生于无高密度征组患者。
到目前为止,平板CT 上高密度征的CT 值对出血的预测价值尚无定论[7,8]。本研究发现高密度征的CT 值是出血的重要预测指标(P=0.002)。较高的CT 值可能反映了对比剂和/或血液成分的大量外渗,表明血脑屏障的严重损伤和随后的出血高风险。除此以外,本研究还发现出血组平板CT上的高密度征占位效应比例显著高于非出血组(67.6%比12.5%;P<0.001)。有文献表明,当血脑屏障损伤较轻时,主要的外渗成分是对比剂,其通常无占位效应,在随访过程中会很快被吸收[12]。当血脑屏障损伤进一步加重时,直径较大的红细胞也会渗出。脑实质中大量红细胞聚集并凝固,边缘锐利,可引起显著的占位效应[18,19,21]。在高密度征患者中,采用CT 值和占位效应相结合的评估方法增加了预测出血的特异度和阳性预测值。假阳性从仅使用CT 值大于96.5 HU 时的34.8%降低到使用联合评估时的8.3%。当在平板CT 上出现高密度征时,应延迟使用抗血小板和抗凝药物,直到进行下一次随访CT 检查以排除出血。神经重症监护,尤其是严格的围术期血压管理是这些患者降低出血风险的另一个重要考虑因素。无论取栓后平板CT 上高密度征的真实起源是什么,高密度征的存在与后续较高风险的出血相关,尤其是那些合并高CT 值和占位效应的高密度征。平板CT 扫描能早期预测那些处于高出血风险的患者群体,可能有助于尽早调整治疗方案,改善预后。
本研究同样存在一些局限性:(1)单中心回顾性研究,且研究人群样本量较小,不可避免地存在选择偏倚。(2)部分患者由于缺乏平板CT 扫描而不得不被排除在本研究之外。(3)考虑到后颅窝区域CT 平扫图像骨性伪影较多,不利于判断高密度征,因此后循环卒中患者未纳入本研究。
总之,平板CT 扫描是一种简单有效的技术,使用简单快捷的评估参数(高密度征)达到术后即刻预测AIS 患者机械取栓术后的出血风险。本研究发现当联合CT 值和占位效应评估时,平板CT 预测高密度征进展为出血的能力得到进一步提高。