卵巢恶性Brenner 瘤两例报告
黄文鹏 李莉明 宋乐乐 孙昕瑶 高剑波 康磊
Brenner 瘤是一种少见的起源于卵巢表面上皮的肿瘤,约占所有卵巢上皮性肿瘤的5%[1]。病理上分为良性、交界性/非典型增生性、恶性三型,其中恶性Brenner 瘤更为罕见[2,3],国内外鲜有报道。与卵巢其他肿瘤鉴别困难,临床上易误诊。本文报道2 例卵巢恶性Brenner 瘤,介绍其诊疗经过及影像学特点,以加强对本病的认识。
病例资料病例1,患者,女,76 岁,因发现腹盆腔包块1 年余就诊。患者1 年前无明显诱因发现腹腔包块,无腹胀、腹痛等症状,自发病以来食欲、睡眠欠佳,大小便正常,体重下降10 kg。既往高血压病史20 年,无家族性遗传病史,已绝经。查体:腹部膨隆,无腹壁静脉曲张,无压痛、反跳痛,全腹部触及包块,大小约25 cm×23 cm×22 cm,质软,固定。实验室检查:血红蛋白80.0 g/L,血小板计数360×109/L,肿瘤相关抗原19-9 升高:152.60 U/ml,人附睾蛋 白4(human epididymis protein 4,HE4)升 高:165 pmol/L。影像检查:(1)超声:全腹内可见巨大囊性包块,内可及分隔。(2)CT:腹盆腔内见巨大多囊性低密度肿块,边界清楚,内见分隔、钙化,并见结节向囊内突起,增强后分隔及结节明显强化,腹腔脏器受压移位(图1a~1c);考虑卵巢囊腺癌。患者全麻下行腹腔巨大肿块切除和双侧附件切除术,术中见腹腔内少量淡黄色腹腔积液,左侧卵巢见大小约30 cm×25 cm×25 cm 多囊性包块,质硬,包膜完整,内包含咖啡色浑浊液体,与周围组织无明显粘连,部分囊壁实性增厚,形成灰白灰红色乳头状突起,壁厚0.2~0.4 cm。术后病理:光镜下见上皮细胞层次增多,核异型性,核仁明显,核分裂像易见(图1d)。病理诊断:(左侧卵巢)恶性Brenner 瘤。
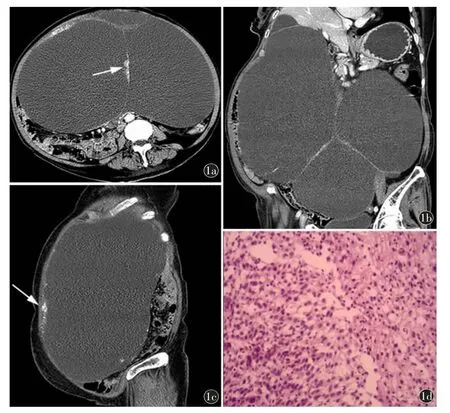
图1 女,76 岁,左侧卵巢恶性Brenner 瘤。a)CT 静脉期轴位示增强后分隔及结节明显强化(箭);b)CT 静脉期冠状位示病灶巨大,腹腔脏器受压移位;c)CT 静脉期矢状位示病灶边界清楚,边缘见钙化(箭);d)镜下见上皮细胞层次增多,核异型性,核仁明显,核分裂像易见(HE 染色,×200)
病例2,患者,女,62 岁,因发现盆腔包块2 d 就诊。患者1 个月内因胃部不适于当地医院体检发现盆腔包块,自发病以来大小便正常,体重下降5 kg。既往体健,无家族性遗传病史,已绝经。查体:右附件区触及大小约10 cm 包块,质韧,固定。实验室检查:白细胞计数11.10×109/L,红细胞计数2.95×1012/L,血红蛋白87.0 g/L,血小板计数384×109/L,白蛋白22.7 g/L,肿瘤相关抗原19-9:165.7 U/ml,肿瘤相关抗原125 升高:235.5 U/ml,癌胚抗原升高:20.8 μg/L。影像检查:(1)超声:盆腔内可及范围约11.6 cm×8.0 cm 不均质回声区,边界清楚,形态不规则,部分呈中等回声,部分呈无回声,呈蜂窝样改变,彩色多普勒血流成像(color Doppler flow imaging,CDFI)示内可及条状血流信号(图2a)。(2)CT:盆腔内类圆形软组织肿块,大小约为10.4 cm×12.7 cm,内密度不均匀,见多发分隔,增强后动脉期呈明显不均匀强化,可见丰富滋养血管,静脉期病灶强化呈度略下降,腹膜后未见肿大淋巴结(图2b~2e);考虑卵巢囊腺癌。患者全麻下行盆腔肿块切除术和全子宫及双侧附件切除术,术中见右侧卵巢大小约10 cm×11 cm 肿块,切面灰白灰红,质软至中等。术后病理:光镜下见增生纤维间质内移行肿瘤细胞浸润,巢团状分布,核异型性明显(图2f);免疫组化:AE1/AE3(+),CK7(+),CK20(-),P63(部 分+),P16(+),P53(+),PAX-8(-),ER(部分+),PR(+),CR(灶+),WT-1(-),Ki-67(约70%+)。病理诊断:(右侧卵巢)恶性Brenner 瘤。
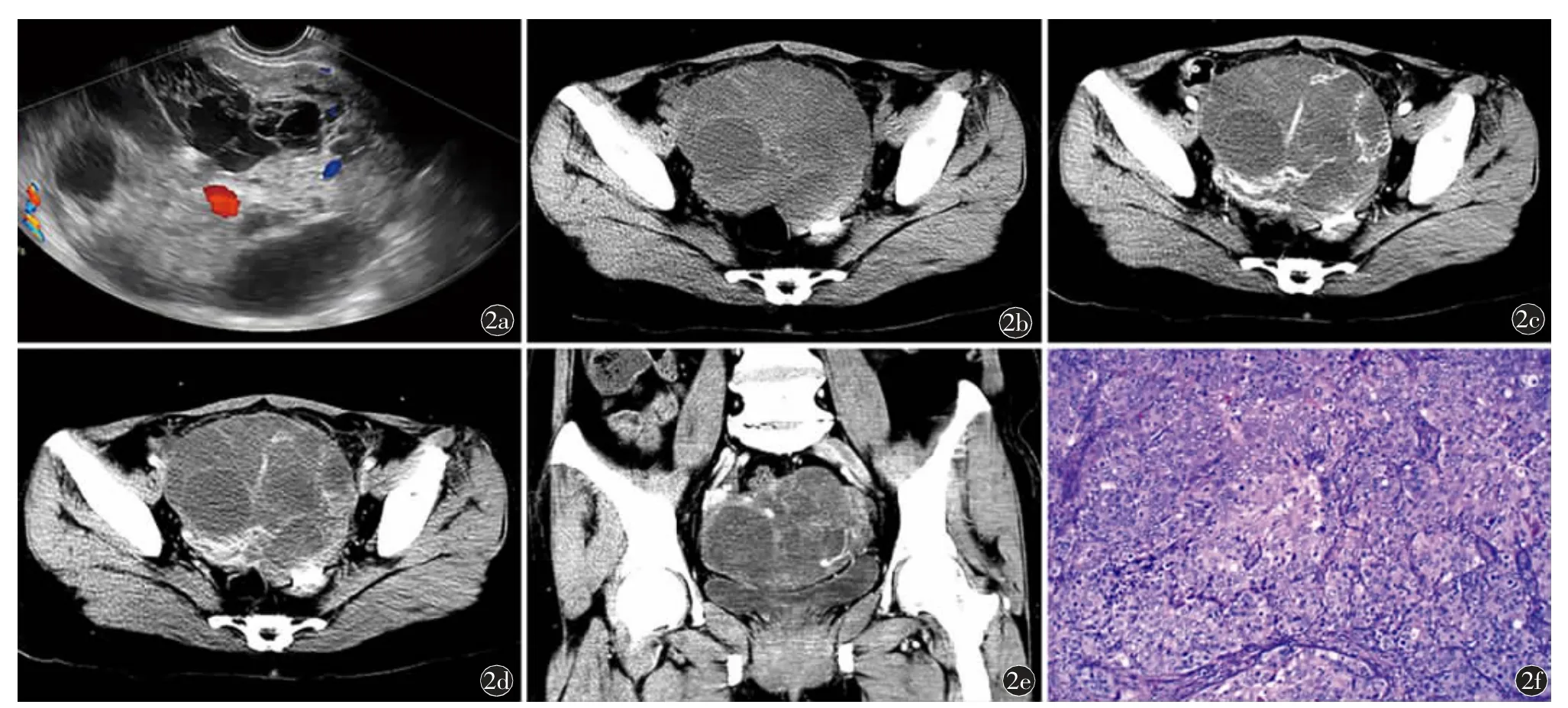
图2 女,62 岁,右侧卵巢恶性Brenner 瘤。a)超声示盆腔内形态不规则回声区,呈蜂窝样改变,CDFI 内可及条状血流信号;b)CT 平扫轴位示盆腔内类圆形软组织肿块,其内密度不均匀;c)CT 动脉期轴位示肿块内多发分隔,增强呈明显不均匀强化,见丰富滋养血管;d)CT静脉期轴位示病灶强化程度略下降;e)CT 静脉期冠状位示病灶边界清楚,周围无增大淋巴结;f)镜下见增生纤维间质内移行肿瘤细胞浸润,巢团状分布,核异型性明显(HE 染色,×100)
讨论1.卵巢恶性Brenner 瘤的定义和临床表现
卵巢Brenner 瘤起源于卵巢表面上皮,因其组织与尿路移行上皮细胞相似,又称为移行细胞肿瘤,主要见于围绝经期和绝经后女性。恶性Brenner 瘤常发生于单侧卵巢,可见于任何年龄,其中40~50 岁女性多见,临床表现与其他恶性卵巢肿瘤相似,包括腹胀、腹痛、卵巢肿块和异常阴道出血[4-6],无特异性症状,部分患者无自觉症状于体检时或其他原因进行卵巢切除术后偶然发现,也有文献报道恶性Brenner 瘤可出现破裂[7]。万桃等[8]在综述中提出CA125在约70%的卵巢Brenner 瘤病例中升高。亦有报道称HE 4、D-二聚体、纤维蛋白原和CA199 等指标也会在卵巢Brenner 瘤病例中异常升高[9]。但目前还没有可靠的特异性肿瘤标志物用于诊断[8]。
2.卵巢恶性Brenner 瘤的发病机制和病理
卵巢Brenner 瘤的发病机制尚未明确,多数认为卵巢表面上皮通过移行上皮化生。而Kuhn 等[10]提出其起源于输卵管浆膜间皮和输卵管上皮交界处的移行细胞化生(输卵管腹膜连接处的Walthard 细胞巢),并且可能与雄激素刺激有关。典型的卵巢Brenner 瘤多呈实性,少数为囊实性,切面呈纤维状,偶尔因钙化沉积而质硬。镜下由形态学上类似于尿路移行细胞的上皮细胞以及纤维结缔组织组成[11],可囊性变。当良性/交界性Brenner 瘤中出现出血和坏死区时,需警惕有无恶性可能。恶性Brenner 瘤具有明确的恶性特征,可同时包含恶性和良性/增生性成分,存在明显的间质浸润和高度的细胞学非典型性,病理性核分裂像多见。间质浸润有时难以判断,促结缔组织增生反应对浸润灶的判断有帮助[12]。恶性Brenner 瘤表达多种尿路上皮癌的免疫组织化学标志物,包括CK7、P63、GATA3、Uroplakin III、S100 和血栓调节蛋白阳性表达。亦有文献报道MDM2 扩增和P16 表达缺失可能在Brenner瘤恶变的过程中起作用[1]。
3.卵巢恶性Brenner 瘤的影像表现分析
卵巢Brenner 瘤在超声上表现为实性或囊实性的低回声肿块,伴“蛋壳样”钙化[13],后方见扇形声影,良性血流不丰富,恶性Brenner 瘤的实性部分呈低阻血流,阻力指数可能有利于良恶性的鉴别[13]。CT 上良性Brenner 瘤形态可呈圆形、椭圆形、不规则或分叶状,实性肿块内粗大的无定形钙化伴轻度强化是典型的CT 表现[14],囊性成分以外生型为主,囊液成分单一均匀。恶性Brenner 瘤多为囊实性,呈分叶状,病灶成分相对较为复杂,囊壁可见附壁结节,也可出现周围组织侵犯征象,盆腔内有时见肿大淋巴结[15]。目前不确定的附件肿块采用卵巢附件MR肿瘤风险评分(ADNEX MR/O-RADS 分级)[16],此两例缺少MRI 检查较为遗憾,CT 对于卵巢肿块的定性不够理想,却是显示钙化的最佳方法[4]。本文患者1 病变呈多发囊性改变,囊变位于病灶中心,边缘见斑片状钙化,增强后分隔及结节明显强化,患者2 病变的边缘及分隔的实性成分呈明显强化,内见丰富滋养血管,这可能与肿瘤生长速度较快,肿瘤血供随恶性程度升高而增加有关,CT图像上倾向于卵巢来源的恶性肿瘤。卵巢Brenner 瘤可合并Meig’s 综合征[14],但本文2 例患者均未发现胸腔积液及腹腔积液存在。当囊实性病变中出现混合性点状钙化、病灶周围增粗迂曲血管,增强表现为快速而持续性的强化时,应考虑恶性Brenner 瘤的可能。卵巢恶性Brenner 瘤需与囊腺癌、颗粒细胞瘤和卵巢转移瘤(Krukenberg 瘤)相鉴别。囊腺癌表现为附件区囊实性肿块,边界不清,囊壁不均匀增厚,伴有多发结节和间隔,常伴有腹膜腔种植转移。颗粒细胞瘤的囊变多呈“蜂窝状”,钙化少见,常伴雌激素升高及子宫内膜增生。Krukenberg 瘤常表现为卵圆形的实性或囊实性肿块,边界清楚,实性部分及囊壁也可明显强化,通常为双侧发病,多伴有原发恶性胃肠道肿瘤,常伴有腹部和盆腔积液或转移,钙化极少见。
4.卵巢恶性Brenner 瘤的治疗
手术是卵巢恶性Brenner 瘤的主要治疗方法,与其他卵巢上皮癌类似,多数恶性患者诊断时多处于早期,行全面分期手术,预后较好,根据患者年龄及生育需求进行选择行肿瘤剥除术、附件切除及全子宫和双附件切除术。当出现远处转移如腹腔转移时,晚期患者已失去手术时机,应行肿瘤细胞减灭术,预后不良[6,17]。恶性Brenner 瘤的淋巴结转移少见,即使发生淋巴结转移,淋巴结清扫无法提高生存率,因此恶性Brenner 瘤患者是否常规行淋巴结清扫术仍未明确[18]。在一项小型的回溯性研究中,术后使用铂类化疗药物加紫杉醇显示了生存益处[19],与其他上皮性卵巢癌的疗法一致。术后放疗的作用在很大程度上仅限于肿瘤复发后的姑息治疗和局部控制。
综上所述,恶性Brenner 瘤罕见,与其他恶性卵巢肿瘤的表现重叠,其影像特征无特异性。当囊实性病变中出现混合性点状钙化、周围出现增粗迂曲血管,增强表现为快速而持续性的强化时,应考虑恶性Brenner 瘤的可能。在卵巢肿瘤的术前评估中,虽然CT 检查对于卵巢肿块的定性不是理想的成像技术,但是显示钙化优势明显,也可评估肿瘤邻近器官和组织的侵袭,确定是否存在盆腔积液、腹腔和淋巴结转移,并为临床分期提供依据。

