抗肠球菌生物膜药物的研究进展
曹阳 赵建平
摘要:肠球菌已成为难以治疗的院内和社区获得性感染的主要原因之一。形成生物膜的肠球菌可以显著降低细菌对抗生素的敏感性,逃避宿主的免疫系统攻击,导致感染时间延长。因此开发新药物来应对抗肠球菌生物膜这一挑战是非常有必要的,本文就抗肠球菌生物膜的几种药物进行综述,以期为临床提供指导。
关键词:肠球菌;生物膜;抗感染;抗生物膜,新型药物
中图分类号:R978.1 文献标志码:A 文章编号:1001-8751(2023)04-0224-06
Research Progress of Anti-Enterococcal Biofilm Drugs
Cao Yang1,Zhao Jian-ping2
(1 Inner Mongolia Clinical Medical College, Inner Mongolia Medical University, Hohhot 010050;
2 Department of Laboratory Medicine, Inner Mongolia Peoples Hospital, Hohhot 010000)
Abstract:Enterococcus has become the main cause of hospital-acquired and community-acquired infections that are difficult to treat. The biofilm-forming Enterococcus can significantly reduce the sensitivity of bacteria to antibiotics and evade the host's immune system attack, resulting in prolonged infection time. Therefore, it is necessary to develop new drugs to deal with the challenge of Enterococcus biofilm. This article reviews several drugs against Enterococcus biofilm in order to provide guidance for clinical practice.
Key words:Enterococcus; biofilm; anti-infection; anti-biofilm; new chemotherapeutics
肠球菌属革兰阳性菌,广泛存在于环境以及人、动物消化道内,能够在高盐(6.5% NaCl)、碱性(pH 9.6)、40%胆汁培养基、10~45 ℃等环境下生长,对多种环境具有高度耐受性,这有助于其在不同的宿主内定植并在环境中持久存在[1]。由于其在社区和医院恶劣环境中生存的能力,以及固有的和获得性的抗生素耐药机制,肠球菌已成为难以治疗的院内和社区获得性感染的主要原因之一[2]。在欧洲和美国,肠球菌属是第二常见的与卫生保健感染相关的病原体[3]。根据2016—2020年中国细菌耐药监测网CHINET数据显示,肠球菌属细菌在革兰阳性菌中的分离率仅次于金黄色葡萄球菌,居第二位[4-7]。
肠球菌形成生物膜的能力增强了其对抗生素的抵御能力。越来越多的证据证明生物膜形成在肠球菌感染中的关键作用[8]。生物膜是指许多细菌作为附着在表面的复杂群落的一部分存在,嵌入到细菌自己形成的聚合物基质中[9]。这种结构可以显著降低细菌对抗生素的敏感性,逃避宿主的免疫系统攻击,导致感染时间延长[10]。欧洲地区报道肠球菌生物膜阳性率达(60%~90%),我国学者丁丽等[1]发现粪肠球菌和屎肠球菌生物膜阳性率分别为63.46%与13.33%;Zheng等[11]报道的粪肠球菌生物膜阳性率为50.4%。因此,迫切需要开发新的药物来应对这一挑战。本文就抗肠球菌生物膜药物的研究进展进行综述,旨在为临床抗肠球菌感染提供新思路。
1 抗生素类
1.1 大环内酯类抗生素
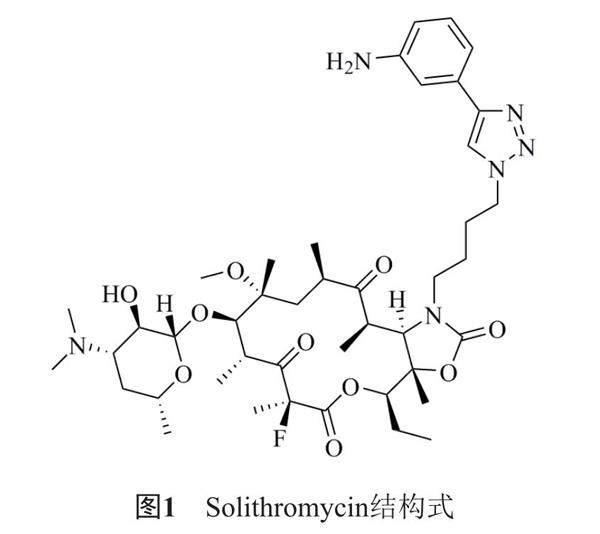
第四代大环内酯类新型抗生素Solithromycin (SOL)对广谱革兰阳性菌表现出较强的抗菌作用和良好的药代动力学/药效学(PK/PD)参数[12-15],结构式见图1。SOL的PK/PD特性和临床研究显示其生物利用度高、副作用小、组织穿透性好、口服后分布量大[14-17]。与红霉素相比,SOL显著提高了对临床粪肠球菌和屎肠球菌分离株的体外抗菌活性,SOL对粪肠球菌生物膜的形成具有抑制作用,其杀菌活性与利奈唑胺和万古霉素相当[18]。但是,SOL能抑制粪肠球菌生物膜的形成,却不能根除,且SOL联合抗生素并没有增强其杀菌活性。所以SOL应用于肠球菌生物膜的治疗还比较局限。
1.2 新型酮内酯类抗生素
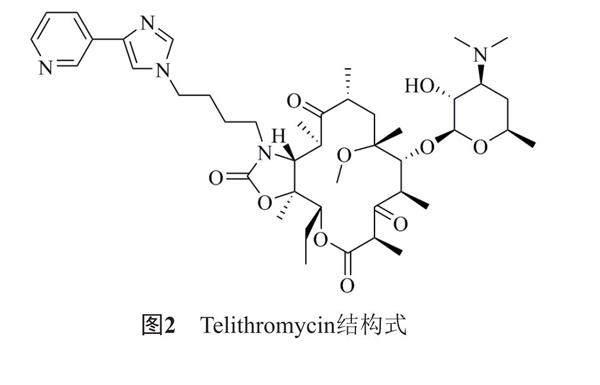
Telithromycin是一种新型酮内酯类抗菌药物,可用于治疗呼吸道感染,结构式见图2。也有研究Telithromycin对肠球菌的疗效[19],并已被证明对肠球菌比一些第一代和第二代的大环内酯类抗生素更有效[20]。对来自中国的临床肠球菌分离株分析,发现Telithromycin 可以抑制粪肠球菌生物膜的形成,与氨苄西林联用还可以增强抗菌作用和抗生物膜活性[21]。研究表明,涉及关键呼吸道病原体的呼吸道感染的治疗,每日一次800 mg口服剂量的Telithromycin在血浆中即可保持有效浓度[22]。因此,Telithromycin/氨苄西林联合可能是治疗肠球菌生物膜感染的潜在方法。越来越多的证据表明,通过临床使用Telithromycin产生耐药性的可能性较低[21]。并且Tedizolid对耐利奈唑胺的粪肠球菌也表现出抑菌活性[23]。但是目前关于Telithromycin对肠球菌的杀伤动力学和抗生素后效应的研究有限,Telithromycin治疗肠球菌的最佳剂量方案还需要进一步研究。
虽然SOL的PK/PD特性好,但是它不能根除已经形成的生物膜,它的杀菌活性与利奈唑胺和万古霉素相当,也没有发现它与其他抗生素有协同作用。并且它对广谱革兰阳性菌活性较强,大规模使用可能会产生耐药,笔者认为它的开发价值不大。而Telithromycin与氨苄西林联合使用对我国分离的肠球菌有较好的抗菌和抑制生物膜的作用,并且,临床使用耐药性低,对耐利奈唑胺的粪肠球菌也表现出抑菌作用,所以Telithromycin有潜力成为抗肠球菌生物膜的药物。
2 植物提取物
2.1 木犀草素
木犀草素(Luteolin)是一种天然类黄酮,存在于花生壳和多种植物中,如水果、百里香、薄荷、欧芹、芹菜和青椒,其药理潜力包括抗氧化和抗炎活性[24-25]。木犀草素可以抑制细胞黏附和附着,以剂量依赖性的方式通过降低生物膜内胞外多糖和蛋白质的产量,阻断生物膜的形成,还能提高生物膜对抗生素的敏感性,进而提高抗菌治疗效果[26]。
2.2 甘草查尔酮A
甘草查尔酮A(Licochalcone A, Lic)是从甘草中提取的一种具有抗氧化、抗血管生成、抗炎症和抗肿瘤作用的新型黄酮类化合物[27-28]。研究发现,甘草查尔酮A对粪肠球菌具有抗菌活性[29]。亚抑制浓度下,通过抑制粪肠球菌早期黏附和聚集来减少其生物膜的形成,但单独使用或与其他抗菌剂联合使用对已建立的粪肠球菌生物膜均无根除作用;高浓度的甘草查尔酮A通过快速杀死粪肠球菌浮游细胞,减少粪肠球菌持久性细胞的产生提高其对抗生素的敏感性[30]。并且,因为甘草查尔酮A是通过干扰粪肠球菌胞内信号转导或转录调控发挥抗菌作用,所以比利奈唑胺(阻断蛋白质的合成)、万古霉素和氨苄西林(干扰细胞壁合成)更有效[30]。甘草查尔酮A在粪肠球菌中可能有多个靶基因,这使它不容易产生耐药[30]。
这些植物提取物来源于可食用的植物中,比其他化学合成的药物对人体的伤害更小,特别是甘草查尔酮A在高浓度时效果更好,低毒这一特点尤为重要,未来的研究也需要具体评估它们对宿主细胞的损伤作用。
3 生物制剂
3.1 溶菌酶
溶菌酶(1,4-β-N-acetylmurmidase,LYS)是一种单链碱性蛋白,由129个氨基酸残基组成[31]。作为先天免疫系统的一个组成部分,它能分裂细菌细胞壁中肽聚糖N-乙酰胞壁酸和N-乙酰氨基葡萄糖肽聚糖残基之间的β-1,4糖苷键的断裂[31-33],导致细胞裂解,对体外培养的革兰阴性菌和革兰阳性菌具有广谱抗菌活性[33]。溶菌酶也可以作为阳离子抗菌肽(CAMP),破坏细菌细胞膜的稳定[34]。美国有学者证明了CAMP可以诱导粪肠球菌生物膜的细胞裂解,并且对具有不同耐药性和毒力因子的粪肠球菌不同菌株的生物膜均有效[32]。溶菌酶抗生物膜的效果不仅限于粪肠球菌,未来可能作为一种广谱抗生素应用,并且可以考虑联合其他抗生素使用,以增强对生物膜的破坏效果。
3.2 Rhodethrin
Rhodethrin(Rdn)是一种从光合无氧紫色非硫细菌类球红细菌(Rhodobacter sphaeroides)OU5中分离出来的次生代谢物[35]。它是一种新型的吲哚萜类化合物,具有抗菌、抗生物膜[36]、抗癌、环氧合酶-I抑制和植物激素活性等潜在的生物学应用[35]。Rdn可能通过强烈干扰生物膜相关蛋白GelE和SprE、细胞分裂FtsZ蛋白和LuxS蛋白QS机制来抑制生物膜的形成[37]。将药物与常规抗生素联合使用可能会提高抗菌药物抗菌效果和降低细胞毒性,是一种很有前途的方法。Rdn与氯霉素联合使用可以提高其效率,二者联合使用对粪肠球菌(ATCC 19433)生物膜的形成具有显著的协同作用[37]。
3.3 噬菌体
噬菌体是一种病毒,能在特定细菌内大量复制。有研究发现,一些噬菌体能对抗细菌形成的生物膜[38-42]。近年来,有许多专家学者分离出了针对肠球菌及其生物膜的噬菌体并对其性能进行测试评估,对噬菌体V583抑制和降解耐万古霉素的粪肠球菌生物膜的作用进行1~7 d的测试:在抑制实验中,噬菌体显著减少了长达7 d的生物膜,在降解实验中,噬菌体对1~2 d的生物膜的有效性显著[43];噬菌体S2在较宽的温度和pH值范围内具有较高的稳定性,经口服给药时不被降解,适用于控制人体感染的治疗;在抑制和降解实验中,噬菌体的存在降低了耐万古霉素屎肠球菌生物膜的完整性和黏附性[44]。还分离出一类对粪肠球菌具有裂解活性的噬菌体,它们有能力穿透生物膜到达宿主细菌细胞并溶解肠球菌生物膜[45]。这项能力来自于它们尾突蛋白中解聚酶的水解活性或对裂解浮游细胞具有显著活性的内溶素的存在[40,46]。还有的噬菌体与达托霉素和β-内酰胺联合使用可用于根除多药耐药的屎肠球菌生物膜介导的感染,并防止对抗生素和噬菌体耐药性的出现[47]。
作为细菌的天敌,与抗生素相比,噬菌体产生耐药性的过程极慢,它分离容易且快速,一旦有新的挑战,也可以快速修改。并且它具有高度的特异性,对人体细胞安全,是对抗肠球菌生物膜一种不错的思路。
4 药物再利用
4.1 五氟利多
五氟利多(Penfluridol,PF)是一种经FDA批准的口服长效抗精神病药,用于治疗急性精神病、精神分裂症和妥瑞特综合征[48]。它可以抑制胶质母细胞瘤、乳腺癌、胰腺癌和肺癌细胞的生长和转移[49-52]。有文献报道,PF在体内对粪肠球菌有明显活性,可以导致粪肠球菌生物膜生物量显著减少[10]。共聚焦激光扫描显微镜(CLSM)观察发现PF是通过杀死细菌和降低细胞外基质来达到根除生物膜效果的,还可能是通过影响群体感应系统和第二信使c-di-GMP的调控,进而影响粪肠球菌生物膜[10]。但由于生物膜背后的抗菌机制复杂,PF抑制粪肠球菌生物膜并去除成熟生物膜的机制尚不清楚,有待进一步研究。众所周知,联合用药可以提高抗菌效果、减少抗生素耐药机会并降低细胞毒性。研究表明[10],PF与阿米卡星和庆大霉素具有部分协同抑菌作用,与万古霉素和替考拉宁具有相加抑菌作用,并且还可以减少这些抗生素的副作用和产生耐药性的机会。在安全方面,有文献报道[53],每周口服30 mg(小鼠模型12.5~25 mg/kg)治疗急性精神病患者;大于60 mg/d(小鼠模型25~50 mg/kg)用于精神分裂症的治疗[54],均无副作用。研究表明[55],长期给药PF对小鼠的行为活动没有显著影响。此外,有学者通过评估体重、器官重量和血浆转氨酶(ALT和AST),报告PF即使长期使用也是相对安全的[50]。因此,PF有成为抗肠球菌药物的潜力,但在临床应用前,还需要进一步地研究,以增强抗菌作用,同时降低细胞毒性。
4.2 双硫醇
双硫醇(Bithionol,BT)是一种临床批准的驱虫药物,在体外和体内可以通过破坏细菌细胞膜脂质双分子层对耐甲氧西林金黄色葡萄球菌(MRSA)及其持久性细胞具有活性[56]。BT在体外通过破坏肠球菌的细胞膜对肠球菌表现出有效的抗菌活性(屎肠球菌强于粪肠球菌)和抑制其生物膜形成能力,并能根除预先形成的生物膜,且耐药率极低[57]。此外,BT还可以有效地杀死对DAP(美国食品和药物管理局批准的针对细菌细胞膜的抗生素)耐药的粪肠球菌和屎肠球菌临床菌株[57]。BT还可以与头孢曲松、替考拉宁等多种常规抗生素产生协同作用,这可能是由于它能够破坏细菌细胞膜,从而促进其他抗生素渗透到细胞内[57]。当浓度高达64 ?g/mL时,BT可选择性地与细菌细胞膜结合而不影响哺乳动物细胞膜[56]。在一项小鼠体内毒性研究中,即使以240 mg/kg的高剂量治疗30 d以上,BT也是安全的[56,58]。因此,有效的抗菌效果、对哺乳动物低毒性以及耐药率低,使BT有较大的潜力作为一种抗菌药物用于临床。
药物再利用是新抗菌药研发的不错选择,药物部分特性已经清楚,这可以减少研发的时间和经济成本。已经明确,PF和BT的毒性低,安全性较好。研究发现,它们都具有根除已经形成的生物膜的作用,并且可以与其他常规抗生素协同使用,特别是还发现BT不容易耐药。因此,它们有较好的使用前景,值得进一步研究用于临床。
5 讨论
生物膜相关的肠球菌感染不仅难以根除,而且是细菌传播的温床和抗生素耐药基因的储存库。研究发现,SOL和Telithromycin可以抑制肠球菌生物膜的形成,PF和BT可以根除已经形成的生物膜。并且,Telithromycin、PF和BT还可以与其他常规抗生素联合使用,增强抗菌抗膜活性,减少抗生素副作用,降低耐药机会。特别是研究发现,Telithromycin、甘草查尔酮A、BT和噬菌体本身也不容易耐药。还发现木犀草素、甘草查尔酮A、噬菌体、BT和PF的毒性低,对人体伤害小,而且噬菌体、BT和PF的成本低,更有研究潜力。当前肠球菌的用药还主要停留在抗浮游菌和敏感菌阶段,缺乏对肠球菌生物膜形成的检测,预防肠球菌生物膜形成的意识还没有深入临床医生心里。未来需要加强对肠球菌生物膜的检测和预防,对形成机制进行进一步的研究,针对其形成的不同环节进行阻断。同时,进一步研发和改良药物,来根除已经形成的生物膜,还可以考虑已经用于临床的其他药物的再利用,降低药物开发成本。
参 考 文 献
丁丽, 吴旸, 李培, 等. 肠球菌属生物膜表型和基因型相关性分析 [J]. 中国感染与化疗杂志, 2020, 20(2): 157-162.
Kateete D P, Edolu M, Kigozi E, et al. Species, antibiotic susceptibility profiles and van gene frequencies among enterococci isolated from patients at Mulago National Referral Hospital in Kampala, Uganda [J]. BMC Infect Dis, 2019, 19(1): 486.
Garcia-solache M, Rice L B. The Enterococcus: a model of adaptability to its environment [J]. Clin Microbiol Rev, 2019, 32(2): e00058-18.
胡付品, 郭燕, 朱德妹, 等. 2019年CHINET三级医院细菌耐药监测 [J]. 中国感染与化疗杂志, 2020, 20(3): 233-243.
胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中国细菌耐药监测 [J]. 中国感染与化疗杂志, 2021, 21(4): 377-387.
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测 [J]. 中国感染与化疗杂志, 2018, 18(3): 241-251.
胡付品, 郭燕, 朱德妹, 等. 2018年CHINET中国细菌耐药性监测 [J]. 中国感染与化疗杂志, 2020, 20(1): 1-10.
Ch'ng J H, Chong K K L, Lam L N, et al. Biofilm-associated infection by enterococci [J]. Nat Rev Microbiol, 2019, 17(2): 82-94.
Conwell M, Dooley J S G, Naughton P J. Enterococcal biofilm-A nidus for antibiotic resistance transfer? [J]. J Appl Microbiol, 2022, 132(5): 3444-3460.
Zeng X, She P, Zhou L, et al. Drug repurposing: antimicrobial and antibiofilm effects of penfluridol against Enterococcus faecalis [J]. Microbiologyopen, 2021, 10(1): e1148.
Zheng J X, Bai B, Lin Z W, et al. Characterization of biofilm formation by Enterococcus faecalis isolates derived from urinary tract infections in China [J]. J Med Microbiol, 2018, 67(1): 60-67.
Salerno S N, Edginton A, Cohen-Wolkowiez M, et al. Development of an adult physiologically based pharmacokinetic model of Solithromycin in plasma and epithelial lining fluid [J]. CPT Pharmacometrics Syst Pharmacol, 2017, 6(12): 814-822.
Fernandes P, Pereira D, Watkins P B, et al. Differentiating the pharmacodynamics and toxicology of macrolide and ketolide antibiotics [J]. J Med Chem, 2020, 63(12): 6462-6473.
Okusanya O O, Forrest A, Bhavnani S M, et al. Pharmacokinetic/pharmacodynamic evaluation of solithromycin against Streptococcus pneumoniae using data from a neutropenic murine lung infection model [J]. Antimicrob Agents Chemother, 2019, 63(8): e02606-18.
Gonzalez D, James L P, Aluzri A, et al. Population pharmacokinetics and safety of solithromycin following Intravenous and oral administration in infants, children, and adolescents [J]. Antimicrob Agents Chemother, 2018, 62(8): e00692-18.
Keelan J A, Kemp M W, Payne M S, et al. Maternal administration of solithromycin, a new, potent, broad-spectrum fluoroketolide antibiotic, achieves fetal and intra-amniotic antimicrobial protection in a pregnant sheep model [J]. Antimicrob Agents Chemother, 2014, 58(1): 447-454.
Darpo B, Sager P T, Fernandes P, et al. Solithromycin, a novel macrolide, does not prolong cardiac repolarization: a randomized, three-way crossover study in healthy subjects [J]. J Antimicrob Chemother, 2017, 72(2): 515-521.
Wang Y, Xiong Y, Wang Z, et al. Comparison of solithromycin with erythromycin in Enterococcus faecalis and Enterococcus faecium from China: antibacterial activity, clonality, resistance mechanism, and inhibition of biofilm formation [J]. J Antibiot (Tokyo), 2021, 74(2): 143-151.
Min Y H, Yoon E J, Kwon A R, et al. Alterations in regulatory regions of erm(B) genes from clinical isolates of enterococci resistant to telithromycin [J]. Arch Pharm Res, 2011, 34(12): 2149-2154.
Singh K V, Zscheck K K, Murray B E. Efficacy of telithromycin (HMR 3647) against Enterococci in a mouse peritonitis model [J]. Antimicrob Agents Chemother, 2000, 44(12): 3434-3437.
Xiong Y, Chen J, Sun X, et al. The antibacterial and antibiofilm activity of telithromycin against Enterococcus spp. isolated from patients in China [J]. Front Microbiol, 2020, 11: 616797.
Namour F, Wessels D H, Pascual M H, et al. Pharmacokinetics of the new ketolide telithromycin (HMR 3647) administered in ascending single and multiple doses [J]. Antimicrob Agents Chemother, 2001, 45(1): 170-175.
Wang L, Zhang Y, Liu S, et al. Comparison of anti-microbic and anti-biofilm activity among tedizolid and radezolid against Linezolid-resistant Enterococcus faecalis isolates [J]. Infect Drug Resist, 2021, 14: 4619-4627.
Wang X, Wang Q, Morris M E. Pharmacokinetic interaction between the flavonoid luteolin and gamma-hydroxybutyrate in rats: potential involvement of monocarboxylate transporters [J]. AAPS J, 2008, 10(1): 47-55.
Luo Y, Chen S, Zhou J, et al. Luteolin cocrystals: Characterization, evaluation of solubility, oral bioavailability and theoretical calculation [J]. J Drug Deliv Sci Tec, 2019, 50: 248-254.
Fu Y, Wang W, Zeng Q, et al. Antibiofilm efficacy of luteolin against single and dual species of Candida albicans and Enterococcus faecalis[J]. Front Microbiol, 2021, 12: 715156.
Xue L, Zhang W J, Fan Q X, et al. Licochalcone A inhibits PI3K/Akt/mTOR signaling pathway activation and promotes autophagy in breast cancer cells [J]. Oncol Lett, 2018, 15(2): 1869-1873.
Shen T S, Hsu Y K, Huang Y F, et al. Licochalcone a suppresses the proliferation of osteosarcoma cells through autophagy and ATM-Chk2 activation [J]. Molecules, 2019, 24(13): 2435.
Hosseinzadeh S, Dastmalchi Saei H, Ahmadi M, et al. Anti-quorum sensing effects of licochalcone a and epigallocatechin-3-gallate against Salmonella typhimurium isolates from poultry sources [J]. Vet Res Forum, 2020, 11(3): 273-279.
Liu X, Xiong Y, Shi Y, et al. In vitro activities of licochalcone a against planktonic cells and biofilm of Enterococcus faecalis [J]. Front Microbiol, 2022, 13: 970901.
Behbahani M, Nosrati M, Mohabatkar H. Inhibition of human immunodeficiency type 1 virus (HIV-1) life cycle by different egg white lysozymes [J]. Appl Biochem Biotechnol, 2018, 185(3): 786-798.
Rouchon C N, Harris J, Zubair-nizami Z, et al. The cationic antimicrobial peptide activity of lysozyme reduces viable Enterococcus faecalis cells in biofilms [J]. Antimicrob Agents Chemother, 2022, 66(5): e0233921.
Beaussart A, Retourney C, Quiles F, et al. Supported lysozyme for improved antimicrobial surface protection [J]. J Colloid Interface Sci, 2021, 582(Pt B): 764-772.
Ragland S A, Criss A K. From bacterial killing to immune modulation: recent insights into the functions of lysozyme [J]. PLoS Pathog, 2017, 13(9): e1006512.
Ranjith N K, Sasikala C, Ramana Ch V. Rhodethrin: a novel indole terpenoid ether produced by Rhodobacter sphaeroides has cytotoxic and phytohormonal activities [J]. Biotechnol Lett, 2007, 29(9): 1399-1402.
Tatta E R, Kumavath R. Rhodethrin and rubrivivaxin as potential source of anti-biofilm agents against vancomycin resistant Enterococcus faecalis (ATCC 19443) [J]. Microb Pathog, 2020, 148: 104457.
Tatta E R, Kumavath R. Attenuation of Enterococcus faecalis biofilm formation by rhodethrin: a combinatorial study with an antibiotic [J]. Microb Pathog, 2022, 163: 105401.
Tkhilaishvili T, Lombardi L, Klatt A B, et al. Bacteriophage Sb-1 enhances antibiotic activity against biofilm, degrades exopolysaccharide matrix and targets persisters of Staphylococcus aureus [J]. Int J Antimicrob Agents, 2018, 52(6): 842-853.
Azeredo J, Garcia P, Drulis-kawa Z. Targeting biofilms using phages and their enzymes [J]. Curr Opin Biotechnol, 2021, 68: 251-261.
Dakheel K H, Abdul Rahim R, Al-obaidi J R, et al. Proteomic analysis revealed the biofilm-degradation abilities of the bacteriophage UPMK_1 and UPMK_2 against methicillin-resistant Staphylococcus aureus [J]. Biotechnol Lett, 2022, 44(3): 513-522.
Pires D P, Melo L, Vilas Boas D, et al. Phage therapy as an alternative or complementary strategy to prevent and control biofilm-related infections [J]. Curr Opin Microbiol, 2017, 39: 48-56.
Taglialegna A, Matilla-cuenca L, Dorado-Morales P, et al. The biofilm-associated surface protein Esp of Enterococcus faecalis forms amyloid-like fibers [J]. NPJ Biofilms Microbiomes, 2020, 6(1): 15.
Goodarzi F, Hallajzadeh M, Sholeh M, et al. Anti-biofilm activity of a lytic phage against vancomycin-resistant Enterococcus faecalis [J]. Iran J Pathol, 2022, 17(3): 285-293.
Goodarzi F, Hallajzadeh M, Sholeh M, et al. Biological characteristics and anti-biofilm activity of a lytic phage against vancomycin-resistant Enterococcus faecium [J]. Iran J Microbiol, 2021, 13(5): 691-702.
El-atrees D M, El-kased R F, Abbas A M, et al. Characterization and anti-biofilm activity of bacteriophages against urinary tract Enterococcus faecalis isolates [J]. Sci Rep, 2022, 12(1): 13048.
Abedon S T. Ecology of Aanti-biofilm agents I: antibiotics versus bacteriophages [J]. Pharmaceuticals (Basel), 2015, 8(3): 525-558.
Lev K, Kunz Coyne A J, Kebriaei R, et al. Evaluation of bacteriophage-antibiotic combination therapy for biofilm-embedded MDR Enterococcus faecium [J]. Antibiotics (Basel), 2022, 11(3): 392.
Srivastava S, Zahra F T, Gupta N, et al. Low dose of penfluridol inhibits VEGF-Induced angiogenesis [J]. Int J Mol Sci, 2020, 21(3): 755.
Chien W, Sun Q Y, Lee K L, et al. Activation of protein phosphatase 2A tumor suppressor as potential treatment of pancreatic cancer [J]. Mol Oncol, 2015, 9(4): 889-905.
Ranjan A, Gupta P, Srivastava S K. Penfluridol: an antipsychotic agent suppresses metastatic tumor growth in triple-negative breast cancer by inhibiting integrin signaling axis [J]. Cancer Res, 2016, 76(4): 877-890.
Ranjan A, German N, Mikelis C, et al. Penfluridol induces endoplasmic reticulum stress leading to autophagy in pancreatic cancer [J]. Tumour Biol, 2017, 39(6): 1010428317705517.
Tuan N M, Lee C H. Penfluridol as a candidate of drug repurposing for anticancer agent [J]. Molecules, 2019, 24(20): 3659.
Van Praag H M, Schut T, Dols L, et al. Controlled trial of penfluridol in acute psychosis [J]. Br Med J, 1971, 4(5789): 710-713.
Soares B G, Lima M S. Penfluridol for schizophrenia [J]. Cochrane Database Syst Rev, 2006, 19(2): CD002923.
Ashraf-uz-zaman M, Sajib M S, Cucullo L, et al. Analogs of penfluridol as chemotherapeutic agents with reduced central nervous system activity [J]. Bioorg Med Chem Lett, 2018, 28(23-24): 3652-3657.
Kim W, Zou G, Hari T P A, et al. A selective membrane-targeting repurposed antibiotic with activity against persistent methicillin-resistant Staphylococcus aureus [J]. Proc Natl Acad Sci USA, 2019, 116(33): 16529-16534.
She P, Wang Y, Li Y, et al. Drug repurposing: In vitro and in vivo antimicrobial and antibiofilm effects of bithionol against Enterococcus faecalis and Enterococcus faecium [J]. Front Microbiol, 2021, 12: 579806.
Ayyagari V N, Johnston N A, Brard L. Assessment of the antitumor potential of Bithionol in vivo using a xenograft model of ovarian cancer [J]. Anticancer Drugs, 2016, 27(6): 547-559.

