拟南芥CARK11参与ABA介导的生理功能研究
黄亚玲 李小意 陈丽 杨毅


为了探究CARK11在ABA介导的生理进程中的具体作用,本研究以拟南芥哥伦比亚生态型(WT)、CARK11功能缺失突变体cark11和回补激酶丧失CARK11N203A(com-CARK11m)以及过表达转基因株系(OE-CARK11)为研究对象,探究CARK11在种子萌发、幼苗形态构建、主根生长与干旱响应中发挥的作用. 结果显示:相比WT,ABA促进了cark11和com-CARK11m的种子萌发、子叶变绿和主根伸长,而OE-CARK11被抑制. qRT-PCR检测RAB18和RD29a的表达量,发现过表达CARK11促进RAB18和RD29a表达;ABA处理后,这种促进作用更强. 干旱实验发现,OE-CARK11耐旱性增加,而cark11和com-CARK11m耐旱性弱于WT. 这些结果表明:CARK11作为ABA信号通路的正调控因子抑制拟南芥的种子萌发、子叶变绿和主根生长;同时在干旱胁迫中具有积极作用;另外CARK11在ABA信号途径中的功能依赖激酶活性.
蛋白激酶CARK11; 脱落酸; 脱落酸信号通路; 干旱
Q943.2A2023.026004
收稿日期: 2022-05-25
基金项目: 国家自然科学基金(31671455, 31870240)
作者简介: 黄亚玲(1997-), 女, 四川绵阳人, 硕士研究生, 研究方向为植物遗传和分子生物学. Email: huangyaling@stu.scu.edu.cn
通讯作者: 杨毅. E-mail: yangyi528@scu.edu.cn
CARK11 involves in ABA-mediated physiological functions in Arabidopsis
HUANG Ya-Ling, LI Xiao-Yi, CHEN Li, YANG Yi
(Key Laboratory of Bio-Resources and Eco-Environment of Ministry of Education, College of Life Sciences, Sichuan University, Chengdu 610065, China)
In this study, the purpose is to explore the specific role of CARK11 in ABA-mediated physiological processes. Arabidopsis Columbia ecotype(WT), T-DNA mutant cark11, complementation of kinase-dead CARK11N203A in the background of cark11, (com-CARK11m), and overexpression transgenic lines(OE-CARK11) were used in this study to determine the roles of CARK11 during seed germination, seedling morphogenesis, primary root growth, and drought tolerance. The results showed that compared with the WT, ABA promoted seed germination, cotyledon greening, and primary root elongation in both cark11 and com-CARK11m, while OE-CARK11 was relatively inhibited. In addition, qRT-PCR data showed that overexpression of CARK11 promoted the expression of RAB18 and RD29a, which were ABA-marked genes, and this facilitation was stronger after ABA treatment. In the drought tolerance assay, the results revealed that OE-CARK11 enhanced drought tolerance, while cark11 and com-CARK11m were weaker than WT. Thus, we conclude that CARK11 acts as a positive regulator in the ABA signaling pathway and inhibits seed germination, cotyledon establishment, primary root growth and drought stress in Arabidopsis. Notably, the function of CARK11 is dependent on kinase activity in the ABA signaling pathway.
CARK11; ABA; ABA signaling; Drought tolerance
1 引 言
面对多变的环境,植物的固着性使得其无法像动物一样通过运动等方式趋利避害,因此植物进化出了特有的应对机制,脱落酸(Abscisic acid, ABA)在其中发挥重要作用. ABA不仅参与响应生物和非生物胁迫,而且还调控着植物的生长发育. 早在上世纪六十年代即发现了ABA的存在,目前ABA的研究已经相对广泛而深入,其中2009年ABA受体(Pyrabactin Resistance 1 / PYR1-Like Receptors / Regulatory Components of ABA Receptors, PYR1 / PYLs / RCARs)的发现是ABA研究领域的突破之一[1, 2]. ABA受体被明确以后,ABA核心信号通路被阐明. ABA受体、蛋白磷酸酶2C(Type 2C protein phosphatases, PP2Cs)和SNF1相关蛋白激酶2(SNF1-Related Protein Kinases2, SnRK2s)是ABA信号通路的核心组件. 当植物受到胁迫时,ABA与RCARs、PP2Cs结合形成三元复合体,PP2Cs酶活受到抑制,释放了对SnRK2s的抑制作用,SnRK2s磷酸化调控下游因子,最终介导种子萌发、气孔关闭、根部生长、非生物胁迫以及衰老等过程[3].
随着ABA核心信号通路的阐明,ABA信号网络的研究逐渐扩大,相关研究还有待于进一步阐明,如核心元件RCARs如何被调控的相关研究仍然未知. 最近研究显示,胞质ABA受体激酶11(Cytosolic ABA Receptor Kinase 11, CARK11)可以结合并磷酸化RCAR11-14,且CARK11第203位氨基酸天冬酰胺(Asparagine, N)是关键磷酸化位点[4]. CARK11是一种类受体胞质蛋白激酶(Receptor-Like Cytoplasmic Protein Kinases, RLCKs),拟南芥中同家族成员还包括CARK1-CARK10. 研究表明CARKs各个成员普遍参与RCARs的调控,并且存在功能冗余[5]. 拟南芥ABA受体分为三个亚家族,第一和第二亚家族都是单体蛋白,分别是RCAR1-4和RCAR5-10,而RCAR11-14是ABA受体的第三亚家族,以二聚体形式存在. 蛋白水平实验表明,拟南芥CARK11可以磷酸化RCAR11-14并使其解聚,解聚的RCAR11-14才能与ABA结合,从而开启ABA信号通路[4]. 因此,CARK11调控ABA信号的分子机理基本明确,但是其在ABA相关生长发育过程中的具体作用尚不清楚. 在小麦等作物中,CARKs家族同源物参与调控ABA信号的研究相对很少,本研究阐明CARK11在拟南芥的种子萌发、幼苗形态构建、主根生长以及干旱响应等生理进程中发挥的作用,可为农业生产相关研究提供理论基础.
鉴于CARK11在蛋白水平上参与调控ABA信号转导,本研究构建并鉴定CARK11的功能缺失突变体cark11、过表达转基因株系(OE-CARK11 #1和OE-CARK11 #9)和CARK11N203A回补株系(com-CARK11m #1和com-CARK11m #2),通过种子萌发、子叶变绿、主根伸长、干旱胁迫以及ABA报告基因实时定量实验,探究CARK11在拟南芥生长发育以及胁迫反应中发挥的功能,并进一步分析CARK11在ABA信号通路中的作用.
2 材料与方法
2.1 材 料
T-DNA插入突变cark11(SALK_208681c)购于拟南芥生物资源中心(Arabidopsis Biological Resource Center). 过表达转基因株系(OE-CARK11)和CARK11N203A回补株系(com-CARK11m)分别通过浸染拟南芥哥伦比亚生态型和CARK11突变株后筛选获得.
2.2 方 法
2.2.1 纯合T-DNA插入突变株系的获得 收取4周龄cark11幼叶1~2片,使用250 μL基因组提取液研磨并高速离心,收取上清液,加入等量异丙醇,充分震荡后再次高速离心,弃去上清液,并用70%乙醇洗涤沉淀2次,晾干后加入超纯水,获得cark11突变体的基因组. 以获得的基因组为模板,进行聚合酶链式反应(Polymerase Chain Reaction, PCR),鉴定引物见表1,根据核酸凝胶电泳成像结果分析鉴定纯合突变体.
2.2.2 转基因株系的构建 将CARK11基因编码序列插入双元载体pBI121,利用35S启动子构建过表达载体,提取质粒后转化进入农杆菌GV3101,然后以拟南芥哥伦比亚生态型野生型为背景,通过花絮浸染法获得转基因株系T0代种子. 在MS培养基中加入50 μg / mL卡那霉素(Kanamycin),将T0代种子铺于板中筛选出阳性苗,根系深深扎入培养基中的即为阳性,种入土中,收获T1代种子. 观察记录T1代种子阳性率,保留阳性率与阴性率比值为3∶1的株系并种植,然后收获T2代种子. T2代种子筛选获得阳性率为100%的株系即为纯合的过表达株系,最后还需确定基因表达量,符合预期的株系用于后续实验.
将CARK11第203位氨基酸天冬酰胺突变为丙氨酸(Alanine, A)(CARK11N203A, CARK11m),获得目的片段后插入pZH01载体,利用35S启动子构建回补载体,提取质粒转入农杆菌GV3101,然后以cark11为背景进行花絮浸染,后续与上述过表达株系构建操作一致.
2.2.3 种子萌发 各个株系种子于4 ℃黑暗条件下春化2 d. 配制ABA浓度梯度的MS培养基,ABA终浓度依次为0、0.3、1.0、3.0、10.0 μmol/L,每个浓度培养基各设置三个重复. 在各个培养基中分别点播相同数量的种子,然后于组培室中平置培养,4 d后统计萌发的种子数量. 种子萌发率(Germination Rate)计算方式为:
种子萌发率=萌发种子数量/种子总数
2.2.4 子叶变绿 同于种子萌发实验技术,种子分别在MS和加入0.3 μmol/L ABA的MS 培养基中培养大约1 w后观察记录子叶变绿的情况. 子叶绿化率(Greening)的计算方式为:
子叶绿化率=长出绿色子叶的种子数/种子总数
2.2.5 主根伸长 先将种子置于MS培养基中垂直培养2~3 d,然后选取根长一致的幼苗分别转移到ABA浓度为0和20 μmol/L的1/2 MS培养基中,未加ABA的培养基作为对照组,垂直放置培养大约1 w后统计分析主根伸长长度.
2.2.6 干旱胁迫 各个株系撒播于土壤中,设置三个生物学重复,正常生长2 w,然后停止浇水,干旱2 w后复水,2 d后观察存活率.
2.2.7 RNA的提取 利用Trizol法提取RNA:收取于MS培养基中平置培养1 w的拟南芥幼苗,加入液氮至研钵中充分研磨样本,粉末状样本置入1 mL Trizol并立即充分混匀,冰置10 min. 低温高速离心后收取上清液,加入200 μL氯仿混匀,冰置5 min. 再次低温高速离心后收取上清液,加入500 μL异丙醇混匀,冰置30 min. 低温高速离心,弃去上清,70%乙醇洗涤沉淀,晾干后加入超纯水溶解沉淀,所获溶液即为RNA,后续可用于实时定量分析(Real-Time Quantitative PCR, qRT-PCR).
2.2.8 实时定量分析 以RNA为模板,利用Takara反转录试剂盒获得cDNA,根据CARK11基因序列设计引物,引物序列委托华大基因公司合成(表2),然后利用Takara实时荧光定量试剂盒对CARK11进行qRT-PCR. 以β-Actin为内参,反应体系为20 μL:10 μL TB Green Premix Ex Taq,上下游引物各1 μL,1 μL cDNA以及7 μL无菌水. 反应程序为:95 ℃预变性2 min,然后95 ℃变性10 s,60 ℃退火30 s,95 ℃延伸5 s,检测39个循环. 每个样本技术重复3次,生物学重复3次,最终通过2-ΔΔt的方法计算相对表达量,GraphPad Prism 9.0绘制结果.
3 结 果
3.1 CARK11基因表达量分析
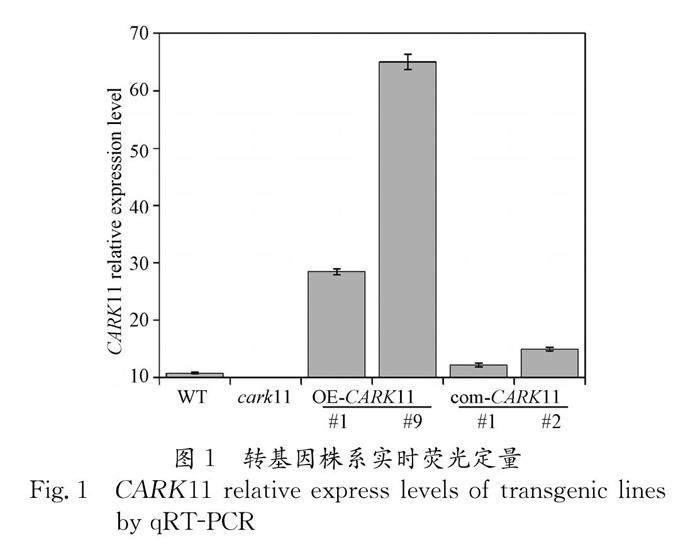
获得突变体与转基因纯合株系后,需要进一步进行CARK11基因表达量分析,定量结果呈现为T-DNA插入突变体表达量降低、过表达株系升高、回补株系与野生型水平一致才能进行表型分析. 提取野生型以及各个转基因株系的RNA后,进行实时荧光定量. 定量结果显示,在野生型(WT)中CARK11基因相对表达量仅为11左右;但是T-DNA插入突变的cark11的表达量更低,基本接近于0;两个过表达株系(OE-CARK11 #1和OE-CARK11 #9)的CARK11基因相对表达水平显著高于野生型,OE-CARK11 #1的CARK11基因表达量大约是野生型的3倍,OE-CARK11 #9甚至达到野生型的6倍;而关键磷酸化位点突变的回补株系(com-CARK11m #1和com-CARK11m #2)表达量较野生型稍高,但是远低于过表达株系(图1). 可以确定在cark11和OE-CARK11株系中基因表达量确实如预期降低和升高,而com-CARK11m恢复了cark11的基因表达水平,甚至高于野生型.因此上述五个株系可以用于后续的功能分析.
3.2 CARK11参与调控ABA介导的种子萌发
种子萌发实验显示,未加ABA进行处理时,各个株系的萌发率一致,基本都能够接近100%,表明种子的生理活性一致. ABA抑制种子萌发,0.3 μmol/L ABA处理后,野生型的萌发率明显降低,约为84%;而cark11突变体萌发率显著高于野生型,达到91%;相反,过表达株系OE-CARK11 #1和OE-CARK11 #9的种子萌发率分别为75%和70%,显著低于野生型;而回补株系com-CARK11m #1和com-CARK11m #2的萌发率类似cark11,分别为91%和95%,说明磷酸化位点突变后的CARK11N203A不能挽救突变体的功能缺失(图2). 分别用1.0、3.0、10.0 μmol/L ABA处理各个株系,随着浓度的升高,ABA对各个株系的抑制作用加强,但是在相同浓度下,ABA对功能缺失突变体cark11、com-CARK11m#1和com-CARK11m#2的抑制率仍旧显著低于野生型;除了高浓度的10.0 μmol/L ABA处理外,OE-CARK11#1和OE-CARK11#9的抑制率高于野生型. 总之,CARK11功能突变体cark11、com-CARK11m#1和com-CARK11m#2在ABA处理后种子萌发呈现为ABA不敏感,而过表达株系对ABA敏感,表明CARK11作为正调控因子参与调控ABA介导的种子萌发.
3.3 CARK11参与调控ABA介导的幼苗形态建成
未经ABA处理时,WT、cark11、OE-CARK11#1和OE-CARK11#9、com-CARK11m#1和com-CARK11m#2的子叶在MS培养基中生长情况一致,100%都能长出绿色子叶. 当0.3 μmol/L ABA处理时,各株系的子叶绿化率显著减少,野生型减少为30.8%;功能突变体cark11、com-CARK11m#1和com-CARK11m#2子叶绿化率较野生型更高,分别是41.7%、46.4%和45.9%;而OE-CARK11#1和OE-CARK11#9则显著低于野生型,绿化率仅17.6%和18.8%(图3). 因此,CARK11功能缺失后对ABA处理的子叶变绿过程不敏感,而过表达则超敏感,表明CARK11正调控ABA介导的子叶形态构建.
3.4 CARK11参与调控ABA介导的主根生长抑制
在1/2MS培养基中,各个株系主根长度一致. 当20 μmol/L ABA处理后,过表达株系主根长度明显短于野生型,而功能缺失突变体较长(图4). 统计伸长率后发现,野生型的根长仅为1/2 MS培养基的35%,即主根伸长率为35%;cark11、com-CARK11m #1和com-CARK11m #2根伸长率显著高于野生型,分别为44%、46.8%和42%,表明突变体对ABA不敏感;OE-CARK11#1和OE-CARK11 #9的根伸长率为17.1%和17.75%,对ABA处理呈现敏感状态(图4). 鉴于ABA抑制主根生长,但是CARK11功能缺失后,ABA抑制主根伸长的作用被抑制,而过表达增强了抑制作用,因此,CARK11正调控ABA信号,从而抑制主根生长.
3.5 ABA信号通路下游基因表达量分析
RAB18和RD29a是ABA信号通路的下游基因,作为ABA信号通路的报告基因. 对RAB18基因表达量进行分析,结果表明:在正常条件下,野生型与cark11的表达水平相似;OE-CARK11 #9和com-CARK11m #1转基因株系中RAB18表达量则显著低于野生型. 对幼苗进行50 μmol/L ABA处理后,野生型的RAB18表达水平显著提高,大约为未经处理时的40倍;但是突变体cark11仅提高8倍,显著低于野生型;过表达OE-CARK11 #9的RAB18表达提高了接近100倍,显著高于野生型;而回补株系com-CARK11m #1的RAB18表达水平介于突变体和过表达之间,提高了大约20倍(图5). 而RD29a的表达水平分析结果显示:无ABA处理时,功能突变体cark11和com-CARK11m #1的RD29a表达量显著低于野生型,而过表达则显著高于野生型,大约是野生型的7倍. ABA处理后RD29a的表达模式类似于RAB18,功能突变体降低,过表达提高(图5). 综上结果表明,CARK11通过增强RAB18和RD29a的表达促进ABA信号通路.
3.6 CARK11正调控拟南芥的干旱胁迫响应
将2 w龄的拟南芥幼苗干旱处理13 d后,各个株系都呈萎蔫状态,功能突变体cark11、com-CARK11m #1和com-CARK11m #2甚至较野生型失水更严重,但是过表达OE-CARK11 #1和OE-CARK11 #9较野生型失水更少. 复水2 d后观察植株生长状况发现,大多数野生型幼苗能恢复干旱处理前的状态,存活率大约为75%;突变体植株整体看来仍旧萎蔫,统计发现存活率仅为2.5%;而过表达的复水状况较野生型更好,基本100%都能存活(图6). 因此,CARK11正调控拟南芥耐干旱胁迫的过程.
4 讨 论
ABA核心信号通路在被子植物中是相对保守的,RCARs代表被子植物中的主要ABA受体,无论是对于模式植物拟南芥还是重要作物水稻,当RCARs功能突变后,其种子萌发、幼苗生长以及气孔运动等生理进程都会受损[6, 7]. RCARs通过转录后修饰可精细响应环境变化,其中的修饰即包括磷酸化(Phosphorylation),酪氨酸硝化(Tyrosine Nitration)和泛素化(Ubiquitination). 朱健康研究团队在2018年鉴定出ABA受体的磷酸激酶TOR(Target of Rapamycin):在非应激条件下,TOR磷酸化RCAR12第119位的苏氨酸,抑制RCAR12与ABA的结合,从而负调控ABA信号途径;在应激条件下,SnRK2s解离TOR复合体,从而解除TOR对ABA信号的抑制[8]. 拟南芥类EL1蛋白(EL1-like Protein, AEL)是一种酪蛋白激酶,AEL功能突变后种子萌发以及主根生长过程都对ABA处理敏感,因为AEL可以磷酸化ABA受体并促进其泛素化降解,从而抑制ABA响应[9]. 而本实验室鉴定出的拟南芥激酶CARKs与ABA受体存在普遍的相互作用,其中CARK2-5和CARK11等都可结合并磷酸化第Ⅲ亚家族ABA受体RCAR11-14,第Ⅲ亚家族ABA受体在正常条件下呈二聚体状态,但是ABA诱导CARKs磷酸化RCAR11-14使其解聚,暴露与ABA的结合位点,从而正调控ABA信号通路[4]. 因此,通过对ABA受体的磷酸化调节,植物可以优化生长和应激反应的平衡. 本研究显示,CARK11作为ABA信号通路的正调控因子参与ABA介导的抑制种子萌发、幼苗形态构建以及主根伸长的生长发育过程,并且这些过程依赖于CARK11的磷酸激酶活性.
干旱是影响植物生长和发育的一种主要渗透胁迫,会导致农作物产量的严重损失. ABA信号转导对于干旱胁迫响应亦十分重要,植物抵御干旱最重要的途径是叶片气孔的关闭,保卫细胞膨压和微丝动态变化是调节气孔开闭的关键参数[10, 11]. 植物在遭遇干旱时,叶片中的ABA迅速增加,ABA-RCARs-PP2Cs三元复合物的形成破坏了PP2C和开放气孔1(Open Stomata, OST1)的结合,从而释放活性OST1激酶,OST1激活阴离子通道蛋白(Slow Anion Channel Associated 1, SLAC1)使膜去极化,导致气孔膨压降低,最终气孔闭合[12-14]. 在本文中,干旱实验结果显示CARK11功能突变后表现为不耐旱,而过表达则相比野生型更耐旱,可能是突变体中气孔关闭缓慢,水分散失更多,而过表达气孔关闭非常灵敏,从而相对保留更多的水分,表明CARK11在干旱胁迫响应中的正调控作用. 结合ABA对干旱胁迫的响应,推测CARK11可能通过激活ABA受体诱导ABA信号通路,从而调控气孔的关闭.
本文结果进一步证明CARK11确实参与ABA通路,通过磷酸化ABA受体的方式介导拟南芥的生长发育和胁迫反应. 在小麦与水稻等应用作物中,CARKs家族同源物参与调控ABA信号的研究相对很少,因此本文阐明拟南芥CARK11在ABA核心信号通路中发挥的调控作用为水稻等相关研究提供模板,从而为水稻与小麦等重要作物的种子萌发、根系生长以及干旱胁迫等研究奠定理论基础,对于农业生产具有一定的意义.
参考文献:
[1] Park S Y, Fung P, Nishimura N, et al. Abscisic acid inhibits PP2Cs via the PYR/PYL family of ABA binding START proteins [J]. Science, 2009, 324: 1068.
[2] Ma Y, Szostkiewicz I, Korte A, et al. Regulators of PP2C phosphatase activity function as abscisic acid sensors [J]. Science, 2009, 324: 1064.
[3] Hauser F, Li Z, Waadt R, et al. Snapshot: Abscisic acid signaling [J]. Cell, 2017, 171: 1708.
[4] Li X, Xie Y, Zhang Q, et al. Monomerization of abscisic acid receptors through CARKs-mediated phosphorylation [J]. New Phytol, 2022, 235: 533.
[5] 黄彦菱, 姜雅淇, 李小意, 等. 拟南芥CARK家族响应脱落酸信号的研究 [J]. 四川大学学报:自然科学版, 2021, 58: 206.
[6] Komatsu K, Takezawa D, and Sakata Y. Decoding ABA and osmostress signalling in plants from an evolutionary point of view [J]. Plant Cell Environ, 2020, 43: 2894.
[7] Chen K, Li G J, Bressan R A, et al. Abscisic acid dynamics, signaling, and functions in plants [J]. J Integr Plant Biol, 2020, 62: 25.
[8] Wang P, Zhao Y, Li Z, et al. Reciprocal regulation of the TOR kinase and ABA receptor balances plant growth and stress response [J]. Mol Cell, 2018, 69: 100.
[9] Chen H H, Qu L, Xu Z H, et al. EL1-like casein kinases suppress ABA signaling and responses by phosphorylating and destabilizing the ABA receptors PYR/PYLs in Arabidopsis [J]. Mol Plant, 2018, 11: 706.
[10] Zhao S, Jiang Y, Zhao Y, et al. Casein kinase1-like protein2 regulates actin filament stability and stomatal closure via phosphorylation of actin depolymerizing factor [J]. Plant Cell, 2016, 28: 1422.
[11] Lim C W, Baek W, Jung J, et al. Function of ABA in stomatal defense against biotic and drought stresses [J]. Int J Mol Sci, 2015, 16: 15251.
[12] Cutler S R, Rodriguez P L, Finkelstein R R, et al. Abscisic acid: emergence of a core signaling network [J]. Annu Rev Plant Biol, 2010, 61: 651.
[13] Hubbard K E, Nishimura N, Hitomi K, et al. Early abscisic acid signal transduction mechanisms: Newly discovered components and newly emerging questions [J]. Genes Dev, 2010, 24: 1695.
[14] Lee S C, Lan W, Buchanan B B, et al. A protein kinase-phosphatase pair interacts with an ion channel to regulate ABA signaling in plant guard cells [J]. Proc Natl Acad Sci USA, 2009, 106: 21419.

