一株产低温碱性淀粉酶蕈状芽孢杆菌的分离筛选和发酵优化
刘佳慧 吕红 林娟

本研究的目的是从生态环境独特而复杂的西藏林芝地区的土壤样品中挖掘所蕴藏的特殊淀粉酶微生物资源.采用淀粉酶功能筛选的方法获得一株低温碱性淀粉酶生产菌株,编号为3F1.其酶活最适条件为10 ℃、pH 10.2.通过16S rDNA序列分析法鉴定该菌株为蕈状芽孢杆菌(Bacillus mycoides),并将其命名为Bm3F1.通过发酵条件的逐步优化,最终确定其最佳发酵条件为:发酵培养基中添加1.5%可溶性淀粉,培养基初始pH 7.2,装液量10 mL/250 mL,菌体接种量9.0%,发酵温度30 ℃,发酵时间18 h,经优化后可将菌株的酶活提升至13.58 U/mL. 表明从西藏林芝地区分离的Bm3F1具有在低温和碱性条件下产较高酶活淀粉酶的特性.
低温碱性淀粉酶; 蕈状芽孢杆菌; 分离筛选; 发酵条件优化
Q93A2023.026001
收稿日期: 2022-05-09
基金项目: 上海市科技攻关项目 (19DZ2282100); 西藏大学-复旦大学生物多样性与全球变化联合实验室资助项目
作者简介: 刘佳慧 (1997- ), 女, 上海人, 硕士研究生, 研究方向为微生物活性物质挖掘. E-mail: 19210700068@fudan.edu.cn
通讯作者: 林娟. E-mail: linjuan@fudan.edu.cn; 吕红. E-mail: honglv@fudan.edu.cn
Isolation and screening of psychrophilic and alkaline amylase-producing Bacillus mycoides strain 3F1 and the optimum fermentation for enzyme production
LIU Jia-Hui, L Hong, LIN Juan
(School of Life Science, State Key Laboratory of Genetic Engineering, Tibet University-Fudan University Joint Laboratory for Biodiversity and Global Change, Fudan University, Shanghai 200438, China)
This study is intended to explore the microbial resource contained in the soil samples of Nyingchi, Tibet, which has a unique and complex ecological environment. A psychrophilic and alkaline amylase-producing strain was obtained by the amylase functional screening method, numbered 3F1. The optimum conditions of amylase activity were 10 ℃ and pH 10.2. According to the 16S rDNA sequencing and phylogenetic analysis result, this strain was classified as Bacillus mycoides and named Bm3F1. Through the gradual optimization of fermentation conditions, the optimum fermentation condition for Bm3F1 was determined as follows: fermentation medium was supplemented with 1.5% soluble starch, the initial pH was 7.2, the liquid volume was 10 mL/250 mL, the bacterial inoculum was 9.0%, and the fermentation temperature and time were 30 ℃ and 18 hours, respectively. Under the optimum conditions, the amylase activity from Bm3F1 could be increased to 13.58 U/mL. The results showed that Bm3F1 isolated from Nyingchi, Tibet, has the characteristics of producing high activity amylase under low temperature and alkaline conditions.
Psychrophilic and alkaline amylase; Bacillus mycoides; Isolation and screening; Fermentation condition optimization
1 引 言
淀粉酶全称为葡聚糖水解酶,属于一种水解酶类,能催化淀粉、糖原和糊精等多糖化合物中的糖苷键,将其水解转化成葡萄糖、麦芽糖及其他低聚糖.在淀粉为原料的工业生产中,淀粉酶作为最重要的一种水解酶,可参与液化(liquefaction)和糖化(saccharification)等加工过程.例如生淀粉降解酶(Raw starch degrading enzymes, RSDE)在淀粉糊化阶段可直接用于降解生淀粉颗粒,具有显著的节省能源和简化工序等效益[1].目前淀粉酶已经成为用途最广、产量最大的一种酶制剂,占整个酶制剂市场的30%,可用于食品饲料加工、燃料酒精工业、纺织退浆过程、生物制药等等行业[2, 3].
微生物发酵法作为目前淀粉酶大规模生产的主要途径.其发酵方式主要分为深层发酵法(Submerged fermentation, SmF)和固态基质发酵法(Solid substrate fermentation, SSF).前者适于细菌发酵生产,后者适于真菌发酵生产[4].工业上广泛使用的细菌来源淀粉酶主要来自芽孢杆菌属(Bacillus),如枯草芽孢杆菌(B. subtilis)、地衣芽孢杆菌(B. 1icheniformis)、嗜热脂肪芽孢杆菌(B. stearothermophilus)、凝结芽孢杆菌(B. coagulans)、解淀粉芽孢杆菌(B. amyloliquefaciens)和嗜碱芽孢杆菌(B. alkalophilic)等.在真菌来源淀粉酶方面,曲霉属(Aspergillus)中的米曲菌(A. oryzae)、黑曲霉(A. niger)、泡盛曲霉(A. awamori)、烟曲霉(A. fumigatus)、黄曲霉(A. flavus)和白曲霉(A. kawachii),以及青霉菌属(Penicillium)中的扩展青霉(P. expansum)、微紫青霉(P. janthinellum)、棕褐青霉(P. brunneum)、娄地青霉(P. roqueforti)、瘿青霉(P. fellutanum)、沙门柏干酪青霉(P. camemberti)、产黄青霉(P. chrysogenum)和奥尔森青霉(P. olsonii)等都可作为淀粉酶生产的真菌来源[4, 5].
虽然目前研究显示具有分泌胞外淀粉酶的生产菌株众多,但是特定性能淀粉酶生产菌株则相当有限.这些淀粉酶在特殊反应条件下如高温、低温或强酸、强碱等处理下依然能够保持较高的酶活.这较常规淀粉酶具有更为广阔的应用前景.例如,嗜冷交替单胞菌(Alteromonas haloplanctis)所生产的低温淀粉酶(AHA)具有高灵活性的多肽链可在较低温度条件下(0~20 ℃)进行酶促反应[6, 7].此类在低温条件下仍具有较高酶活的淀粉酶,在生物工程领域可用于解决现代能源危机,具有较高的应用经济价值[8].另外,碱性淀粉酶可以耐受强碱环境,在环境pH值为 8.0~10.0时仍具有催化活性.该特性具有抵抗恶劣的工业加工条件,使其在工业应用中展现出较好的优越性.由于当下具有各种特性的淀粉酶生产菌株大多都是从特殊或极端的自然环境样本中进行筛选和获取的,故而本研究选取生态环境独特而复杂的西藏林芝地区作为采样地,通过挖掘当地所蕴藏的微生物资源,期望筛选获得具有良好特性的产淀粉酶菌株.在此基础上通过一系列的发酵条件优化提高生产菌株的产酶量,以最终实现当地微生物资源由简单发现到高值化应用的转换.
2 材料与方法
2.1 材 料
2.1.1 样品来源 样品采自西藏林芝市波密县如纳村的玉米作物土壤.在采集时去除2 cm的表土后取距离地面2~15 cm土层的混合样装入样品袋,于4 ℃保存.
2.1.2 培养基 种子和发酵培养基:胰酪胨17.0 g/L,大豆木瓜蛋白酶水解物3.0 g/L,氯化钠5.0 g/L,磷酸氢二钾2.5 g/L,葡萄糖2.5 g/L, pH值调至7.3±0.2;
淀粉酶筛选培养基[9]:可溶性淀粉2.0 g/L,胰酪胨15.0 g/L,大豆木瓜蛋白酶水解物5.0 g/L,氯化钠5.0 g/L,琼脂15.0 g/L, pH值调至7.3±0.2.
2.2 方 法
2.2.1 淀粉酶生产菌株的筛选 称取2 g土壤样品装入盛有22.5 mL无菌水的三角瓶中,充分振荡后静置15~20 min作为原始菌液.待上清液与沉淀分层后,吸取上清液制备成10-1、10-2和10-3三个浓度梯度的稀释液.分别吸取100 μL稀释液涂布于淀粉酶筛选培养基平板上,于28 ℃倒置培养,每隔16 h观察一次菌落生长情况,待长出明显菌落后采用碘熏蒸法[10]进行淀粉酶生产菌落的显色初筛.选择具有明显透明水解圈的菌落转接至淀粉酶筛选培养基上进行划线分离,于28 ℃培养16 h后用碘熏蒸法进行验证与复筛,用以获得形状、大小、颜色相一致的纯种单菌落[11, 12].挑取单菌落接种于含有1 mL种子培养基的2 mL EP管中,于28 ℃、220 r/min条件下培养16 h后进行编号作为后续实验的种子液.
2.2.2 初始发酵培养 将种子液以1.0%接种量接种于含有5 mL发酵培养基的15 mL试管中,培养基初始pH 7.3±0.2,于28 ℃、220 r/min培养16 h.发酵结束后,取2 mL发酵液于12 000 r/min离心20 min后吸取上清液作为粗酶液进行酶活测定.
2.2.3 淀粉酶活力的测定 测定方法:采用3, 5-二硝基水杨酸法,即DNS法测定淀粉酶的酶活[13, 14].取80 μL粗酶液与720 μL 1.0%可溶性淀粉溶液(用20 mmol/L、pH 5.2的醋酸钠缓冲液配制)混合,在28 ℃、pH 5.2条件下反应15 min后,迅速加入800 μL的DNS显色剂,沸水浴10 min后用冰水混合物冷却至稳定.在540 nm波长下测定吸光值,以去离子水作为空白对照组,并且每个样品做三个平行组.
最适反应温度测定条件:在pH 5.2条件下设定五个反应温度值(4、10、28、50和65 ℃),以确定酶活的最适温度.
最适pH的测定条件:在28 ℃条件下设定五个反应pH值(3.2、4.2、5.2、9.2、10.2和11.2),以确定酶活的最适pH.
酶活计算:一个酶活单位(U)定义为:在酶活测定条件下,1 mL粗酶液每分钟产生相当于1 μmol/L葡萄糖所需要的酶量.
酶活计算公式如下:
酶活=A×V1×103t×V2×180(μmol·L-1/mL·min)
式中,A是水解产生葡萄糖浓度(mg/mL);V1是反应总体积(mL);103是单位换算倍数;t是反应时间(min);V2是粗酶液体积(mL);180为葡萄糖分子量.
2.2.4 菌株鉴定 形态学观察:在淀粉酶筛选培养基平板上观察菌落形态特征,挑取单菌落进行革兰氏染色后在100倍光学显微镜下观察菌体形态特征.
生理生化指标鉴定:挑取纯培养的单菌落进行一些系列的细菌生理生化试验,如过氧化氢酶试验、明胶液化试验、硝酸盐还原性试验和Voges-Proskauer (V-P)试验,具体实验流程可参考《常见细菌系统鉴定手册》[15].
分子生物学鉴定:采用16S rDNA基因测序法进行细菌的种属鉴定,利用通用引物(27-F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492-R:5′-TACGGTTACCTTGTTACGACTT-3′)和Vazyme 2× Phanta Max Master Mix高保真DNA聚合酶进行PCR扩增.取5 μL扩增产物在1%琼脂糖凝胶电泳进行检测,在凝胶成像系统下观察1500 bp左右的目标条带.将成功扩增的样品进行测序,其测序结果通过GeneBank数据库(https://blast.ncbi. nlm.nih.gov/Blast.cgi)和EzBioCloud数据库(https://www.ezbiocloud.net/identify)进行序列比对以确定种属[16].
2.2.5 发酵条件优化 发酵优化采用的是逐步优化的方法,初始发酵培养条件与2.2.2所述相同,酶活测定条件为在2.2.3中确定的最适温度和pH条件下测定.
(1) 发酵时间的优化
在初始发酵培养条件下,改变发酵时间,每隔6h进行无菌取样测定细菌浓度(OD600),通过观察菌株的生长及产酶曲线,以确定该菌株的产酶模型以及最佳发酵时间.
(2) 培养基作用底物类型和浓度的优化
在(1)的基础上,在发酵培养基中添加不同作用底物类型(可溶性淀粉、普鲁兰多糖、蔗糖、麦芽糖),底物质量浓度均为10 g/L;选取最适底物类型,通过改变最适底物浓度(0.5%、1.0%、1.5%、2.0%和2.5%),确定最适底物浓度.
(3) 培养基初始pH的优化
在(1)和(2)的基础上,通过改变培养基初始pH值(4.2、5.2、6.2、7.2、8.2、9.2和10.2),以确定最佳初始pH;
(4) 装液量的优化
在(1)(2)(3)的基础上,在250mL三角瓶中分别加入不同的培养基装液量(3、10、25、50、100和150 mL),以确定最佳装液量.
(5) 发酵温度的优化
在(1)(2)(3)(4)的基础上,分别于不同温度条件(20、25、30、35、40和45 ℃)进行培养,以确定最佳发酵温度;
(6) 菌体接种量的优化
在(1)(2)(3)(4)(5)的基础上,改变菌体接种量(1%、3%、5%、7%、9%、11%、13%和15%),以确定最佳接种量.
3 结果与分析
3.1 低温碱性淀粉酶生产菌株的筛选和鉴定
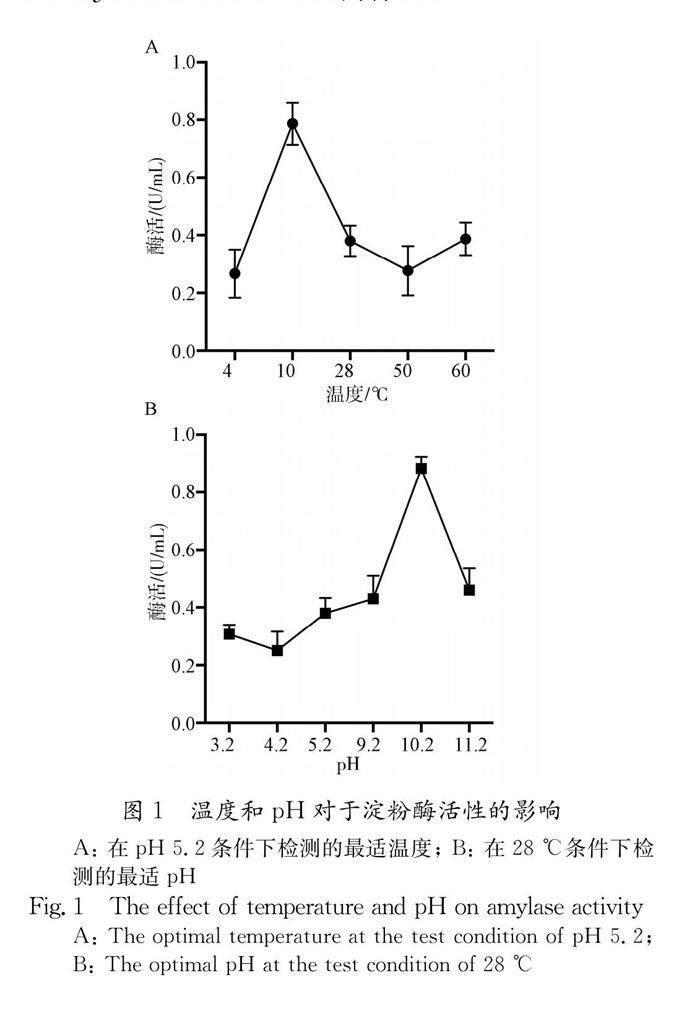
从采集到的土壤样品中,通过功能活性筛选法在248个可培养单菌落中分离得到24株可在其菌落周围形成明显水解圈的淀粉酶生产菌株.产淀粉酶菌株占总菌株的9.68%.通过探究温度和pH对分离菌株酶活的影响,获得一株在低温和碱性条件下仍具有较高淀粉酶活性的菌株,其编号为3F1.测定结果如图1所示,在pH 5.2条件下,其酶活在10 ℃时可达最高值,约为0.79 U/mL(图1A);在28 ℃条件下,其酶活在pH 10.2时可达最高值,约为0.88 U/mL(图1B).因此,3F1菌株作为一株低温碱性淀粉酶生产菌株,其酶活的最适温度为10 ℃和最适pH为10.2.
随后对3F1菌株进行了形态学观察.结果显示,该菌株在28 ℃培养16 h后的菌落形态特征表现为:直径大小约为1.48 mm,形态大致为圆形,颜色呈现乳白色,质地易挑起,表面无光泽,不透明,无隆起且边缘不规则.挑取该菌落进行革兰氏染色后在100倍光学显微镜下观察,该菌株为长杆状,革兰氏染色为阳性.生理生化性质分析显示: 3F1菌株过氧化氢酶、明胶液化和硝酸盐还原性以及V-P试验均呈阳性.通过16S rDNA序列比对和分析,初步鉴定3F1菌株属于蕈状芽孢杆菌(Bacillus mycoides),进而我们将其命名为Bacillus mycoides strain 3F1,简称Bm3F1.
3.2 菌株Bm3F1的发酵产酶条件优化
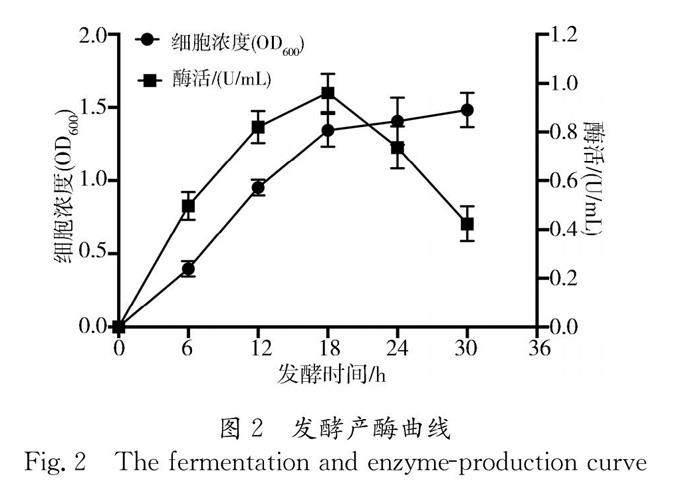
3.2.1 发酵时间对产酶的影响 为了确定Bm3F1在发酵培养过程中细菌生长情况与胞外淀粉酶酶活高低之间的关系,我们每隔6 h取样测定细胞浓度和酶活,绘制了该菌株的发酵产酶曲线,以探究其产酶模型和发酵时间对酶活的影响,结果如图2所示.在Bm3F1发酵产酶过程中,第三次取样即18 h前,该菌株处于生长对数期,其胞外酶活也随着细胞的快速生长而不断上升,并在18 h时达到最高值,约为0.96 U/mL.因此,在18 h内Bm3F1的产酶模型为同步合成型.随后,第四次取样即24 h后,该菌株生长明显减缓,进入生长平台期,其胞外酶活呈现显著下降趋势.第五次取样即30 h时其酶活低至0.42 U/mL.综上,Bm3F1菌株的最佳发酵时间为18 h.
3.2.2 培养基作用底物类型和浓度对产酶的影响发酵培养基中成分的变化会影响菌株的产酶能力.通过在发酵培养基中添加不同淀粉酶作用底物类型,即可溶性淀粉(直链淀粉)、普鲁兰多糖(支链淀粉)、蔗糖和麦芽糖(双糖),以探究底物类型对于菌株产酶的影响,结果如图3所示.不同作用底物类型对Bm3F1产淀粉酶有不同程度的影响,其中在发酵培养基中添加可溶性淀粉时,所产酶活性最高,其次是普鲁兰多糖.据此可初步确定该菌株生产的淀粉酶属于诱导型,即在发酵培养基环境中存在催化底物时,该酶可以高效合成并分泌到胞外,并且该淀粉酶种类属于直链淀粉酶.又通过对可溶性淀粉浓度的梯度设置,以确定最优底物浓度,结果如图4所示.当发酵培养基中可溶性淀粉的浓度为1.5%时,Bm3F1的酶活最高,约为3.07 U/mL.综上,在发酵培养基中添加1.5%可溶性淀粉可显著提高Bm3F1的产酶能力.
3.2.3 培养基初始pH和装液量对产酶的影响 培养基初始pH值不仅会影响细菌生长还会改变酶类活性.通过设定培养基初始pH梯度以考察初始pH对生产菌株酶活的影响,结果见图5.Bm3F1在培养基初始pH值为4.2~7.2时,其淀粉酶活性随pH值的升高而显著增强;当pH值为7.2~10.2时,其酶活虽呈现递减趋势,但相对稳定;当初始pH值为7.2时,其酶活达到最高值,约为3.52 U/mL.因此,选择培养基初始pH 7.2.在确定最佳初始pH值后,我们需要进一步探究培养基装液量对菌株产酶的影响,因为装液量可反映菌株发酵过程中对溶氧量的需求,直接影响菌株生长情况.在250 mL三角瓶中装入不同体积的培养基,以考察装液量对产酶的影响,结果见图6.装液量为10 mL/250mL时,Bm3F1菌株的产酶能力最强,其酶活可达8.29 U/mL;而装液量为25 mL/250 mL~150 mL/250 mL时,菌株的酶活逐渐减小,说明该菌株在发酵过程中需要较高的溶氧量.因此,我们选择10 mL/250 mL为培养基最适装液量.综上,培养基初始pH 7.2和装液量10 mL/250 mL可使Bm3F1菌株的酶活进一步提高.
3.2.4 发酵温度和菌体接种量对产酶的影响 发酵温度会显著影响细菌生长状况、代谢过程以及所产酶蛋白稳定性.通过设定发酵温度梯度以考察发酵温度对生产菌株酶活的影响,结果如图7所示. Bm3F1在发酵温度为20~30 ℃时, 其淀粉酶活性随着温度的升高而增强,当发酵温度为30~45 ℃时,其酶活呈现显著的递减趋势.当发酵温度为30 ℃时,其酶活达到最高值,约为9.58 U/mL.因此,选择发酵温度30 ℃.在确定最佳发酵温度后,我们需要进一步探究菌体接种量对菌株产酶的影响,因为接种量对于细菌细胞生长速率以及培养基营养成分消耗速率息息相关.通过设定接种量梯度以考察菌体接种量对产酶的影响,结果如图8所示.当Bm3F1菌体接种量为1.0%~9.0%时,其淀粉酶活性随着接种量的升高而增强,当接种量大于9.0%时,其酶活均下降.当接种量为9.0%时,其酶活达到最高值,约为13.58 U/mL.综上,我们确定Bm3F1的最佳发酵温度和最适菌体接种量分别为30 ℃和9.0%.
3.2.5 优化前后酶活对比 通过对上述发酵条件的逐一优化,最终确定了Bm3F1菌株的最佳发酵条件,即发酵时间为18 h、在发酵培养基中添加1.5%可溶性淀粉、培养基初始pH为7.2、装液量为10 mL/250 mL、发酵温度为30 ℃以及菌体接种量为9.0%.分别采用初始和最佳发酵条件对Bm3F1菌株进行发酵培养,并在10 ℃、pH 10.2条件下测定该菌株在优化前后的淀粉酶活性,其结果显示,逐步优化后的最终酶活可达13.58 U/mL,是优化前0.93 U/mL的14.60倍.
4 讨 论
本文从西藏林芝地区的土壤样品中筛选获得一株产低温碱性淀粉酶蕈状芽孢杆菌Bm3F1(Bacillus mycoides strain 3F1),其酶活最适条件为10℃、pH 10.2.有详细的文献记载蕈状芽孢杆菌(Bacillus mycoides)是一种耐寒性菌种,通常可以在7 ℃或者更低温度下生存[17, 18].据此,我们推测Bm3F1菌株自身的适冷生存性赋予了其体内所产酶类的低温活性.在寒冷恶劣的环境下,各种选择压力使得微生物不断进化适应,促使其体内产生独特的酶系统来适应生存环境.另外,芽孢杆菌属(Bacillus)来源淀粉酶通常用于碱性pH条件[19].例如2017年Simair等[20]分离获得一株碱性淀粉酶生产菌株Bacillus sp. BCC 01-50,其酶活的最适pH为9.0.相比之下,本文获得的Bm3F1菌株所产淀粉酶在碱适应性上更具备优势(pH 10.2).再如2018年Arabaci等[21]分离获得一株产低温碱性淀粉酶菌株Bacillus subtilis N8,其酶活最适条件为25 ℃、pH 8.0.相较而言,本文获得的低温碱性淀粉酶似乎具有更强的低温活性(10 ℃)和碱适应性(pH 10.2).
为了进一步挖掘Bm3F1生产菌株的工业应用价值和潜能,我们通过发酵条件优化来提高其产酶能力.研究结果发现该菌株所产淀粉酶的活性受到培养基作用底物类型和浓度、发酵时间和温度、培养基初始pH和装液量以及菌体接种量的影响.其中我们发现Bm3F1在发酵培养18 h后,其产酶活性开始呈现下降趋势.这是由于随着发酵培养时间的延长,菌株进入生长平台期以后,一方面可能停止生产淀粉酶,另一方面可能所合成的其他蛋白酶将部分淀粉酶降解,或者已分泌的胞外淀粉酶被离子螯合而失活.我们还发现培养基初始pH和装液量对Bm3F1菌株产淀粉酶能力具有明显影响.这是由于初始pH值不仅可通过改变细菌细胞膜的通透性和稳定性来影响菌体对外界营养成分的吸收以及阻碍产物酶蛋白的分泌,而且可通过影响发酵培养基成分的离子化程度使发酵液中的酶类活性发生变化.培养基装液量则通过影响发酵培养基的溶氧量直接影响菌株的生长速度.最后,我们发现Bm3F1菌株的发酵温度低于30 ℃不利于菌体生长而影响其产酶过程,可导致胞外淀粉酶积累量较低.而较高温度(35℃~45℃)则使菌株的产酶效果更差,严重影响其生长代谢过程;高温条件还会影响发酵液中淀粉酶的稳定性,从而导致酶活性显著降低.例如在45 ℃时酶活仅有0.98 U/mL.此外,我们发现Bm3F1菌体接种量为1.0%时酶活最低.这可能是由于接种量过小导致菌体生长速度较低,产酶活性也随之下降;而过高的接种量如11%~15%使得发酵液中的菌体细胞浓度过高,培养基营养成分快速消耗,最终导致菌体细胞提前衰老死亡,影响了淀粉酶的胞外积累.
本研究结果表明,采用了优化后的最佳发酵条件对Bm3F1进行发酵培养,其淀粉酶活性最终可达13.58 U/mL,较优化前提高了13.60倍.该菌株经优化后的酶活距离工业应用标准仍然具有一定差距,我们期望在未来实验中可通过对该菌株进行诱变选育来进一步提高其产酶量以提升其工业应用的潜能.
参考文献:
[1] Sun H, Zhao P, Ge X, et al. Recent advances in microbial raw starch degrading enzymes [J]. Appl Biochem Biotechnol, 2010, 160: 98.
[2] Mehta D, Satyanarayana T. Bacterial andarchaeal α-amylases: diversity and amelioration of the desirable characteristics for industrial applications [J]. Front Microbiol, 2016, 7: 1129.
[3] Elyasi far B, Ahmadi Y, Yari khosroshahi A, et al. Microbial alpha-amylase production: progress, challenges and perspectives [J]. Adv Pharm Bull, 2020,10: 350.
[4] Farooq M A, Ali S, Hassan A, et al. Biosynthesis and industrial applications of α-amylase: a review [J]. Arch Microbiol, 2021, 203: 1281.
[5] Erdal S E, Taskin M E. Production of α-amylase by Penicillium expansum MT-1 in solid-state fermentation using waste Loquat (Eriobotrya japonica Lindley) kernels as substrate [J]. Rom Biotech Lett, 2010, 15: 5342.
[6] Feller G, Lonhienne T, Deroanne C, et al. Purification, characterization, and nucleotide sequence of the thermolabile alpha-amylase from the antarctic psychrotroph Alteromonas haloplanctis A23 [J]. J Bio Chem, 1992, 267: 5217.
[7] Aghajari N, Feller G, Gerday C, et al. Crystal structures of the psychrophilic alpha-amylase from Alteromonas haloplanctis in its native form and complexed with an inhibitor [J]. Protein Sci, 1998, 7: 564.
[8] 徐玲, 唐茂妍, 陈旭东. 低温淀粉酶的耐温性研究 [J]. 饲料工业, 2010, 31: 13.
[9] 陈凯, 薛东红, 夏尚远, 等. 短短芽孢杆菌(Brevibacillus brevis)XDH菌株发酵培养基配方的研究 [J]. 山东农业大学学报: 自然科学版, 2006, 37: 190.
[10] 唐嘉, 陈朝银, 赵声兰, 等. 一种初筛产胞外淀粉酶菌株的简化方法 [J]. 生物加工过程, 2008, 6: 37.
[11] 刘杰雄, 陈号, 陆雯, 等. 淀粉酶高产菌株的筛选及其酶活的测定[J]. 食品工程, 2010, 1: 45.
[12] Yassin S N, Jiru T M, Indracanti M. Screening and characterization of thermostable amylase-producing bacteria isolated from soil samples of Adera, afar region, and molecular detection of amylase-coding gene [J]. Int J Microbiol, 2021, 2021: 5592885.
[13] Bernfeld P. Amylase, α and β [J]. Method Enzymol, 1955, 1: 149.
[14] 赵凯, 许鹏举, 谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008, 29: 534.
[15] 蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 370.
[16] Yoon S H, Ha S M, Kwon S, et al. Introducing EzBioCloud: a taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies [J]. Int J Syst Evol Micr, 2017, 67: 1613.
[17] Lechner S, Mayr R, Francis K P, et al. Bacillus weihenstephanensis sp. nov. is a new psychrotolerant species of the Bacillus cereus group [J]. Int J Syst Bacteriol, 1998, 48: 1373.
[18] Phan H, Sidorenko M L, Tsai P C, et al. Whole-genome shotgun sequence of Bacillus mycoides strain U53, a psychrotolerant bacterium isolated from the Sakhalin region in Russia [J]. Microbiol Resour Announc, 2021, 10: e01257-20.
[19] Kizhakedathil M P J, C S D. Acid stable α-amylase from Pseudomonas balearica VITPS19-production, purification and characterization [J]. Biotechnol Rep (Amst), 2021, 30: e00603.
[20] Simair A A, Qureshi A S, Khushk I, et al. Production and partial characterization of α-amylase enzyme from Bacillus sp. BCC 01-50 and potential applications [J]. Biomed Res Int, 2017, 2017: 9173040.
[21] Arabaci N, Arikan B. Isolation and characterization of a cold-active, alkaline, detergent stable α-amylase from a novel bacterium Bacillus subtilis N8 [J]. Prep Biochem Biotech, 2018, 48: 419.

