黄芪幼苗根系生长发育与GR24和IAA的关系
黄晓宇 庞娟 陈贵林




摘要:为探究独脚金内酯和生长素对黄芪根系生长发育的影响,该研究以膜荚黄芪和蒙古黄芪幼苗为材料,在种子萌发袋中添加不同浓度GR24和IAA(2 μmol·L1GR24、5 μmol·L1IAA和2 μmol·L1GR24+5 μmol·L1IAA),7 d后检测黄芪幼苗主根长和侧根数,并测定内源激素含量、生长素和独脚金内酯相关基因表达量的变化。结果表明:(1)GR24处理显著促进黄芪主根生长。(2)IAA处理下主根生长受到抑制,侧根数明显增加。(3)GR24+IAA处理下主根的生长同样受到抑制,膜荚黄芪侧根数较IAA处理下减少,说明GR24有抑制IAA对侧根发育的诱导作用,但不能缓解IAA对黄芪主根生长的抑制。(4)3种处理下黄芪幼苗根系内源激素含量、生长素和独脚金内酯相关基因表达量发生了显著变化,说明GR24和IAA对黄芪幼苗主根长和侧根数的影响可能与生长素和独脚金内酯相关基因表达及内源激素水平的变化有关。该研究结果初步阐明了黄芪幼苗根系生长发育与GR24和IAA之间的关系,为黄芪规范化育苗和幼苗质量控制提供理论依据,对进一步探索独脚金内酯和生长素调控黄芪根系生长发育的分子机制具有一定的意义。
关键词: 黄芪, 主根, 侧根, 独脚金内酯, 生长素, 基因表达
中圖分类号:Q945
文献标识码:A
文章编号:10003142(2022)05084510
Relationship between root growth and development
of Astragalus seedlings and GR24 and IAA
Abstract:In order to explore the effects of strigolactones and auxin on the growth and development of Astragalus roots, Astragalus membranaceus and A. membranaceus var. mongholicus seedlings were put into seed germination bag with different concentrations of GR24 and IAA (2 μmol·L1GR24, 5 μmol·L1IAA and 2 μmol·L1GR24+5 μmol·L1IAA). Primary root length and lateral root number of Astragalus seedlings were measured, and endogenous phytohormones, the expression levels of auxin and strigolactone related genes were determined after seven days treatment. The results were as follows: (1) GR24 treatment could significantly promote the growth of primary roots of Astragalus. (2) The growth of primary roots was inhibited under IAA treatment, and the number of lateral roots was significantly increased. (3) The growth of primary roots under GR24+IAA treatment was also inhibited, the number of lateral roots of A. membranaceus was reduced compared with that under IAA treatment, indicating that GR24 can inhibit the induction of IAA to lateral root development, but can not alleviate the inhibition of IAA to primary root growth. (4) The levels of endogenous hormones, auxin and strigolactone related gene expression in the root of Astragalus seedlings under the three treatments were changed significantly, indicating that the effects of GR24 and IAA on primary root length and lateral root number of Astragalus seedlings may be related to these changes. The results preliminarily clarify the relationship between the root growth and development of Astragalus seedlings and GR24 and IAA, and provide a theoretical basis for the standardized breeding and seedling quality control of Astragalus. It also has certain significance to further explore the molecular mechanism of strigolactones and auxin regulating the growth and development of Astragalus root.
Key words: Astragalus, primary roots, lateral roots, strigolactones, auxin, genes expression
生长素是最早发现且目前研究最多的一类植物激素,一直以来被认为是参与植物根系生长发育最关键的核心植物激素(Saini et al., 2013; Wei et al., 2016)。生长素的分布、极性运输和信号转导决定着植物根系的形态建成(Saini et al., 2013)。生长素在植物地上部幼嫩组织合成后,通过维管组织运输到根部(Ljung et al., 2005; Teale et al., 2006)。生长素输入载体AUX1/LAX、生长素输出载体PIN和ABCB转运蛋白介导生长素在细胞间的极性运输(Okushima et al., 2005; Vieten et al., 2007; Vanneste & Friml, 2009),使生长素在根部形成一定的浓度梯度,为根的生长发育提供所需的最佳生长素浓度(Teale et al., 2006)。而PIN蛋白在质膜的定位也进一步影响着细胞极性、生长素分布和根部组织分化(Aida et al., 2004)。在生长素调控根生长发育的信号转导过程中,了解最清晰的是泛素化介导的蛋白酶体降解途径。当生长素响应因子ARF被活化后,其会调控下游参与根生长发育的生长素应答基因表达,进而调控根的生长和发育(Guilfoyle & Hagen, 2007; Saini et al., 2013);生长素响应因子ARF7和ARF19通过激活LBD/ASL基因而调控侧根的形成(Okushima et al., 2007)。另外,Zhang等(2008)研究表明MAPK途径也参与生长素的极性运输与根的发育。
独脚金内酯是一类主要产生于植物根系的植物激素,最初发现其具有刺激寄生植物种子萌发的作用(Cook et al., 1966;Waldie et al., 2014)。进一步研究表明,它还能够促进丛枝菌根真菌菌丝分枝(Xie et al., 2010),抑制植物分枝(GomezRoldan et al., 2008; 冯丹和陈贵林,2011),调控植物根系的生长发育(Koltai, 2010; RuyterSpira et al., 2011; Hu et al., 2018)。拟南芥独脚金内酯合成突变体max3和max4及独脚金内酯信号突变体max2较野生型植株主根变短且侧根增加,表明独脚金内酯正调控主根的生长而负调控侧根形成(Kapulnik et al., 2011; RuyterSpira et al., 2011)。随着独脚金内酯类似物GR24的开发与利用及现代分子生物学技术的应用,发现GR24一方面通过抑制生长素外输载体活性影响生长素正常的极性运输,从而调控主根的生长和侧根的发育(Koltai et al., 2010;RuyterSpira et al., 2011);另一方面,通过刺激分生组织细胞分裂使细胞数量增加进而促进主根生长(RuyterSpira et al., 2011),但也有研究认为GR24促进了皮层细胞的伸长而不是细胞分裂(Koltai et al., 2010)。同时,GR24处理阻碍了侧根原基由V阶段向VI阶段的转换,因而抑制侧根形成(RuyterSpira et al., 2011);也有学者认为GR24影响侧根发生的起始并不影响侧根原基的发育(Kapulnik et al., 2011)。因此,关于独脚金内酯如何在细胞水平上调控植物根系的生长发育存在很多争论,对独脚金内酯如何在分子层面与细胞层面调控根系生长发育的进一步研究将有助于阐明独脚金内酯在植物根系形态结构建成中所发挥的重要作用。
黄芪作为中医临床上常用大宗中药材,以膜荚黄芪(Astragalus membranaceus)或蒙古黄芪(A. membranaceus var. mongholicus)的干燥根入藥,用量大且用途广泛(刘强等,2008;陈贵林,2018)。市场上主要以主根长、侧根数少的外观形态指标作为优质黄芪的主要评价标准。黄芪外观品质在一定程度上影响其有效成分含量。而在农业生产中,黄芪多以移栽苗的方式进行种植。因此,培育优质的黄芪幼苗对于提高黄芪的药用价值具有重要意义。目前,关于独脚金内酯和生长素调控植物根系生长发育的研究多集中于水稻、拟南芥和番茄等植物上,而对药用植物的研究却鲜有报道。因此,本文基于相关研究报道及前期对黄芪幼苗外施不同浓度的GR24和IAA处理的预实验结果,最终选取2 μmol·L1GR24、5 μmol·L1IAA和2 μmol·L1GR24 + 5 μmol·L1IAA对黄芪幼苗进行处理,研究GR24、IAA以及二者相互作用对黄芪根系形态、内源激素水平和独脚金内酯与生长素相关基因表达的影响,为黄芪规范化育苗和幼苗质量控制提供科学依据,同时也为独脚金内酯和生长素调控药用植物根系生长发育的分子机制研究奠定基础。
1材料与方法
1.1 材料
以膜荚黄芪(Astragalus membranaceus)和蒙古黄芪(A. membranaceus var. mongholicus)为材料,黄芪种子均采购于内蒙古丰镇市天创农牧业有限公司。
1.2 实验设计
分别取适量的膜荚黄芪和蒙古黄芪种子于50 mL离心管中,清水冲洗干净,95%乙醇溶液消毒1 min,0.1% HgCl溶液消毒30 s,无菌水冲洗5~6次,浸泡4 h。之后,将黄芪种子播种于铺有无菌水浸湿滤纸的培养皿(规格:9 cm)后置于24 ℃恒温培养箱中黑暗培养。
以1/2 MS营养液为母液,通过添加IAA(3吲哚乙酸)和GR24(人工合成的独脚金内酯类似物)配制不同IAA浓度(0.04、0.2、1和5 μmol·L1)和GR24浓度(0.01、0.1、1和2 μmol·L1)的营养液,pH值5.8。采用种子萌发袋(高14 cm,宽12.5 cm;北京启维益成科技有限公司)培养幼苗,每个种子萌发袋中添加10 mL不同IAA浓度和GR24浓度的营养液,对照组(CK)添加10 mL蒸馏水。待黄芪种子黑暗条件下萌发3 d后,将下胚轴长约1 cm、长势一致的黄芪幼苗转移到种子萌发袋中(图版I)。每个种子萌发袋放入6株黄芪幼苗,为一个处理,每处理3个种子萌发袋,两种黄芪共计30个种子萌发袋180株幼苗。将幼苗置于24 ℃ 恒温生长室中培养,培养条件为16 h/8 h光周期。每个种子萌发袋隔2 d补充一次1/2 MS营养液,处理7 d后取样,测量幼苗主根长和统计幼苗侧根数。根据以上不同IAA浓度和GR24浓度的处理结果,最终筛选2 μmol·L1GR24、5 μmol·L1IAA和2 μmol·L1GR24+5 μmol·L1IAA分别对黄芪幼苗进行处理,处理7 d后取样,检测幼苗主根长、侧根数,并测定幼苗根系内源激素含量、独脚金内酯和生长素相关基因表达量。
1.3 方法
1.3.1 根系形态指标测定收集每个处理18株黄芪幼苗,将根部冲洗干净,使用直尺测量主根长,在体式显微镜(Leica EZ4 HD)下观察侧根,人工统计侧根数量。
1.3.2 内源激素含量测定
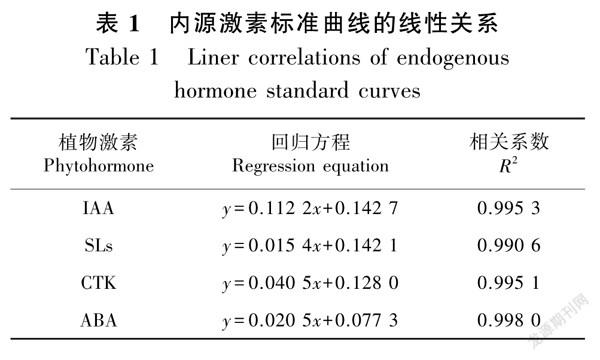
黄芪幼苗根系生长素(IAA)、独脚金内酯(SLs)、脱落酸(ABA)和细胞分裂素(CTK)含量参照朱莉莉等(2020)的方法进行提取,采用植物激素酶联免疫分析(ELISA)试剂盒(上海酶联生物科技有限公司)进行检测,使用全光谱酶标仪(美国赛默飞世尔科技公司)在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中植物激素含量,各激素标准曲线的线性关系如表1所示。
1.3.3 黄芪根系总RNA提取及反转录按照全式金生物技术有限公司提供的Easy Pure Plant RNA kit试剂盒提取各处理组黄芪幼苗根系总RNA。1%琼脂糖凝胶电泳鉴定RNA完整性,采用NanoDrop 2000紫外分光光度计对其浓度和纯度进行检测。参照该公司提供的TransScript AllinOne FirstStrand cDNA Synthesis SuperMix for qPCR(OneStep gDNA Removal)逆转录试剂盒将总RNA合成cDNA,放于-20 ℃下保存。
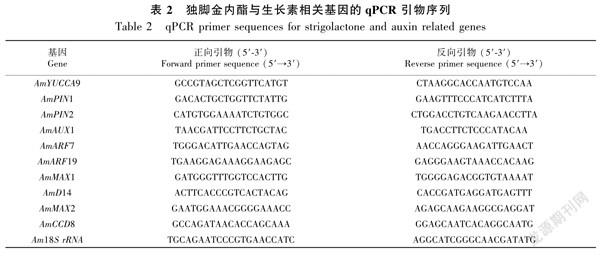
1.3.4 荧光定量PCR采用TransStart Tip Green qPCR SuperMix试剂盒进行荧光定量PCR检测基因的表达量,使用primer express 3.0.1设计引物(Singh & Pandey, 2015),引物见表2。qPCR反应体系为20 μL,包括2×TransStart Tip Green qPCR SuperMix 10 μL、正反向引物各0.4 μL(10 μmol·L1)、Nucleasefree Water 7.2 μL、模板cDNA 2 μL(10 ng·μL1)。反应程序:94 ℃预变性3 min;94 ℃ 5 s,58 ℃ 34 s,72 ℃ 30 s,重复40个循环,每个样品做3个重复。以18S rRNA作为内参基因,采用2-ΔΔCT方法(Livak & Schmittgen, 2001)分析基因的表达量,实验仪器采用ABI Prism 7500荧光定量PCR仪。
1.4 数据分析
采用SPSS 22.0软件统计分析结果,进行单因素方差分析(ANOVA),并使用GraphPad Prism 8绘制柱状图,结果用平均值±标准误显示。
2结果与分析
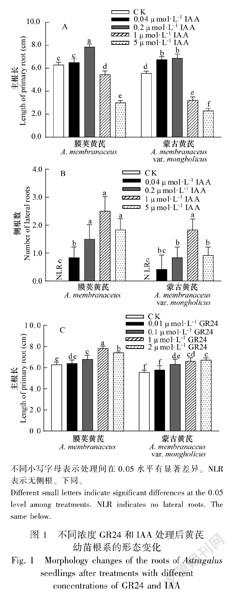
2.1 不同浓度GR24与IAA对黄芪幼苗主根长和侧根数的影响
由图1可知,随着IAA处理浓度的升高,两种黄芪主根长呈先增长后降低的趋势。与CK相比,0.2 μmol·L1 IAA显著促进黄芪主根的生长,1 μmol·L1 IAA和5 μmol·L1 IAA抑制了主根的生长。不同浓度IAA处理下侧根数与CK相比均明显增加。0.1 μmol·L1 GR24、1 μmol·L1 GR24和2 μmol·L1 GR24处理下主根长均显著高于CK,且随浓度的升高主根长呈增加的趋势;而CK和不同浓度GR24处理下均未见黄芪侧根发育和生长。表明GR24可促进黄芪主根的生长,其中1 μmol·L1 GR24和2 μmol·L1 GR24作用效果较显著;0.04 μmol·L1 IAA和0.2 μmol·L1 IAA可促進黄芪主根的生长,1 μmol·L1 IAA和5 μmol·L1 IAA抑制主根的生长;不同浓度IAA对黄芪侧根的发育均具有促进作用。
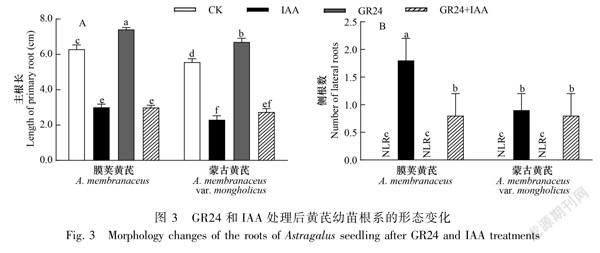
2.2 GR24与IAA对黄芪幼苗主根长和侧根数的影响
由图2可知,CK和IAA、GR24和GR24+IAA处理下黄芪主根随着生长天数的增加均呈逐渐增长的趋势;GR24处理的两种黄芪主根明显长于同一生长时期CK的黄芪主根,蒙古黄芪的变化趋势略小于膜荚黄芪;而IAA和GR24+IAA处理的黄芪主根均明显短于CK,且较CK生长缓慢。
由图3可知,与CK相比,GR24处理的两种黄芪主根显著增长,侧根数没有发生显著变化;IAA处理下两种黄芪主根显著变短、侧根数增加,且膜荚黄芪侧根数显著多于蒙古黄芪;GR24+IAA处理下两种黄芪主根仍显著短于CK,与IAA单独处理下无显著差异,膜荚黄芪侧根数显著少于IAA单独处理。表明GR24处理对黄芪主根生长具有促进作用;IAA抑制黄芪主根生长,诱导侧根发生;GR24+IAA处理下,GR24不能缓解IAA对黄芪主根生长的抑制,可以抑制IAA对膜荚黄芪侧根发生的诱导。
2.3 GR24与IAA对黄芪幼苗根系内源激素含量的影响
与CK相比,IAA、GR24和GR24+IAA处理均增加了膜荚黄芪根系IAA和SLs含量(图4:A,B),而CTK和ABA含量显著降低(图4:C,D)。另外,3种处理也均显著增加了蒙古黄芪根系IAA含量,但对其根系CTK和ABA含量变化没有显著影响,SLs含量在GR24和GR24+IAA处理下显著增加(图4)。表明IAA和GR24处理显著影响了两种黄芪根系内源激素水平,且膜荚黄芪与蒙古黄芪根系内源激素水平变化存在一定的差异。
2.4 GR24与IAA对黄芪幼苗根系生长素相关基因表达的影响
由图5可知,与CK相比,IAA处理显著增加了AmPIN1、AmPIN2和AmARF19基因在膜荚黄芪根系的表达,而降低了AmARF7基因表达;蒙古黄芪根系AmPIN1、AmARF7和AmARF19基因表达量均显著增加,且AmPIN1和AmARF7基因的表达均显著高于膜荚黄芪,AmPIN2基因在蒙古黄芪根系的表达显著降低。GR24处理的膜荚黄芪根系与CK相比,AmPIN1、AmPIN2和AmARF7基因表达显著降低,蒙古黄芪根系中仅AmPIN1和AmARF7基因表达降低。GR24+IAA处理增加了AmPIN1、AmPIN2基因在膜荚黄芪根系的表达, 降低了AmARF7基因的表
达;而蒙古黄芪根系仅AmPIN1表达增加,AmARF7表达减少。表明GR24和IAA影响了黄芪根系生长素相关基因的表达,且膜荚黄芪与蒙古黄芪具有差异的基因表达模式。
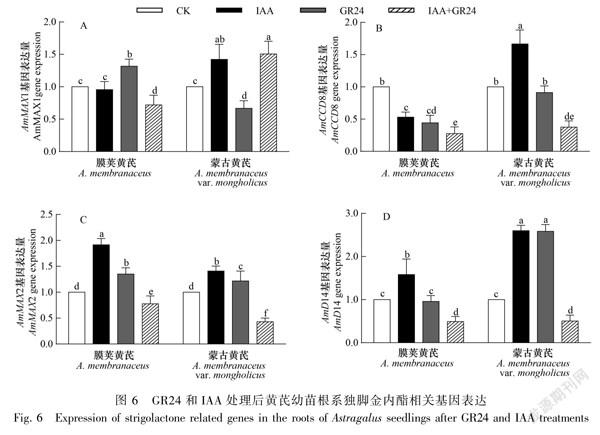
2.5 GR24与IAA对黄芪幼苗根系独脚金内酯相关基因表达的影响
由图6可知,与CK相比,IAA处理显著增加了膜荚黄芪根系AmMAX2和AmD14基因的表达,AmCCD8的表达减少;蒙古黄芪根系AmMAX1、AmCCD8、AmMAX2和AmD14的表达均显著增加,且AmMAX1、AmCCD8和AmD14的表达显著高于膜荚黄芪。GR24处理显著增加了膜荚黄芪根系AmMAX1和AmMAX2基因的表达,降低了AmCCD8基因的表达;蒙古黄芪根系AmMAX2和 AmD14表达水平增加,AmMAX1表达降低。GR24+IAA处理均降低了AmCCD8、AmMAX2和AmD14基因在膜荚黄芪和蒙古黄芪根系表达量,增加了AmMAX1基因在蒙古黄芪中的表达,降低了其在膜荚黄芪中的表达。表明IAA和GR24同时也影响了黄芪根系独脚金内酯相关基因的表达,且独脚金内酯相关基因在膜荚黄芪与蒙古黄芪根系也具有差异的基因表达模式。
3讨论与结论
已有研究表明,独脚金内酯影响植物根系的形态结构,且生长素是调控植物根系生长发育的关键激素,本研究深入探究了独脚金内酯和生长素与黄芪根系生长发育之间的关系。GR24处理显著促进了膜荚黄芪和蒙古黄芪幼苗主根的生长,主根的长度明显增加。这与前人对番茄(Koltai et al., 2010)、水稻(RuyterSpira et al., 2011)和高茅草(Hu et al., 2018)的研究结果一致,说明独脚金内酯对植物主根具有正调控作用。通常,生长素在低浓度下会促进植物根的生长,高浓度抑制根的生长,促进侧根发育(Xing et al., 2016; Lu et al., 2019),在黄芪中也得到了相同的结果。两种黄芪幼苗在5 μmol·L1 IAA处理下主根生长均受到抑制,侧根数增加。GR24+IAA共同作用下,主根长较IAA单独处理下无显著差异,膜荚黄芪侧根数量却明显减少,说明GR24可以减轻IAA对侧根发育的诱导。
PIN1和PIN2基因是生长素输出载体PINs家族的两个成员,在生长素运输和根系生长素浓度梯度的建立过程中发挥着重要作用(Blilou et al., 2005; Blakeslee et al., 2005; Saini et al., 2013)。本研究中qPCR结果表明GR24处理的两种黄芪幼苗根系AmPIN1基因表达下调,AmPIN2在膜荚黄芪根系表达下调,说明GR24抑制了生长素运输基因的表达,进而可能通过影响生长素向根系的极性运输,打破根系生长素浓度梯度的平衡,促进黄芪主根生长。IAA和GR24+IAA处理促进了AmPIN1基因和AmPIN2基因的表达,因此黄芪幼苗主根生长受到了抑制。Hu等(2019)研究表明,GR24同样抑制了高茅草冠根PIN1和PIN2基因的表达,NAA和NAA+GR24处理促进了PIN1和PIN2基因表达,与我们的结果相一致。因此,进一步证实了GR24可能通过影响生长素运输而调控黄芪根系生长和发育。同时,我们发现AmPIN2基因在蒙古黄芪幼苗根系中的表达与膜荚黄芪存在差异,这可能由于膜荚黄芪与蒙古黄芪之间遗传上的差异和信号转导的复杂性所致。
除了生长素运输载体外,生长素响应因子ARFs也参与调控根的生长和发育(Guilfoyle & Hagen, 2007; Chen et al., 2018; Guan et al., 2019)。本研究中,IAA处理下AmARF7和AmARF19的表达在蒙古黄芪幼苗根中上调。Chen等(2019)研究发现缩节胺使棉花幼苗根中GhARF7/19和GhLBD18s基因表达上调而促进了侧根起始和侧根伸长生长,从而使侧根数量增加。Okushima等(2007)研究表明,ARF7和ARF19作为转录激活因子,通过激活LBD/ASL基因的表达来促进侧根形成。因此,推测IAA可能同样通过诱导黄芪根中AmARF7和AmARF19基因表达,促进了侧根发育,侧根数量增加;GR24+IAA处理下AmARF7和AmARF19基因在蒙古黄芪根系表达量相比IAA处理下减少,因而侧根的发育被减缓。但是AmARF7和AmARF19是否通过诱导AmLBDs基因的表达而促进黄芪侧根发育还需要进一步的探究。另外,与CK相比,虽然GR24处理的两种黄芪根系中AmARF7的表达发生下调,但是CK组和GR24处理下侧根均未发育,这可能是由于幼苗生长周期较短所致,因而GR24对侧根的发育是否具有抑制作用,还需要进一步研究。
生长素还会通过影响独脚金内酯的合成和信号转导,进一步调控植物根的生长和发育(Saini et al., 2013; Hu et al., 2018)。Hu等(2018)研究表明,NAA处理能够显著上调高茅草冠根中独脚金内酯信号转导基因D3和D14的表达。本研究中,IAA处理后独脚金内酯合成基因MAX1和CCD8在蒙古黄芪幼苗根中显著上调,独脚金内酯信号转导基因MAX2和D14的表达在膜荚黄芪和蒙古黄芪中均上调。因此,IAA可能通过诱导MAX1和CCD8基因表达,促进独脚金内酯合成,使其含量增加;独脚金内酯进一步通过影响生长素运输和信号转导途径而调控根的生长和发育;同时通过其自身的信号转导而调控根的生长和发育。
在植物根的生长发育过程中,每个植物激素并不是单独地发挥作用,而是互相之间形成动态的反馈环,协同控制根的形成与发育(Hayward et al., 2009;Saini et al., 2013)。研究表明生长素与独脚金内酯能够显著影响根系内源激素水平和分布(Hayward et al., 2009)。本研究IAA、GR24和GR24+IAA处理均导致膜荚黄芪根系IAA和SLs含量增加,CTK和ABA含量减少;在蒙古黄芪根系中IAA和SLs含量增加,CTK和ABA含量没有显著变化。因此,说明外源激素信号改变了黄芪根系激素的內稳态,且内源激素水平的变化在不同黄芪中表现出很大的差异性。这种激素水平的变化,可能导致各个激素之间形成新的信号转导网络,协调互作从而参与植物生长过程,进而改变黄芪根系的生长发育;另外,两种黄芪的遗传差异,可能导致对外源激素信号应答水平的不同,所以出现差异的内源激素水平变化。今后对不同黄芪内源激素变化的深入研究,将有助于进一步理解黄芪对外源信号刺激的应答机制。
綜上所述,本研究发现2 μmol·L1GR24处理可促进黄芪主根生长且可以抑制IAA对黄芪侧根发育的诱导,对培育优质黄芪种苗具有重要实践意义。GR24和IAA对黄芪根系结构的改变可能与生长素和独脚金内酯相关基因表达的改变及内源激素水平变化有关,为阐明独脚金内酯和生长素调控黄芪根系生长发育的分子机制奠定了基础,独脚金内酯和生长素如何在细胞水平及与其他植物激素之间精细的互作调控黄芪根系的生长发育今后还有待研究。
参考文献:
AIDA M, BEIS D, HEIDSTRA R, et al., 2004. The PLETHORA genes mediate patterning of the Arabidopsis root stem cell niche[J]. Cell, 119(1): 109-120.
BLAKESLEE JJ, PEER WA, MURPHY AS, 2005. Auxin transport[J]. Curr Opin Plant Biol, 8(5): 494-500.
BLILOU I, XU J, WILDWATER M, et al., 2005. The PIN auxin efflux facilitator network controls growth and patterning in Arabidopsis roots[J]. Nature, 433(7021): 39-44.
CHEN XJ, ZHAN M, WANG M, et al., 2018. The effects of mepiquat chloride on the lateral root initiation of cotton seedlings are associated with auxin and auxinconjugate homeostasis[J]. BMC Plant Biol, 18(1): 361-375.
CHEN GL, 2018. Astragalus membranaceus biological research[M]. Beijing: Science Press: 1-3.[陈贵林, 2018. 黄芪生物学研究 [M]. 北京: 科学出版社: 1-3.]
COOK CE, WHICHARD LP, TURNER B, et al., 1966. Germination of witchweed (Striga lutea Lour.): isolation and properties of a potent stimulant[J]. Science, 154(3753): 1189-1190.
FENG D, CHEN GL, 2011. Research progress on strigolactone regulation of collateral development[J]. Chin J Ecol, 30(2): 349-356.[冯丹, 陈贵林, 2011. 独脚金内酯调控侧枝发育的研究进展 [J]. 生态学杂志, 30(2): 349-356.]
GOMEZROLDAN V, FERMAS S, BREWER PB, et al., 2008. Strigolactone inhibition of shoot branching[J]. Nature, 455(7210): 189-94.
GUILFOYLE TJ, HAGEN G, 2007. Auxin response factors[J]. Curr Opin Plant Biol, 10(5): 453-460.
GUAN L, TAYENGWA R, CHENG ZM, et al., 2019. Auxin regulates adventitious root formation in tomato cuttings[J]. BMC Plant Biol, 19(1): 435-451.
HAYWARD A, STIRNBERG P, BEVERIDGE C, et al., 2009. Interactions between auxin and strigolactone in shoot branching control[J]. Plant Physiol, 151(1): 400-412.
HU QN, ZHANG SX, HUANG BR, 2018. Strigolactones and interaction with auxin regulating root elongation in tall fescue under different temperature regimes[J]. Plant Sci, 271: 34-39.
KAPULNIK Y, DELAUX PM, RESNICK N, et al., 2011. Strigolactones affect lateral root formation and roothair elongation in Arabidopsis[J]. Planta, 233(1): 209-216.
KOLTAI H, DOR E, HERSHENHORN J, et al., 2010. Strigolactones’ effect on root growth and roothair elongation may be mediated by auxinefflux carriers[J]. J Plant Growth Regul, 29(2): 129-136.
LIVAK KJ, SCHMITTGEN TD, 2001. Analysis of relative gene expression data using realtime quantitative PCR and the 2- ΔΔCT method[J]. Methods, 25(4): 402-408.
LIU Q, ZHANG ZS, CONG LN, et al., 2008. Isolation of protoplast from the Astragalus membranaceus[J]. Guihaia, 28(3): 411-413. [刘强, 张宗申, 丛丽娜, 等, 2008. 黄芪原生质体分离技术 [J]. 广西植物, 28(3): 411-413.]
LJUNG K, HULL AK, CELENZA J, et al., 2005. Sites and regulation of auxin biosynthesis in Arabidopsis roots[J]. Plant Cell, 17(4): 1090-1104.
LU CC, CHEN MX, LIU R, et al., 2019. Abscisic acid regulates auxin distribution to mediate maize lateral root development under salt stress[J]. Front Plant Sci, 10: 716.
OKUSHIMA Y, OVERVOORDE PJ, ARIMA K, et al., 2005. Functional genomic analysis of the auxin response factor gene family members in Arabidopsis thaliana: unique and overlapping functions of ARF7 and ARF19[J]. Plant Cell, 17(2): 444-463.
OKUSHIMA Y, FUKAKI H,ONODA M, et al., 2007. ARF7 and ARF19 regulate lateral root formation via direct activation of LBD/ASL genes in Arabidopsis[J]. Plant Cell, 19(1): 118-130.
RUYTERSPIRA C, KOHLEN W, CHARNIKHOVA T, et al., 2011. Physiological effects of the synthetic strigolactone analog GR24 on root system architecture in Arabidopsis: another belowground role for strigolactones[J]. Plant Physiol, 155(2): 721-734.
SAINI S, SHARMA I, KAUR N, et al., 2013. Auxin: a master regulator in plant root development[J]. Plant Cell Rep, 32(6): 741-757.
SINGH A, PANDEY GK, 2015. Primer design using primer express for SYBR greenbased quantitative PCR[J]. Methods Mol Biol, 1275: 153-164.
TEALE WD, PAPONOV IA, PALME K, 2006. Auxin in action: signalling, transport and the control of plant growth and development[J]. Nat Rev Mol Cell Biol, 7(11): 847-859.
VANNESTE S, FRIML J, 2009. Auxin: a trigger for change in plant development[J]. Cell, 136(6): 1005-1016.
VIETEN A, SAUER M, BREWER PB, et al., 2007. Molecular and cellular aspects of auxintransportmediated development[J]. Trends Plant Sci, 12(4): 160-168.
WALDIE T, MCCULLOCH H, LEYSER O, 2014. Strigolactones and the control of plant development: lessons from shoot branching[J]. Plant J, 79(4): 607-622.
WEI X, LEACH RB, ROBERT PK, et al., 2016. Cyclic programmed cell death stimulates hormone signaling and root development in Arabidopsis[J]. Science, 351(6271): 384-387.
XIE X, YONEYAMA K, YONEYAMA K, 2010. The strigolactone story[J]. Ann Rev Phytopathol, 48(1): 93-117.
XING L, ZHAO Y, GAO JH, et al., 2016. The ABA receptor PYL9 together with PYL8 plays an important role in regulating lateral root growth[J]. Sci Rep, 6(1): 27177-27190.
ZHANG XD, XIONG YQ, DEFRAIA C, et al., 2008. The Arabidopsis MAP kinase kinase 7: A crosstalk point between auxin signaling and defense responses?[J]. Plant Sign Behav, 3(4): 272-274.
ZHU LL, CHEN YW, WANG PT, et al., 2020. Optimization of HPLCMS/MS method for simultaneous quantification of six classes of endogenous hormones in plant[J]. J Henan Univ (Nat Sci Ed), 50(3): 298-304. [朱莉莉, 陳雅雯, 王棚涛, 等, 2020. HPLCMS/MS同时测定植物6种内源激素含量方法的优化 [J]. 河南大学学报(自然科学版), 50(3): 298-304.]
(责任编辑周翠鸣)
收稿日期:2021-07-04
基金项目:国家自然科学基金(81660630);内蒙古自治区科技重大专项课题(ZDZX2018049);内蒙古科技厅项目(201702114)
第一作者: 黄晓宇(1995-),硕士研究生,主要从事药用植物化学研究,(Email)huangxiaoyu2340322@163.com。
通信作者:陈贵林,博士,教授,博士生导师,主要从事药用植物化学研究,(Email)guilinchen61@163.com。

