昼夜节律调节心律失常的机制及治疗药物的研究进展
张乐 邓嘉禾 马琳琳 宁忠平 李延飞

[基金项目:浦东新区卫生健康委员会临床高峰学科建设计划(PWYgf2021-04)
通信作者:李延飞,E-mail:liyf@sumhs.edu.cn]
【摘要】昼夜节律是一种正常生理节律,调控着机体的生理机能以适应外界环境的变化,对包括心脏在内的机体众多生理和病理过程发挥重要作用,其紊乱易导致心律失常的发生。现综述昼夜节律调节心律失常发生的分子基础及机制,归纳了伊伐布雷定、β1受体阻滞剂、莫雷西嗪、胺碘酮等治疗药物通过改变昼夜节律基因,发挥抗心律失常作用的机制,旨在为心律失常的预防、治疗及术后康复提供新的治疗思路。
【关键词】昼夜节律;生物钟;心律失常;抗心律失常药
【DOI】10.16806/j.cnki.issn.1004-3934.2023.12.000
Mechanism and Therapeutic Drugs of
Circadian Rhythm Regulating Arrhythmia
ZHANG Le1,DENG Jiahe2,MA Linlin2,NING Zhongping3,LI Yanfei3,4
(1.Graduate School of Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China;2.Department of Medical Technology,Shanghai University of Medicine&Health Sciences,Shanghai 201318,China;3.Department of Cardiology,The Zhoupu Hospital of Shanghai Medicine&Health Sciences University,Shanghai 201318,China;4.Shanghai University of Traditional Chinese Medicine,Pudong New District,Shanghai 201203,China)
【Abstract】Circadian rhythm is a normal physiological rhythm that regulates the physiological function of the body to adapt to changes in the external environment. It plays an important role in many physiological and pathological processes of the body,including the heart,and its disorder can easily lead to arrhythmia. This article reviews the molecular basis and mechanism of circadian rhythm regulation of arrhythmia,and summarizes the mechanism of antiarrhythmic effects of ivabradine,β1 receptor blocker,moricizine,amiodarone and other therapeutic drugs by changing biologi-cal clock genes,aiming to provide new ideas for the prevention,treatment and postoperative rehabilitation of arrhythmia.
【Key words】Circadian rhythm;Biological clock;Arrhythmia;Antiarrhythmics
心律失常是心臟起搏异常或传导障碍引起的心脏搏动频率和节律异常,并对人生命造成巨大威胁的一类心血管疾病。据统计,全球心律失常患者约4 000万例,每年因心律失常直接或间接导致的心脏性猝死居全球死因首位,其中80%的心源性猝死由室性心律失常所致[1-2]。研究[3-4]已证实电生理紊乱、氧化应激、缝隙连接重塑和心肌纤维化增强是导致心律失常的重要机制。近年来发现,多种心律失常的发生呈现明显的昼夜节律,提示心律失常可能受到昼夜节律基因的调控[5]。
1 昼夜节律调控通路概述
昼夜节律也称生物钟,是生物体长期因光照、温度以及湿度等环境因素形成的以24 h为一个周期的生理性节律变化。这种节律性行为通过调节生物体内源性细胞与分子活动,在白天/夜晚和睡眠/觉醒的生物规律中发挥关键作用。昼夜节律的紊乱易导致睡眠障碍,增加心血管疾病和代谢紊乱的风险,对患者的生活质量和寿命有重大影响[6]。
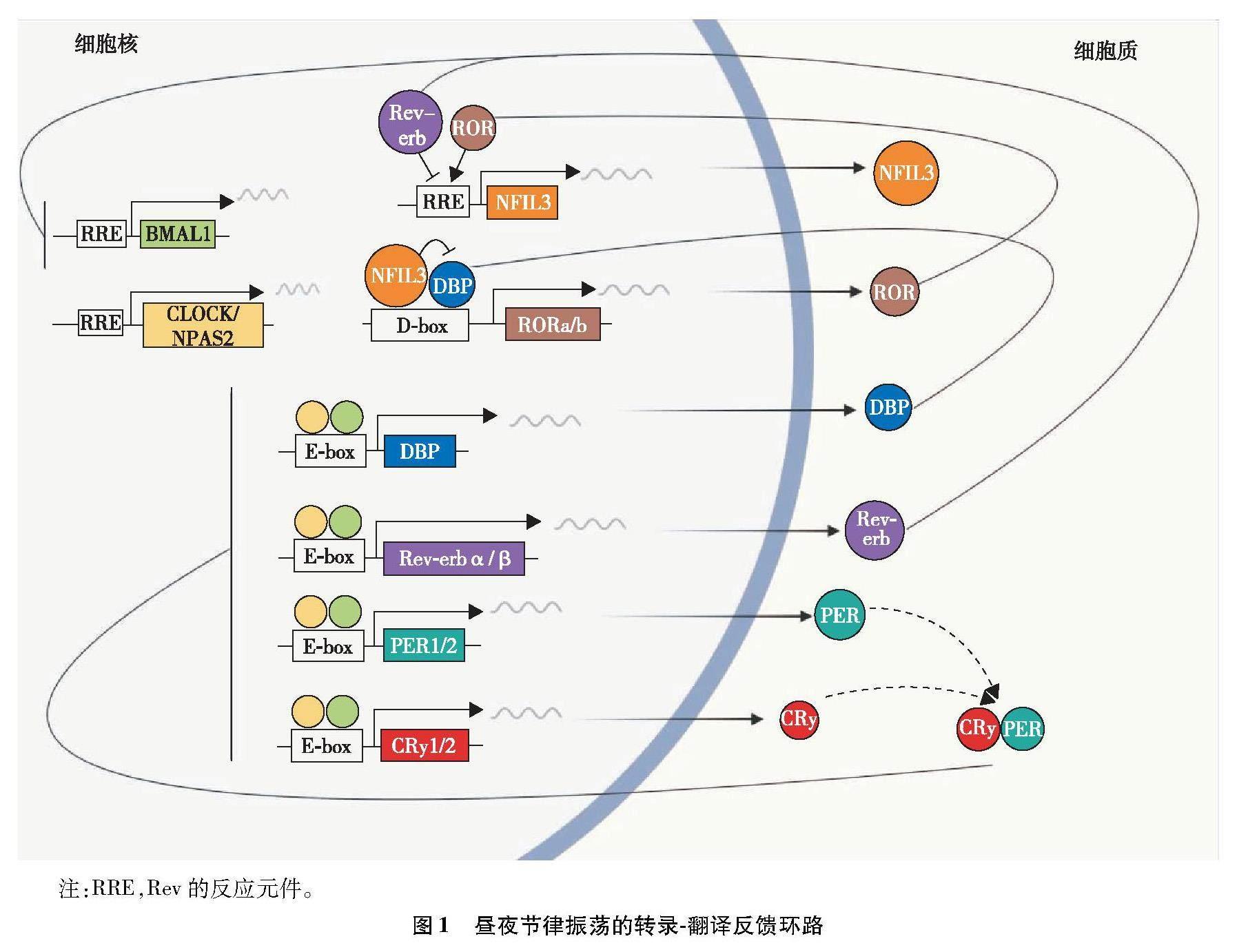
光线刺激通过视网膜到达下丘脑视交叉上核(suprachiasmatic nucleus,SCN)的中央昼夜节律钟,被整合并转化为输出信号到外周生物钟。生物钟节律性振荡的分子机制受到三条转录-翻译反馈环路的调控。第一条:昼夜运动输出周期蛋白(circadian locomotor output cycles kaput,CLOCK)和神经元PAS结构域蛋白2(neuronal PAS domain protein 2,NPAS2)分别与脑和肌肉Arnt样蛋白1(brain and muscle Arnt-like protein 1,BMAL1)在细胞核内形成异源二聚体,并结合到周期昼夜节律调节因子(period,PER)、隐花色素昼夜节律调节因子(cryptochrome circadian regulator,CRy与图一一致因此不改、孤核受体(nuclear receptor,Rev-erb)和D-box结合的PAR bZIP转录因子(D-box binding PAR bZIP transcription factor,DBP)基因的E-box区域,从而激活它们的转录。随着PER和CRy蛋白在细胞质中逐渐累积,形成的PER/CRy异二聚体重新进入细胞核,抑制CLOCK/NPAS2-BMAL1介导的PER和CRy基因的转录,使PER和CRy转录及蛋白水平降低。第二条:CLOCK-BMAL1激活的Rev-erbα/β节律性抑制BMAL1和白细胞介素-3介导的核因子(nuclear factor interleukin-3 regulated,NFIL3)的转录。第三条:CLOCK-BMAL1激活DBP的转录,DBP与NFIL3在D-box区域结合,从而激活视黄酸相关孤儿受体((retinoic acid receptor-related orphan receptor ,RORa/b),RORa/b进一步激活NFIL3的转录,NFIL3又反过来抑制DBP,以调节RORa/b的转录节律[7-8]。这三条互锁的转录反馈环路组合在一起,使生物钟基因发生了24 h昼夜节律振荡(图1)。
图1 昼夜节律振荡的转录-翻译反馈环路
2 昼夜节律调控心律失常的分子机制
昼夜节律的产生受中枢生物钟和外周生物钟调控。中枢生物钟通过自主神经系统(autonomic nervous system,ANS)和其他神经体液因子直接影响心律失常的进展,而心脏局部的外周生物钟可能通过驱动心脏离子通道表达的昼夜节律,影响心律失常的发生基础[7,9]。
2.1 通过ANS和神经-体液因子调节心脏电生理
2.1.1 ANS
心率、心率变异性、血压、心输出量、QT间期和ANS的活动等心血管相关参数通常在早晨达到峰值,在夜间下降到最低点,反映了昼夜节律对心脏的节律调控[10]。心率的变化主要是由交感和副交感神经系统这两个ANS的分支,通过缩血管、扩血管和促炎性细胞因子等神经-体液因子的循环进行调节。心率昼夜振荡的最低点与夜间副交感神经活动的增强有关,而最高点与白天交感神经张力的变化有关。Barazi等[11]通过觀察腹腔注射阿托品和普萘洛尔的小鼠,分别阻断副交感和交感神经系统,发现小鼠心率的昼夜节律完全丧失,且心室钾通道亚单位的昼夜节律表达也丢失了,提示ANS通过影响离子通道的转录,调节心率的昼夜节律。
2.1.2 神经-体液因子
2.1.2.1 异丙肾上腺素与去甲肾上腺素:异丙肾上腺素和去甲肾上腺素作为肾上腺素能受体(adrenergic receptor,AR)激动剂,已被证明能刺激局部心脏时钟和昼夜节律基因的表达,如异丙肾上腺素能增强小鼠心室外植体的昼夜节律基因PER2的表达[12]。去甲肾上腺素能增强大鼠心肌细胞Rev-erb、PER和BMAL1的昼夜节律表达[13],因此ANS可能通过同步局部心脏时钟,导致昼夜节律基因的表达发生变化,进而影响心率的昼夜节律。此外,去甲肾上腺素还可逆转恒定黑暗条件下的褪黑素(melatonin,MT)持续减少导致的心律失常[14]。
2.1.2.2 醛固酮与糖皮质激素:Fletcher[15]等证明了醛固酮促进大鼠心肌细胞和小鼠心脏中生物钟基因BMAL1、CRy1、PER1、PER9和REV-ERBA的昼夜节律表达。而糖皮质激素显著诱导昼夜节律基因PER1、PER2、REV-ERBα的表达也已被证实[16-19],提示二者与生物钟信号传导之间有重要联系。此外,在过表达盐皮质激素受体的小鼠心肌细胞上观察到离子通道重构,心室复极延长,导致严重的室性心律失常。但糖皮质激素能否通过影响心脏离子通道的表达,促进心律失常的发生还有待研究。
2.1.2.3 MT:MT是由松果体在光暗周期中有节律地合成和释放的一种昼夜节律激素,已被证实具有抗心律失常作用。MT在恒定黑暗中持续升高,然后逐渐降低导致心律失常的发生。Li等[14]发现MT在去甲肾上腺素给药8~12 h后迅速反弹,提示去甲肾上腺素可恢复MT的节律,使之回到原有的高水平,防止因MT减少导致的心律失常。研究还发现,ADCY1蛋白水平也在去甲肾上腺素给药后6 h显著降低,18 h显著升高,提示ADCY1蛋白水平的表达可能是恒定黑暗期加强MT节律和去甲肾上腺素恢复MT节律的主要因素。
2.2 通过调节心肌通道蛋白的表达
2.2.1 离子通道
小鼠心室动作电位(action potential,AP)包含快速去极化期、瞬时复极化期和缓慢复极化期(小鼠心室AP无明显平台期)。快速去极化是由钠电流(INa)通过SCN5A编码的NaV1.5通道内流引起的。瞬时和缓慢的心室复极化是由几种不同的钾电流(Ito,f,Ito,s,IKslow1,IKslow2,ISS,IKs)和钙电流(ICa,L)引起的。见表1。
2.2.1.1 钠通道:研究表明Scn5a在小鼠心室中的表达呈昼夜节律变化,且在恒定黑暗中以24 h的周期振荡。在BMAL1敲除(BMAL1-/-)小鼠的心脏中,Scn5a转录水平的昼夜节律振荡丢失,且在分离的电压钳夹心室肌细胞显示,INa峰值比对照组小30%[20]。
2.2.1.2 钾通道:Kcnd2和Kcnh2 mRNA在恒定黑暗中以24 h的周期振荡,提示小鼠心室在转录水平上呈昼夜节律振荡[21],而BMAL1-/-小鼠的心脏中,Kcnd2转录水平的昼夜节律振荡丢失,且在分离的电压钳夹心室肌细胞显示,IKr峰值比对照组小50%[22]。Jeyaraj等[23]发现BMAL1直接调节Kruppel样因子15(Kruppel-like factor 15,KLF15)的昼夜节律表达,并使用转基因小鼠证明KLF15驱动Kcnip2的昼夜节律表达。此外,与对照组相比,BMAL1-/-心脏降低了Kcnip2的转录水平;从BMAL1-/-心脏分离的大多数心室肌细胞缺乏Ito,f,且BMAL1-/-心室AP比对照心肌细胞长[24]。与这些数据一致,BMAL1-/-心脏也发现Kcnip2和Kcna5等对小鼠心室复极重要的钾通道转录物水平降低[25]。Hayter等[26]发现αMHCCREBMAL1fl/fl鼠的Kcne1表达增加,而Kcne1过表达增加了心房颤动的易感性。综上所述,生物钟基因CLOCK/BMAL1的表达变化通过调控心肌细胞中钾通道基因的表达以影响心肌复极化,从而参与心律失常的发生及维持。
2.2.1.3 钙通道:Chen等[27]使用膜片钳技术检测到心肌细胞的L型钙通道活性于凌晨3点达到峰值,而过表达CLOCK/BMAL1显著地抑制了L型Ca2+通道的α亚基表达,降低了L型Ca2+通道的电流水平。刘岩等[28]进一步研究发现,过表达CLOCK-BMAL1显著降低Cacna1c水平,αMHCCREBMAL1fl/fl鼠的Cacna1c表达减弱,Cacna1c基因突变破坏了CaV1.2对电压及钙离子的调控作用,从而造成钙电流异常,影响心肌细胞AP,继而引发心律失常。钙螯合蛋白(calsequestrin,Casq)在心脏中调节肌质网Ca2+的释放和心率,Casq1缺乏引起恶性高热/环境热射病样室性心律失常[29],αMHCCREBMAL1fl/fl鼠的Casq1和Casq2表达显著增加[26],提示生物钟基因CLOCK/BMAL1的表达变化通过调控心肌细胞中钙通道基因的表达以影响心室肌复极化,引发心律失常。
2.2.2 超极化激活环核苷酸门控阳离子通道蛋白
超极化激活环核苷酸门控阳离子通道4(hyperpolarization-activated cyclic nucleotide-gated cation channel,HCN4)是窦房结中调控细胞起搏功能和调节节律的关键蛋白,D'Souza 等[9]发现在体内或离体的窦房结中,阻断HCN4可消除心率的昼夜变化。另外作者还发现,窦房结中BMAL1和CRY等生物钟转录因子存在节律性表达,而特异性敲除BMAL1能阻滞局部生物钟,消除HCN4表达和心率的昼夜节律变化,提示BMAL1的昼夜节律变化影响HCN4的转录水平,从而调控心率的昼夜节律。
2.2.3 缝隙连接蛋白
缝隙连接蛋白43(connexin,Cx)43和Cx40是细胞间连接通道的一种蛋白质,参与心肌电信号的传导。Egan Benova等[30]发现高血压大鼠暴露在连续光线下后,Cx43的表达水平显著降低,导致大鼠对恶性心室颤动的易感性增高。柴莹等[31]发现CLOCK突变小鼠的Cx40和Cx43表达的节律位相发生显著改变,在心房中显著前移而在心室中显著后移。在心室中,Cx40、Cx43的表达水平增高,提示Cx40和Cx43在心脏中的节律性表达可能受到生物钟系统的调节。此外,Prado等[32]发现MT通过上调Cx43,发挥预防心律失常的作用。
3 抗心律失常药影响昼夜节律的途径
3.1 伊伐布雷定
伊伐布雷定作为HCN4抑制剂,具有抗心律失常的作用,D'Souza等[9]通过向小鼠的腹腔注射伊伐布雷定,并观察其代表性心电图,发现伊伐布雷定小鼠的平均每日心率降低,且随着光刺激的减弱,心率降低得越明显。深入研究发现,伊伐布雷定通过阻断HCN4,抑制了BMAL1与HCN4内的E-box位点的特异性结合,影响了昼夜节律振荡的转录,进而达到降低心率的效果。
3.2 β1受体阻滞剂
室性心律失常发生于清晨及日间交感神经兴奋之时,已有研究[33]表明β受体阻滞剂减弱了室性心律失常的昼夜节律和清晨高峰。Zhou等[34]采用主动脉收缩法建立了豚鼠慢性心力衰竭(chronic heart failure,CHF)模型,通过染色质免疫沉淀和荧光素酶测定,进一步在转录水平上证实了,选择性β1肾上腺素能受体(β1-adrenergic receptor,β1-AR)阻滞剂基因的增强子通过与CLOCK-BMAL1异二聚体结合,上调β1-AR的表达,进而减弱了CHF小鼠中室性心律失常的昼夜节律变化。
3.3 莫雷西嗪
Han等[35]对时钟调节剂进行高通量化学筛选,发现莫瑞西嗪延长了昼夜节律周期,降低了昼夜节律振幅,且呈剂量依赖性。同时作者用实时定量聚合酶链反应分析检测莫利西嗪对时钟基因表达的影响,发现BMAL1、CRy2、PER3、Rev-erba和DBP等时钟基因与Scn5a、Kcnj2、Ncx1和KLF15等心脏离子通道基因的昼夜节律振荡均与莫雷西秦延长昼夜节律周期的作用一致,提示莫雷西嗪調节昼夜节律的时钟基因和心脏离子通道基因的表达。
3.4 胺碘酮
Ohori等[36]通过建立CHF大鼠模型,给予CHF组大鼠胺碘酮,并在12 h的光暗周期下检测两组大鼠的血压、自主活动和心率,发现两组大鼠在黑暗时期的舒张压变异性的低频部分(low-frequency components of diastolic blood pressure variability,LFdp)显著高于光照期,这是血压和心率昼夜节律的典型表现。并且CHF组的血压、自主活动和心率在黑暗时期增加,这与夜行动物的昼夜节律一致。提示胺碘酮能在觉醒期间抑制LFdp功率的瞬时增加,同时胺碘酮还会抑制交感神经波,影响自主神经的昼夜节律,对CHF大鼠起到保护作用。
4 小结与展望
综上所述,中枢生物钟通过ANS调控异丙肾上腺素、去甲肾上腺素、醛固酮、糖皮质激素、MT等神经-体液因子的释放,从而影响心脏电生理活动。心脏局部的外周生物钟基因改变心肌细胞膜上离子通道的表达,导致心室肌细胞AP异常。这两条途径是心律失常的发生呈现出昼夜节律性变化的重要基础。然而,目前有关心律失常的实验大多只在小鼠中进行,人的心脏结构比小鼠心脏要复杂,与其功能相关的基因、离子通道也更多,所以未来还需在人体试验进一步研究。
生物钟紊乱会对人体健康造成威胁,随着人们工作的需要,倒班和倒时差的人越来越多,轮班工作者心血管疾病的患病率和病死率更高[37],所以应当注意调整自己的生活节律以免出现健康问题。了解心律失常的昼夜节律机制及与之相关治疗药物的作用机理,有助于提高心律失常的预防、治疗和术后康复的效率。
参考文献
[1]李丽,王铭铭,孙环. 不同人群心律失常情况调查及影响因素[J]. 中国卫生工程学,2021,20(1):53-55.
[2]刘俊鹏,施海峰. 室性心律失常的基因治疗进展[J]. 实用心电学杂志,2021,30(5):357-359.
[3]Varró A,Tomek J,Nagy N,et al. Cardiac transmembrane ion channels and action potentials:cellular physiology and arrhythmogenic behavior[J]. Physiol Rev,2021,101(3):1083-1176.
[4]Austin KM,Trembley MA,Chandler SF,et al. Molecular mechanisms of arrhythmogenic cardiomyopathy[J]. Nat Rev Cardiol,2019,16(9):519-537.
[5]蘇锦锋,杨凡,邓莉. 昼夜节律与心律失常的研究进展[J]. 中国医学科学院学报,2022,44(5):919-922.
[6]Ruan W,Yuan X,Eltzschig HK. Circadian rhythm as a therapeutic target[J]. Nat Rev Drug Discov,2021,20(4):287-307.
[7]Black N,D'souza A,Wang Y,et al. Circadian rhythm of cardiac electrophysiology,arrhythmogenesis,and the underlying mechanisms[J]. Heart Rhythm,2019,16(2):298-307.
[8]Takahashi JS. Transcriptional architecture of the mammalian circadian clock[J]. Nat Rev Genet,2017,18(3):164-179.
[9]D'souza A,Wang Y,Anderson C,et al. A circadian clock in the sinus node mediates day-night rhythms in Hcn4 and heart rate[J]. Heart Rhythm,2021,18(5):801-810.
[10]Bernardi J,Aromolaran KA,Zhu H,et al. Circadian mechanisms:cardiac ion channel remodeling and arrhythmias[J]. Front Physiol,2021,11:611860.
[11]Barazi N,Polidovitch N,Debi R,et al. Dissecting the roles of the autonomic nervous system and physical activity on circadian heart rate fluctuations in mice[J]. Front Physiol,2021,12:692247.
[12]Beesley S,Noguchi T,Welsh DK. Cardiomyocyte circadian oscillations are cell-autonomous,amplified by β-adrenergic signaling,and synchronized in cardiac ventricle tissue[J]. PLoS One,2016,11(7):e0159618.
[13]Palm D,Uzoni A,Simon F,et al. Norepinephrine influences the circadian clock in human dermal fibroblasts from study participants with a diagnosis of attention-deficit hyperactivity disorder[J]. J Neural Transm (Vienna),2021,128(7):1147-1157.
[14]Li Y,Cassone VM. Clock-controlled regulation of the acute effects of norepinephrine on chick pineal melatonin rhythms[J]. J Biol Rhythms,2015,30(6):519-532.
[15]Fletcher EK,Kanki M,Morgan J,et al. Cardiomyocyte transcription is controlled by combined MR and circadian clock signalling[J]. J Endocrinol,2019:JOE-18-0584.R3.
[16]Bering T,Hertz H,Rath MF. Rhythmic release of corticosterone induces circadian clock gene expression in the cerebellum[J]. Neuroendocrinology,2020,110(7-8):604-615.
[17]Caratti G,Iqbal M,Hunter L,et al. REVERBa couples the circadian clock to hepatic glucocorticoid action[J]. J Clin Invest,2018,128(10):4454-4471.
[18]Costello HM,Crislip GR,Cheng KY,et al. Adrenal-specific KO of the circadian clock protein BMAL1 alters blood pressure rhythm and timing of eating behavior[J]. Function (Oxf),2023,4(2):zqad001.
[19]Ivy JR,Jones NK,Costello HM,et al. Glucocorticoid receptor activation stimulates the sodium-chloride cotransporter and influences the diurnal rhythm of its phosphorylation[J]. Am J Physiol Renal Physiol,2019,317(6):F1536-F1548.
[20]Schroder EA,Wayland JL,Samuels KM,et al. Cardiomyocyte deletion of Bmal1 exacerbates QT- and RR-interval prolongation in Scn5a (+/ΔKPQ) mice[J]. Front Physiol,2021,12:681011.
[21]Schroder EA,Burgess DE,Zhang X,et al. The cardiomyocyte molecular clock regulates the circadian expression of Kcnh2 and contributes to ventricular repolarization[J]. Heart Rhythm,2015,12(6):1306-1314.
[22]Schroder EA,Lefta M,Zhang X,et al. The cardiomyocyte molecular clock,regulation of Scn5a,and arrhythmia susceptibility[J]. Am J Physiol Cell Physiol,2013,304(10):C954-C965.
[23]Jeyaraj D,Haldar SM,Wan X,et al. Circadian rhythms govern cardiac repolarization and arrhythmogenesis[J]. Nature,2012,483(7387):96-99.
[24]Xie Z,Su W,Liu S,et al. Smooth-muscle BMAL1 participates in blood pressure circadian rhythm regulation[J]. J Clin Invest,2015,125(1):324-336.
[25]Olesen MS,Bentzen BH,Nielsen JB,et al. Mutations in the potassium channel subunit KCNE1 are associated with early-onset familial atrial fibrillation[J]. BMC Med Genet,2012,13:24.
[26]Hayter EA,Wehrens SMT,van Dongen HPA,et al. Distinct circadian mechanisms govern cardiac rhythms and susceptibility to arrhythmia[J]. Nat Commun,2021,12(1):2472.
[27]Chen Y,Zhu D,Yuan J,et al. CLOCK-BMAL1 regulate the cardiac L-type calcium channel subunit CACNA1C through PI3K-Akt signaling pathway[J]. Can J Physiol Pharmacol,2016,94(9):1023-1032.
[28]劉岩,封瑞,郝丽英. CACNA1C基因突变致L-型钙通道异常与心律失常研究的进展[J]. 生理科学进展,2021,52(4):311-316.
[29]Sun Z,Wang L,Han L,et al. Functional calsequestrin-1 is expressed in the heart and its deficiency is causally related to malignant hyperthermia-like arrhythmia[J]. Circulation,2021,144(10):788-804.
[30]Egan Benova T,Viczenczova C,Szeiffova Bacova B,et al. Omacor protects normotensive and hypertensive rats exposed to continuous light from increased risk to malignant cardiac arrhythmias[J]. Mar Drugs,2021,19(12):659.
[31]柴莹,周影,陈晓敏,等. 小鼠心脏缝隙连接蛋白节律性表达与生物钟系统相关性[J]. 温州医科大学学报,2018,48(1):42-45.
[32]Prado NJ,Egan Beňová T,Diez ER,et al. Melatonin receptor activation protects against low potassium-induced ventricular fibrillation by preserving action potentials and connexin-43 topology in isolated rat hearts[J]. J Pineal Res,2019,67(4):e12605.
[33]Vicent L,Martínez-Sellés M. Circadian rhythms,cardiac arrhythmias and sudden death[J]. Front Biosci (Landmark Ed),2021,26(11):1305-1311.
[34]Zhou Z,Yuan J,Zhu D,et al. CLOCK-BMAL1 regulates circadian oscillation of ventricular arrhythmias in failing hearts through β1 adrenergic receptor[J]. Am J Transl Res,2020,12(10):6122-6135.
[35]Han C,Wirianto M,Kim E,et al. Clock-modulating activities of the anti-arrhythmic drug moricizine[J]. Clocks Sleep,2021,3(3):351-365.
[36]Ohori T,Hirai T,Joho S,et al. Circadian changes in autonomic function in conscious rats with heart failure:effects of amiodarone on sympathetic surge[J]. Auton Neurosci,2011,159(1-2):20-25.
[37]Khosravipour M,Khanlari P,Khazaie S,et al. A systematic review and meta-analysis of the association between shift work and metabolic syndrome:the roles of sleep,gender,and type of shift work[J]. Sleep Med Rev,2021,57:101427.
收稿日期:2023-05-27