客观营养状态评估工具在心房颤动中的研究进展
安烁 杨东辉
【摘要】心房颤动(AF)是目前最常见的心律失常之一,发生机制复杂。近期研究发现,营养不良与AF发生发展、预后及消融术后复发相关。简单、快速的营养状态评估工具对发现营养不良非常重要。现对控制营养状态(CONUT)、预后营养指数(PNI)、老年营养风险指数(GNRI)三种客观营养状态评估工具在AF发生发展、预后及消融术后复发的研究进展进行综述,讨论客观营养状态评估工具参与AF可能的机制,从而为AF消融术后复发的预防提供潜在的方法。
【关键词】心房颤动;营养不良;导管消融;复发
【DOI】10.16806/j.cnki.issn.1004-3934.2023.12.000
objective nutritional status assessment tools in atrial fibrillation
AN Shuo,YANG Donghui
(Department of Cardiology,The Second Hospital of Dalian Medical University,Dalian 116027,Liaoning,China)
【Abstract】Atrial fibrillation (AF) is one of the most common arrhythmias at present,and its mechanism is complex. Recent studies have found that malnutrition is associated with the occurrence,development,prognosis and recurrence of AF after ablation. Simple,rapid nutritional status assessment tools are important to detect malnutrition. This paper reviews the research progress of three objective nutritional status assessment tools,namely Control Nutritional Status (CONUT),Prognostic Nutritional Index (PNI) and Geriatric Nutritional Risk Index (GNRI),on the occurrence,development,prognosis and recurrence of AF after ablation,and discusses the possible mechanism of the involvement of objective nutritional status assessment tools in AF to provide potential methods for the prevention of AF recurrence after ablation.
【Key words】Atrial fibrillation;Malnutrition;Catheter ablation;Recurrence
心房顫动(Atrial fibrillation,AF)是最常见的心律失常之一,发病率正逐年升高,AF可以增加血栓栓塞、心力衰竭、慢性肾脏病、痴呆症等疾病发生的风险,同时与患者全因死亡率的升高相关[1]。随着人口的老龄化,住院患者营养不良成为日益严重的健康问题,约20%~50%的患者在入院前出现营养不良[2]。因此对于营养不良患者的识别非常重要,在心血管领域,营养不良可以预测冠心病经皮冠状动脉介入治疗术后、心力衰竭、肥厚型心肌病和AF等患者的不良预后[3-6]。评估营养状态的常用指标包括血清白蛋白、胆固醇、淋巴细胞计数和体重指数(body mass index,BMI)等,这些指标相结合产生了一些营养状态评估工具。现对控制营养状态(controlling nutritional status,CONUT)、预后营养指数(prognostic nutritional index,PNI)、老年营养风险指数(Geriatric Nutritional Risk Index,GNRI)三种简单且易于获得的客观营养状态评估工具在AF的发生发展、预后及消融术后复发的研究进展进行综述。
1 客观营养状态评估工具
1.1 CONUT
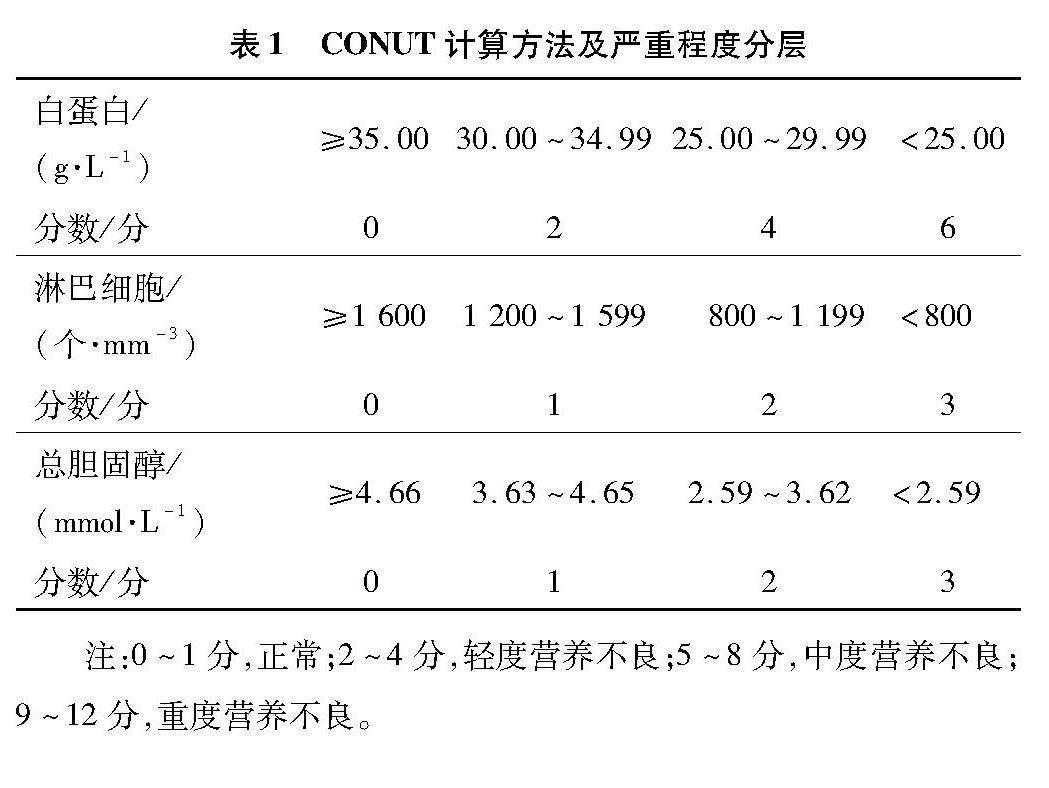
Ignacio de Ulíbarri等[7]于2005年提出CONUT(表1)作为筛查住院患者营养状态的工具,其包括血清白蛋白、总胆固醇和淋巴细胞计数。该评分总分共计12分,评分越高,营养状态越差。
1.2 PNI
Buzby等[8]提出PNI,用于评估胃肠手术患者的营养状态及手术风险。PNI由血清白蛋白浓度和淋巴细胞计数计算而来,计算方法为:血清白蛋白(g/L)+5×血液淋巴细胞计数(109/L),是一个有用且易于获得的个体免疫营养状况指标。有研究[9]将PNI<38分定义为营养不良,可识别中度(35~38分)及重度(<35分)营养不良。目前还有很多研究者通过ROC曲线分析获取PNI的临界值,从而提高研究的特异度及敏感度[10]。
1.3 GNRI
Bouillanne等[11]提出GNRI用于老年外科住院手术患者的营养风险筛查,GNRI由白蛋白及BMI计算而来,GNRI=1.489×血清白蛋白(g/L)+41.7×[当前体重(kg)/理想体重(kg)],其中理想体重BMI为22 kg/m2,该评分越低,营养状态越差。GNRI分为正常(>98分)、低危(92~98分)、中危(82~<92分)和高危(<82分)4个危险分级。
心血管疾病患者中营养不良普遍存在,多项研究表明客观营养状态评估工具与心力衰竭[4]、冠心病[12]、AF[6]、肥厚型心肌病[5]等多种心血管疾病患者的预后相关。现主要讨论客观营养状态评估工具与AF之间的相关性。
2 客观营养状态评估工具在AF中的价值
2.1 客观营养状态评估工具与AF的发生
一项纳入477例接受24小时动态心电图检查患者的研究[13]表明,高CONUT及低PNI患者阵发性心房颤动(Paroxysmal atrial fibrillation,PAF)的发生率显著升高,多因素分析显示CONUT(OR=0.911,95% CI 0.853~0.973,P=0.005)及PNI(OR=1.21,95% CI 1.016~1.440,P=0.032)是PAF存在的独立预测因子。Wu等[14]的研究纳入662例经皮冠状动脉介入治疗术后的急性心肌梗死患者,有84例(12.7%)于住院期间新发心房颤动(New-onset atrial fibrillation,NOAF),相比于非NOAF组,NOAF组的CONUT(P<0.001)更高,GNRI(P<0.001)更低,通过CONUT及GNRI评估营养不良分度,发现NOAF组中度和重度营养不良的患病率更高,生存分析图显示营养状况最差的患者最容易发生NOAF。在肥厚型心肌病患者中,低PNI组AF发生率同样更高[5]。
因此,客观营养状况评估工具作为评估营养状态的指标,筛选出的营养不良患者有更高的AF风险,且营养不良程度较重的患者AF的发生率更高。针对AF发生风险较高人群,应定期评估营养状态,进一步发现AF易感患者,适当干预,可预防AF发生。
2.2 客观营养状态评估工具评估AF患者的不良事件及预后
Raposeiras-Roubín等[15]对4 724例年龄>80岁的AF患者进行平均(3.0±1.8)年的随访,其中801例患者死亡(16.9%),162例发生缺血性卒中(3.4%),141例发生大出血(3.0%),营养不良的患者发生死亡、缺血性卒中和出血事件的风险高于营养状况正常的患者(P均<0.05),且随着CONUT的增加,即营养风险的升高,抗凝和非抗凝患者发生卒中和大出血的风险均增加(P均<0.05)。Shinohara等[16]纳入332例年龄>80岁的AF患者研究中CONUT>5组的大出血的发生率显著高于CONUT<5组(P<0.01),该研究同样证实CONUT筛选出的营养不良患者大出血的发生率显著增高(HR=5.80,95% CI 1.44~23.33,P=0.013)。Wang等[17]的研究纳入406例非瓣膜性AF患者,其中有53例患者有左心耳血栓(left atrial appendage thrombus,LAAT)/自发回声对比(spontaneous echo contrast,SEC),LAAT/密集SEC的存在代表患者有较高的卒中风险,多变量分析表明PNI是LAAT/密集SEC的独立预测因子,其中PNI≤48.0的患者发生LAAT/密集SEC的风险比PNI>48.0的患者高2.57倍,提示营养不良患者中状态较差的患者有更高的卒中风险。
Arenas Miquélez等[6]对449例非瓣膜性AF患者随访1年,有177例(39.4%)患者死亡,存活患者中CONUT的得分较低(P<0.001),提示营养不良与较高的死亡率相关。Díez-Manglano等[18]对282例AF患者进行为期10年的随访,根据CONUT评估患者的营养状态,零风险、低危、中危和高危患者的中位生存期分别为33个月、21个月、10个月和60 d,CONUT与3个月(HR=1.144)、12个月(HR=1.102)和10年(HR=1.051)的死亡率独立相关。
綜上,客观营养状态评估工具是AF患者不良事件及预后的预测因子,且营养不良程度越高,患者发生卒中、出血等不良事件及死亡的风险越高。对AF的患者,应早期识别营养不良患者,并积极改善营养状态,可能降低患者不良事件的发生率并改善预后,但仍需临床试验进一步证实。
3 客观营养状态评估工具预测AF导管消融术后复发的价值
Zhu等[19]对246例AF消融术后的患者中位11个月的随访中,有77例患者(31.3%)患者出现AF复发,复发组的CONUT较高(2.3±1.5 vs 0.9±1.0,P<0.001),GNRI较低(99.9±7.6 vs 103.9±5.6,P<0.001),且复发组发生轻度、中度、重度营养不良的比例均高于非复发组,CONUT和GNRI可独立预测AF消融术后复发;在AF复发的基础预测模型中加入CONUT或GNRI,均可以提高模型预测消融后AF复发的效能,而加入CONUT较GNRI对模型性能的改善更大,其原因可能是GNRI中包含BMI,从而低估了超重患者的营养不良率。在Furui等[9]的研究中,通过CONUT及GNRI评估的营养不良患者的AF消融术后复发率同样高于营养正常患者,但由CONUT筛查的营养不良不能在服用降脂药物的患者中识别出有AF复发风险的患者,其原因可能是使用降脂药降低血脂的作用影响CONUT对营养状态的评估;该研究中将PNI<38定义为营养不良时,PNI只能在0.3%的研究人群中识别出营养不良,可能因其只能用于评估中度至重度营养不良,而接受导管消融的AF患者营养状态通常较好,因此PNI可能不适用于接受AF消融术患者的营养状态评估。Kaneko等[20]的研究中,通过GNRI评估538例首次接受AF导管消融患者的营养状态,有营养风险组患者的AF复发率较无营养风险组显著较高(31.6% vs 15.2%,P=0.001),在Cox比例风险分析中,GNRI是整个研究队列(HR=3.91,P<0.001)和倾向匹配队列(HR=6.49,P=0.016)中心律失常的复发的独立预测因子。但Kim等[21]的研究中,通过CONUT评估的营养不良并不影响AF消融术后的复发结果,营养正常组与营养不良组的临床复发率为(37.0% vs 36.6%,P=0.829),纳入患者中重度营养不良患者的比例太小(0.4%)可能是导致此研究结果与上述其他研究不同的原因。
综上所述,CONUT、PNI、GNRI三种客观营养状态评估工具所包含的都是简单、容易获得的指标,在导管消融术前对AF患者进行评估,获得营养不良危险分层,对AF消融术后复发可能有指导意义。但PNI只能识别中、重度的营养不良,接受导管消融治疗的AF患者往往营养状态较好。GNRI中包含BMI,其可能低估了超重患者的营养不良率。对于早期识别营养不良患者,CONUT可以筛选出更多的营养不良患者,在未使用降脂药的患者中,CONUT是更好的营养状态评估工具,改善营养状况可能是降低AF导管消融术后复发率的一种潜在方法,但仍需临床试验进一步证实。
4 客观营养状态评估工具在AF发生发展及导管消融术后复发可能的作用机制
现综述的三种客观营养状态评估工具由淋巴细胞计数、血清白蛋白、胆固醇及BMI构成。以上指标主要反映人体蛋白质储存、免疫系统的功能、炎症、热量消耗及体重。此部分讨论客观营养状态评估工具中包含的指标在AF消融术后复发可能的作用机制。
4.1 淋巴细胞计数
炎症被认为是AF最初发展的触发因素,也是导致AF持续的因素[22],可引起AF消融术后复发[23]。炎症细胞浸润心肌,释放活性氧、细胞因子、髓过氧化物酶和水解酶,引起不规则间质破裂,导致心房和心室组织的电和结构重构,从而导致AF发生发展。在AF患者的心房组织中可观察到炎症细胞的活跃黏附和聚集,相关细胞包括中性粒细胞、淋巴细胞、单核细胞、巨噬细胞和粒细胞[24]。淋巴细胞是应激反应的一个指标,反映机体的免疫功能,其在先天免疫和适应性免疫中发挥重要作用。一项包含14 500例参与者的基于社区的队列研究[25]表明淋巴细胞计数与较高的AF风险呈负相关,较低的淋巴细胞计数意味着较高的炎症程度和较差的营养状态,从而引起AF的发生、发展及导管消融术后的复发。一项孟德尔随机化研究[26]表明淋巴细胞计数对AF的保护作用可能是由自然杀伤细胞的保护作用和CD4+T细胞的促进作用中和而成的。
4.2 白蛋白
白蛋白是常用的评估临床状况稳定患者营养状态的指标。一项队列研究[27]显示,血清白蛋白水平与AF发生率呈负相关。Wang等[28]荟萃分析(纳入9项研究,32 130例患者)发现,高白蛋白水平降低患者的AF风险,在剂量-反应分析中,血清白蛋白水平每升高10 g/L,AF的风险就降低36%。低白蛋白血症发生的原因主要为肝脏合成减少、分解代谢增加、血管通透性增加、蛋白丢失增加。在心血管疾病患者中低蛋白血症确切的发病机制还不清楚,但营养不良和炎症被认为是低白蛋白血症发生的主要原因。急性和慢性炎症通過改变肝蛋白代谢和诱导毛细血管渗漏来影响血清白蛋白,单核细胞产物在炎症过程中减少血清白蛋白的产生[29]。全身炎症不仅减少白蛋白的合成,也使其降解增加。炎症状态,特别是高浓度的细胞因子白细胞介素-6和肿瘤坏死因子-α,是导致血清白蛋白水平低的两个主要因素[30],血清白蛋白减少其抗炎作用的削弱可能诱导AF的发生、发展。白蛋白水平也是消融术后AF复发的重要分子标志物[31]。血清白蛋白水平在AF中的潜在作用可能主要是其抗氧化、抗炎、抗血小板聚集和电生理活性[32],AF导管消融术后复发增加可能由上述功能受损所致。有研究[29]表明PAF患者的白蛋白水平与血脂水平呈正相关,血脂水平同为AF的保护性因素,二者的降低可能带来更高的AF风险。
4.3 胆固醇
较高的胆固醇水平与心血管事件发生率的增加相关,但在AF中存在“胆固醇悖论”,血清胆固醇水平与AF发生率呈负相关[33]。这种负相关可能与胆固醇对心肌细胞膜的稳定作用相关。胆固醇是细胞膜的主要组成部分,胆固醇水平的变化可以通过影响细胞膜通透性和膜蛋白而引起细胞膜性质的变化,改变细胞膜的电梯度和静息电位,并促进AF的发生、发展。较低的胆固醇水平也会增加细胞膜的流动性,影响细胞膜的功能,导致电位的变化[34]。胆固醇水平和AF的联系也可能与炎症有关。研究[35]表明,炎症过程中总胆固醇、低密度脂蛋白和高密度脂蛋白水平降低,而甘油三酯水平升高,胆固醇水平的降低可能反映宿主体内促发AF的潜在炎症过程,所以低血浆胆固醇可能带来更高的AF消融术后复发风险。有研究[36]表明,胆固醇水平与导管消融后AF的复发呈负相关,这种相关性在女性中更显著,其原因可能是男性和女性的血脂谱存在性别差异,心房的电生理特性也有所不同。
4.4 BMI
BMI是常用的评估肥胖程度及营养状况的指标。有研究[37]发现,与正常体重的患者相比,BMI较高的患者有更好的预后,因此肥胖在AF中可能为保护性因素,这一现象被描述为“肥胖悖论”,但是该观点目前仍存在争议。也有研究表明肥胖与高BMI在AF中为危险因素,Feng等[38]发现长期肥胖和BMI变化与AF风险增加相关。Deng等[39]研究观察到BMI的临界值与AF消融术后复发的风险呈正相关。BMI≥26.36 kg/m2与的AF复发率升高相关,AF复发风险增加50%;使用Cox比例风险模型进行多变量分析,证明体重过轻和肥胖均显著增加AF复发的风险,BMI对消融结果的影响为一个“U”形曲线。BMI作为GNRI的组成部分在体重较轻时可以在评价营养不良中发挥作用。其中的机制可能是心肌细胞在压力、容量负荷和缺血等应激损伤条件下,特别是在心力衰竭患者中,促炎细胞因子分泌增加。这些细胞因子的升高可能与额外的心肌损伤、肌细胞萎缩、脂肪减少和引起恶病质有关[40]。BMI的降低往往伴随着肌肉与脂肪的减少。肌生成抑制素在骨骼肌中合成与表达,骨骼肌的减少削弱其抗炎作用[41],可能增加AF的风险。脂联素是一种由脂肪组织和大脑产生的胰岛素增敏激素和抗炎激素,在BMI较低的患者中,由于脂肪组织的减少,脂联素等脂肪因子的抗炎保护作用也被削弱,可能增加炎症发生的风险[42]。
AF的發生机制非常复杂,淋巴细胞计数、血清白蛋白、胆固醇及BMI等指标与AF的发生均存在直接或间接联系,需要对其深层机制进行探索,并有针对性进行干预,与其他方法相结合,可以提高AF预防和治疗的有效率。
5 总结与展望
营养不良对AF患者的预后及术后复发的预测已被证实,而能快速、准确、容易获得的营养不良标准可以对临床治疗起到关键的作用。CONUT、PNI、GNRI三种客观营养状态评估工具都是简单、容易获得的指标,可以预测AF的发生发展、预后、不良事件及AF消融术后的复发,但目前的相关研究多为回顾性研究,还需要更多前瞻性的大样本、多中心研究来证实。AF导管消融术后营养状况的改善是否能降低AF的复发率也有待进一步研究。
参 考 文 献
[1] Tsao CW,Aday AW,Almarzooq ZI,et al. Heart disease and stroke Statistics-2023 Update:a report from the American Heart Association[J]. Circulation,2023,147(8):e93-e621.
[2] Bellanti F,Lo Buglio A,Quiete S,et al. Malnutrition in hospitalized old patients:screening and diagnosis,clinical outcomes,and management[J]. Nutrients,2022,14(4):910.
[3] Mai Z,Huang Z,Lai W,et al. Association of malnutrition,left ventricular ejection fraction category,and mortality in patients undergoing coronary angiography:a cohort with 45,826 patients[J]. Front Nutr,2021,8:740746.
[4] Sze S,Pellicori P,Kazmi S,et al. Prevalence and prognostic significance of malnutrition using 3 scoring systems among outpatients with heart failure:a comparison with body mass index[J]. JACC Heart Fail,2018,6(6):476-486.
[5] Wang Z,Zhao L,He S. Prognostic nutritional index and the risk of mortality in patients with hypertrophic cardiomyopathy[J]. Int J Cardiol,2021,331:152-157.
[6] Arenas Miquélez A,Requena Calleja MA,Gullón A,et al. Nutritional risk and mortality at one year for elderly patients hospitalized with nonvalvular atrial fibrillation. Nonavasc registry[J]. J Nutr Health Aging,2020,24(9):981-986.
[7] Ignacio de Ulíbarri J,González-Madro?o A,de Villar NG,et al. CONUT:a tool for controlling nutritional status. First validation in a hospital population[J]. Nutr Hosp,2005,20(1):38-45.
[8] Buzby GP,Mullen JL,Matthews DC,et al. Prognostic nutritional index in gastrointestinal surgery[J]. Am J Surg,1980,139(1):160-167.
[9] Furui K,Morishima I,Morita Y,et al. Impact of preoperative nutritional status on the outcome of catheter ablation for atrial fibrillation[J]. Circ J,2022,86(2):268-276.
[10] Wang D,Hu X,Xiao L,et al. Prognostic nutritional index and systemic immune-inflammation index predict the prognosis of patients with HCC[J]. J Gastrointest Surg,2021,25(2): 421-427.
[11] Bouillanne O,Morineau G,Dupont C,et al. Geriatric Nutritional Risk Index:a new index for evaluating at-risk elderly medical patients[J]. Am J Clin Nutr,2005,82(4):777-783.
[12] Chen L,Huang Z,Lu J,et al. Impact of the malnutrition on mortality in elderly patients undergoing percutaneous coronary intervention[J]. Clin Interv Aging,2021,16:1347-1356.
[13] Kurmus Ferik O,Akbuga K,Tolunay H,et al. Poor nutritional status is associated with arrhythmic events on 24-hour holter recording[J]. Med Princ Pract,2022,31(4):368-375.
[14] Wu L,Wang W,Gui Y,et al. Nutritional status as a risk factor for new-onset atrial fibrillation in acute myocardial infarction[J]. Clin Interv Aging,2023,18:29-40.
[15] Raposeiras-Roubín S,Abu-Assi E,Paz RC,et al. Impact of malnutrition in the embolic-haemorrhagic trade-off of elderly patients with atrial fibrillation[J]. Europace,2020,22(6):878-887.
[16] Shinohara M,Wada R,Yano K,et al. Relationship between the nutritional status and safety and efficacy outcomes in atrial fibrillation patients aged 80 years and over receiving oral anticoagulants[J]. J Cardiol,2021,77(2):147-153.
[17]Wang Z,Wang B,Fu G,et al. The prognostic nutritional index may predict left atrial appendage thrombus or dense spontaneous echo contrast in patients with atrial fibrillation[J]. Front Cardiovasc Med,2022,9: 860624.
[18] Díez-Manglano J,Clemente-Sarasa C. The nutritional risk and short-,medium- and long-term mortality of hospitalized patients with atrial fibrillation[J].Aging Clin Exp Res,2019,31(12):1775-1781.
[19] Zhu S,Zhao H,Zheng M,et al. The impact of malnutrition on atrial fibrillation recurrence post ablation[J]. Nutr Metab Cardiovasc Dis,2021,31(3):834-840.
[20] Kaneko M,Nagata Y,Nakamura T,et al. Geriatric nutritional risk index as a predictor of arrhythmia recurrence after catheter ablation of atrial fibrillation[J].Nutr Metab Cardiovasc Dis,2021,31(6):1798-1808.
[21] Kim D,Shim J,Kim YG,et al. Malnutrition and Risk of Procedural Complications in Patients With Atrial Fibrillation Undergoing Catheter Ablation[J]. Front Cardiovasc Med,2021,8:736042.
[22] Carlisle MA,Fudim M,Devore AD,et al. Heart failure and atrial fibrillation,like fire and fury[J]. JACC Heart Fail,2019,7(6):447-456.
[23] Miyazaki S,Kuroi A,Hachiya H,et al. Early recurrence after pulmonary vein isolation of paroxysmal atrial fibrillation with different ablation technologies - prospective comparison of radiofrequency vs. Second-generation cryoballoon ablation[J]. Circ J,2016,80(2):346-353.
[24] Yang X,Zhao S,Wang S,et al. Systemic inflammation indicators and risk of incident arrhythmias in 478,524 individuals:evidence from the UK Biobank cohort[J]. BMC Med,2023,21(1):76.
[25] Misialek JR,Bekwelem W,Chen LY,et al. Association of white blood cell count and differential with the incidence of atrial fibrillation:the Atherosclerosis Risk in Communities (ARIC) study[J].PLoS One,2015,10(8):e0136219.
[26] Feng Y,Liu X,Tan H. Causal association of peripheral immune cell counts and atrial fibrillation:a Mendelian randomization study[J]. Front Cardiovasc Med,2023,9:1042938.
[27] Liao LZ,Zhang SZ,Li WD,et al. Serum albumin and atrial fibrillation:insights from epidemiological and mendelian randomization studies[J]. Eur J Epidemiol,2020,35(2):113-122.
[28] Wang Y,Du P,Xiao Q,et al. Relationship between serum albumin and risk of atrial fibrillation:a dose-response meta-analysis[J]. Front Nutr,2021,8:728353.
[29] Zhong X,Jiao H,Zhao D,et al. Association between serum albumin levels and paroxysmal atrial fibrillation by gender in a Chinese population:a case-control study[J].BMC Cardiovasc Disord,2022,22(1):387.
[30] Keller U. Nutritional laboratory markers in malnutrition[J]. J Clin Med,2019,8(6):775.
[31] Schamroth Pravda N,Golovchiner G,Goldenberg G,et al. Albumin as a prognostic marker for atrial fibrillation recurrence following cryoballoon ablation of pulmonary venous[J].J Clin Med,2022,12(1):264.
[32] Arques S. Human serum albumin in cardiovascular diseases[J].Eur J Intern Med,2018,52:8-12.
[33] Jiang Q,Qin D,Yang L,et al. Causal effects of plasma lipids on the risk of atrial fibrillation:a multivariable mendelian randomization study[J].Nutr Metab Cardiovasc Dis,2021,31(5):1569-1578.
[34] Lee HJ,Lee SR,Choi EK,et al. Low lipid levels and high variability are associated with the risk of new-onset atrial fibrillation[J]. J Am Heart Assoc,2019,8(23):e012771.
[35] Ding WY,Protty MB,Davies IG,et al. Relationship between lipoproteins,thrombosis,and atrial fibrillation[J]. Cardiovasc Res,2022,118(3):716-731.
[36] Li ZZ,Liu T,Huang Q,et al. Association between pre-radiofrequency catheter ablation serum lipid levels and recurrence of atrial fibrillation in 412 patients in Beijing,China:a single-center Study[J]. Med Sci Monit,2023,29:e938288.
[37] Liu X,Guo L,Xiao K,et al. The obesity paradox for outcomes in atrial fibrillation:evidence from an exposure-effect analysis of prospective studies[J]. Obes Rev,2020,21(3):e12970.
[38] Feng T,Vegard M,Strand LB,et al. Weight and weight change and risk of atrial fibrillation:the HUNT study[J]. Eur Heart J,2019,40(34):2859-2866.
[39] Deng H,Shantsila A,Guo P,et al. A U-shaped relationship of body mass index on atrial fibrillation recurrence post ablation:a report from the Guangzhou atrial fibrillation ablation registry[J].EBioMedicine,2018,35:40-45.
[40] Yanagisawa S,Inden Y,Yoshida N,et al. Body mass index is associated with prognosis in Japanese elderly patients with atrial fibrillation:an observational study from the outpatient clinic[J].Heart Vessels,2016,31(9):1553-1561.
[41] Berezin AE,Berezin AA,Lichtenauer M. Myokines and heart failure:challenging role in adverse cardiac remodeling,myopathy,and clinical outcomes[J].Dis Markers,2021,2021:6644631.
[42] Szymczak-Pajor I,Miazek K,Selmi A,et al. The action of vitamin D in adipose tissue:is there the link between vitamin D deficiency and adipose tissue-related metabolic disorders?[J].Int J Mol Sci,2022,23(2):956.
收稿日期:2023-07-12