转录组分析sgf73基因缺失对粟酒裂殖酵母生长代谢影响的分子机制
刘欣岚 叶姿妤 鲁艳 侯怡铃 周丽倩 蒲帝宏 丁祥
摘要: 为研究粟酒裂殖酵母sgf73基因缺失后的关键基因和关键代谢通路,采用RNA-Seq测序技术对野生型酵母菌株及sgf73基因缺陷型菌株进行测序及生物信息学分析,并进行GO和KEGG功能富集分析. 结果表明: sgf73基因缺陷型菌株中高表达基因有1 834个,极高表达基因有6个,且有1 714个差异表达基因,包括934个上调基因,780个下调基因; sgf73基因敲除导致细胞代谢和跨膜转运过程异常变化; MAPK信号通路中参与周期调控cki1,cki2和cdc25基因的下调导致sgf73Δ菌株有丝分裂时间延长; 调控细胞骨架rgf2,rho1和stt4基因的下调导致sgf73Δ菌株肌动蛋白环收缩异常.
关键词: 粟酒裂殖酵母; RNA-Seq测序; sgf73基因; 差异表达基因; MAPK信号通路
中图分类号: Q343 文献标志码: A 文章编号: 1671-5489(2023)02-0426-11
Molecular Mechanism of Eeffect of sgf73 Gene Deletion on Growth and Metabolism of Schizosaccharomyces pombe by Transcriptome Analysis
LIU Xinlan1,YE Ziyu2, LU Yan2,HOU Yiling2,ZHOU Liqian2,PU Dihong2,DING Xiang1
(1. College of Environmental Science and Engineering, China West Normal University, Nanchong 637009,Sichuan Province,China; 2. Key Laboratory of Southwest China Wildlife Resources Conservation of the Ministry of Education,College of Life Science, China West Normal University, Nanchong 637009,Sichuan Province,China)
收稿日期: 2022-06-11.
第一作者簡介: 刘欣岚(1998—),女,汉族, 硕士研究生,从事环境微生物学的研究, E-mail: 3263407070@qq.com.
通信作者简介: 丁 祥(1980—),男,汉族, 博士,教授,从事环境微生物学的研究,E-mail: biostart8083@126.com.
基金项目: 四川省科技厅应用基础重点项目(批准号: 2018JY0087)、 四川省科技厅重点研发项目(批准号: 2018NZ0055)和南充市科技局发展计划项目(批准号: 20YFZJ0053; 20YFZJ0054).
Abstract: In order to study the key genes and key metabolic pathways after the sgf73 gene was knocked out in Schizosaccharomyces pombe, the wild-type yeast strains and sgf73Δ gene-deficient strains were sequenced and bioinformatics analyzed by RNA-Seq sequencing technology,and the GO and KEGG functional enrichment analysis were carried out. The results show that in the sgf73Δ gene-deficient strains, there are 1 834 highly expressed genes, including 6 extremely highly expressed genes, and 1 714 differentially expressed genes, of which 934 genes are up-regulated and 780 genes are down-regulated. The sgf73 gene knockout leads to abnormal changes in cellular metabolism and transmembrane transport. The down-regulation of cki1,cki2 and cdc25 genes involved in cycle regulation in the MAPK signaling pathway leads to prolongation of mitotic time in sgf73Δ strain, the down-regulation of regulatory cytoskeleton rgf2,rho1 and stt4 genes leads to abnormal contraction of actin ring of sgf73Δ strain.
Keywords: Schizosaccharomyces pombe; RNA-Seq sequencing; sgf73 gene; differentially expressed genes (DEGs); MAPK signaling pathway
粟酒裂殖酵母菌(Schizosaccharomyces pombe)具有典型的真核细胞周期,是研究真核细胞生长、 发育和凋亡的重要模式生物[1],其在酿酒工艺生产中应用广泛. 菌株分裂是一个高度保守调控过程,需有序协调一系列在时间和空间上调控的事件,包括在分裂部位形成肌动蛋白环、 环收缩、 膜沟形成和细胞外基质重塑,该过程对维持菌株的基因组完整性至关重要. 菌株分裂功能障碍或失调会导致菌株的生长和代谢功能缺陷,丧失对菌株发酵过程有效调节和控制[2-3].
sgf73基因是基因编码SAGA(Spt-Ada-Gcn5-acetyltransferase)复合物中的SGF73蛋白亚基(SAGA complex subunit SGF73),由344个氨基酸组成,相对分子质量为38 580(38.58 kDa),与SUS1,SGF11 和UBP8(酶学活性亚基)共同组成SAGA 复合物的去泛素化模块(deubiquitination module, DUBm)[4],在染色质修饰、 转录、 DNA 损伤修复和mRNA 转运等过程中发挥作用[5]. SGF73 作为一个 SAGA 复合物亚基,负责在 SAGA 主体结构上锚定去泛素化模块,与 SAGA 复合物一起发挥作用,同时SGF73作为组蛋白H2B泛素水平的调节因子,参与转录起始和修饰. 在菌株分裂中,SGF73蛋白通过触发菌株周期蛋白依赖性激酶(CDK)底物的去磷酸化,从而调节G2/M期的过渡. sgf73 基因缺失会直接引起去泛素化模块解离[6],导致组蛋白 H2B 泛素化水平整体上调[7],引发RNA诱导的转录沉默复合物(RNA-induced initiation of transcriptional gene silencing,RITS)装配异常[8],显著降低菌株生长速率并导致菌株形态异常[9]. sgf73基因异常还可导致胞质分裂缺陷[10],同时导致菌株发酵的正向调控机制失常.
对sgf73基因缺失后菌株有丝分裂中纺锤体、 染色体和肌动蛋白的细胞动力学研究表明,sgf73基因敲除导致子囊孢子数目减少,其中产4个子囊孢子的sgf73Δ比野生型菌株减少了(4.07±1.72)%,纺锤体形成缺陷,单极纺锤体增加,同时肌动蛋白形成的分裂环在有丝分裂中从形成到消失的时间缩短了(7.65±3.55)min,速率降低了(0.02±0.01)μm/min,并导致染色体分离缺陷. 但sgf73基因缺失后导致有丝分裂中纺锤体组装、 染色体分离及肌动蛋白分裂环收缩缺陷的关键基因和信号通路尚未见文献报道. 基于此,本文采用RNA-Seq测序技术对野生型和基因敲除型sgf73Δ菌株测序并进行生物信息学分析,揭示sgf73基因缺失后菌株異常生长过程中的关键基因和关键代谢通路,为提高粟酒裂殖酵母菌发酵产率及代谢规律研究提供一定科学依据.
1 材料与方法
1.1 材料与仪器
粟酒裂殖酵母菌株(S.pombe)保存于西华师范大学西南野生动植物资源保护教育部重点实验室,其中PT286菌株的基因型为h-wt,1003菌株的基因型为h+sgf73Δ: KanR.
酵母提取物、 葡萄糖和琼脂购于美国Thermo Fisher Scientific公司; 组氨酸(L-Histidine)、 亮氨酸(L-Leucine)、 赖氨酸(L-Lysine)、 腺嘌呤和尿嘧啶购于美国西格玛奥德里奇贸易有限公司.
全自动压力蒸汽灭菌锅(LDZX-30FA型,上海申安医疗器械厂); 超清工作台(SE-CJ-1F型,苏州安泰空气技术有限公司); 恒温摇床(THZ-Q型,上海百典仪器设备有限公司); 酶标仪(Epoch型,美国基因有限公司); 电热恒温培养箱(DPX-9272B-1型,美国赛默飞世尔科技公司); 电子分析天平(AR2130型,美国奥豪斯仪器有限公司); -80 ℃超低温冰箱(BCD-208K/A型,青岛海尔股份有限公司); 移液枪(Eppendorf型,德国艾本德国际贸易有限公司); 离心机(5418R型,德国艾本德国际贸易有限公司).
1.2 方 法
1.2.1 菌种复苏及活化
将用体积分数30%的无菌甘油冻存于-80 ℃超低温冰箱中编号为PT286和1003的菌种取出,在YE5S固体培养基上均匀涂布,置于25 ℃恒温培养箱中,恒温培养约48 h. 从YE5S固体培养基上刮取适量PT286和1003菌体,接种至5 mL YE5S培养液中,于25 ℃,120 r/min恒温摇床培养24 h; 用酶标仪测得OD595为0.5~0.8后[11],取1 mL菌液离心,收集离心后的菌体保存于1 mL的Trizol溶液中,并标记样品名称.
1.2.2 样品质量检测
将保存于Trizol中的裂殖酵母细胞冷冻,由北京诺禾致源生物信息科技有限公司进行样品RNA提取及质量检测: 采用琼脂糖凝胶电泳技术,分析RNA的降解程度以及污染状况; 采用NanoDrop检测RNA的纯度(OD260/OD280); 采用Qubit技术对RNA的浓度进行精确定量; 采用Agilent2100方法精确检测RNA的完整性. 样品检测合格后,构建cDNA文库,库检合格后上机测序.
1.2.3 生物信息学分析
整理野生型(wt)和基因敲除型(sgf73Δ)菌株的总RNA测序获得原始数据(raw reads),去除接头数据和低质量数据,得到分析数据(clean reads),用Hisat2软件将分析数据与参考基因组进行快速精确比对,用Feature Counts,Stringtie和Subread软件对基因表达进行定量分析,用DESeq2和EdgeR软件对样本的基因表达量进行差异显著性分析,用Cluster Profile软件对差异基因进行GO和KEGG功能富集分析.
2 结果与分析
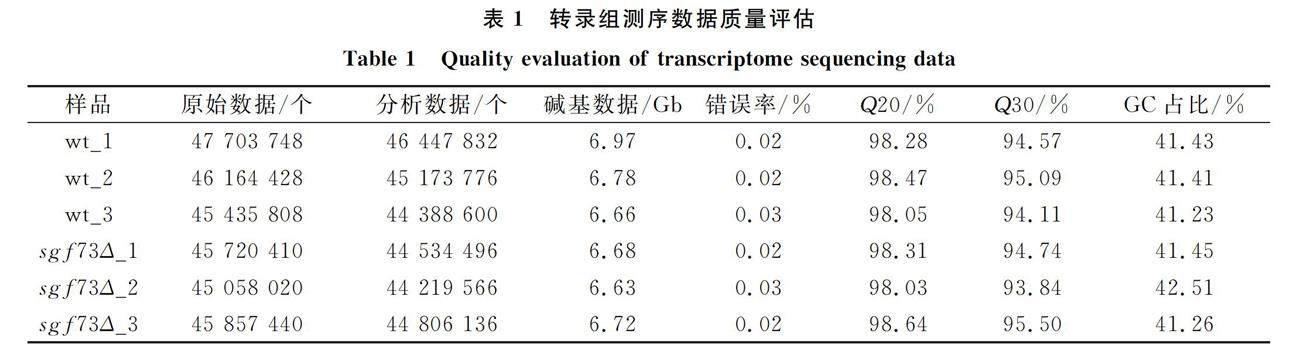
2.1 转录组测序数据质量分析
将酵母细胞转录组RNA-Seq测序得到的原始数据过滤后,野生型菌株分别获得6.97,6.78,6.66 Gb分析数据,sgf73Δ菌株分别获得6.68,6.63,6.72 Gb分析数据,结果列于表1. 由表1可见: 野生型菌株和sgf73Δ菌株3次测序结果平均值的碱基错误率均低于0.03%; Q30值分别大于94.11%和93.84%; GC碱基无AT和GC分离现象,其含量分别为41.36%和41.74%,符合酵母基因组GC含量分布特征.
2.2 基因表达水平分析
通过RSEM软件信息学分析后,对野生型和sgf73Δ菌株的基因表达量进行定量分析和比较,设定基因高水平表达为FPKM>60,基因低水平表达或不表达为FPKM<0.3[12]. 野生型菌株有5 239个基因表达,约占基因总数的71.73%,其中有1 967个基因高表达,约占基因总数的26.93%; sgf73Δ菌株有5 369个基因表达,约占基因总数的73.51%,其中有1 834个基因高表达,约占基因总数的25.11%.
进一步分析发现,野生型菌株有9个基因为极高表达(FPKM>4 000),分别为gpd3,zym1,hsp9,hsp16,fba1,eno101,tdh1,pgk1,tef103. sgf73Δ菌株有6个基因为极高表达,分别为tdh1,hsp9,fba1,eno101,tpi1,tef103. 结果列于表2 .
由表2可见,gpd3,pgk1,hsp16基因仅在野生型菌株中极高表达,tpi1基因仅在sgf73Δ组中极高表达, hsp9在sgf73Δ菌株中的FPKM值从7 879.47下降为6 414.72. gpd3,pgk1和tpi1基因共同编码糖酵解途径的关键酶[13-14],而糖酵解酶、 甘油醛-3-磷酸脱氢酶与有丝分裂突变抑制因子Mcs4 (mitotic catastrophe suppressor)可通过物理相互作用激活 MAP 激酶级联反应协调细胞有丝分裂过程. 热休克蛋白Hsp9和Hsp16参与细胞核内细胞周期G2-M检查点的调节,并调控细胞末期细胞板的形成和F-肌动蛋白收缩环结构稳定性[15]. 肌动蛋白作为真核细胞的细胞骨架中重要组成部分,在有丝分裂时形成分裂环,维持一段时间后进入收缩期,有丝分裂结束后将细胞一分为二,且多种关键基因功能缺失可导致细胞分裂过程中肌动蛋白分裂环形成和细胞有丝分裂时间延长,如在裂殖酵母细胞中,ain1(编码α-肌动蛋白)影响细胞分裂过程和肌动蛋白细胞骨架组成,该基因缺失后导致收缩环变形、 收缩异常[16]. 野生型菌株和sgf73Δ菌株形成分裂环維持时间分别为(12.90±2.66)min和(16.8±2.88)min,相比野生型菌株延长了(3.90±0.22)min. 野生型菌株和sgf73Δ菌株有丝分裂中纺锤体从形成到断裂的总时间分别为(30.15±2.48)min和(38.78±8.03)min,相比野生型菌株延长了(8.63±5.55)min. 可见,sgf73基因敲除导致分裂环在有丝分裂中维持时间极显著延长后,有丝分裂总时间极显著延长(P<0.01). 该结果与本文中gpd3,pgk1,hsp16,tpi1等高表达基因定量分析结果显示敲除sgf73基因后细胞分裂中收缩环的动力学及正常生长代谢过程发生改变,导致细胞有丝分裂过程异常相符.
2.3 差异表达基因(DEGs)分析
使用DESeq软件对野生型和sgf73Δ菌株的转录组数据进行差异表达基因(DEGs)分析,设置显著差异表达阈值为校正后的P值(padj)<0.05、 差异倍数(|log2FoldChange|)>0,结果分别如图1和图2所示. 两组间差异表达基因有1 714个,其中934个基因上调,780个基因下调. 上调差异倍数较大的10个基因为mat2-Pc,mat2-Pi,tf2-13,grt1,str3,isp3,aat1,prl51,tlh2,mug146,下调差异倍数较大的10个基因为mat3-Mc,mat1-Mc,dak2,mat3-Mc,rik1,agl1,5S_rRNA,cao2,gal7,eno102,分别列于表3和表4.
由表3和表4可见,差异最显著的基因包括上调的tf2-13,grt1,isp3和下调的mat3-Mc,mat1-Mc基因. 其中,tf2-13基因在营养缺陷的胁迫环境下上调表达[17]; grt1基因可应对环境和生理压力并调控相关基因表达[18]; isp3基因定位于细胞孢子壁上,对抵抗环境压力的胁迫起主要作用,可提高对热环境、 消化酶和乙醇的耐受性[19]. mat3-Mc和mat1-Mc基因以序列特异性方式与 DNA 结合,调控细胞交配型区域,同时调控粟酒裂殖酵母的减数分裂[20]. 在sgf73Δ菌株中,tf2-13,grt1和isp3基因分别上调8.458 7,5.5183,4.773 4倍,表明sgf73基因与上述基因共同作用通过内部调节以适应胁迫环境下的存活. 在细胞减数分裂过程中,多种关键基因突变会导致细胞分裂异常且影响产孢数量,如nce102(编码173个氨基酸的跨膜蛋白),该基因缺失可导致孢子分生异常[21]; 在裂殖酵母中,裂变酵母突触蛋白直向同源物syb1与高尔基体后分泌囊泡相关,在氮饥饿条件下形成异常孢子壁,并影响孢子形成[22]. sgf73基因缺失导致子囊孢子数目显著减少,野生型菌株99.2 %产生4个子囊孢子,sgf73Δ菌株(95.13±1.72)%产生4个子囊孢子,与野生型菌株相比减少了(4.07±1.72)%,具有显著差异(P<0.05),表明sgf73基因可能与裂殖酵母有性生殖相关. sgf73基因敲除后,mat3-Mc和mat1-Mc基因分别下调6.985 3,5.465 9倍,表明sgf73Δ菌株中细胞减数分裂调控过程被抑制,从而减数分裂发生异常,子囊孢子减少.
2.4 差异基因GO 富集分析
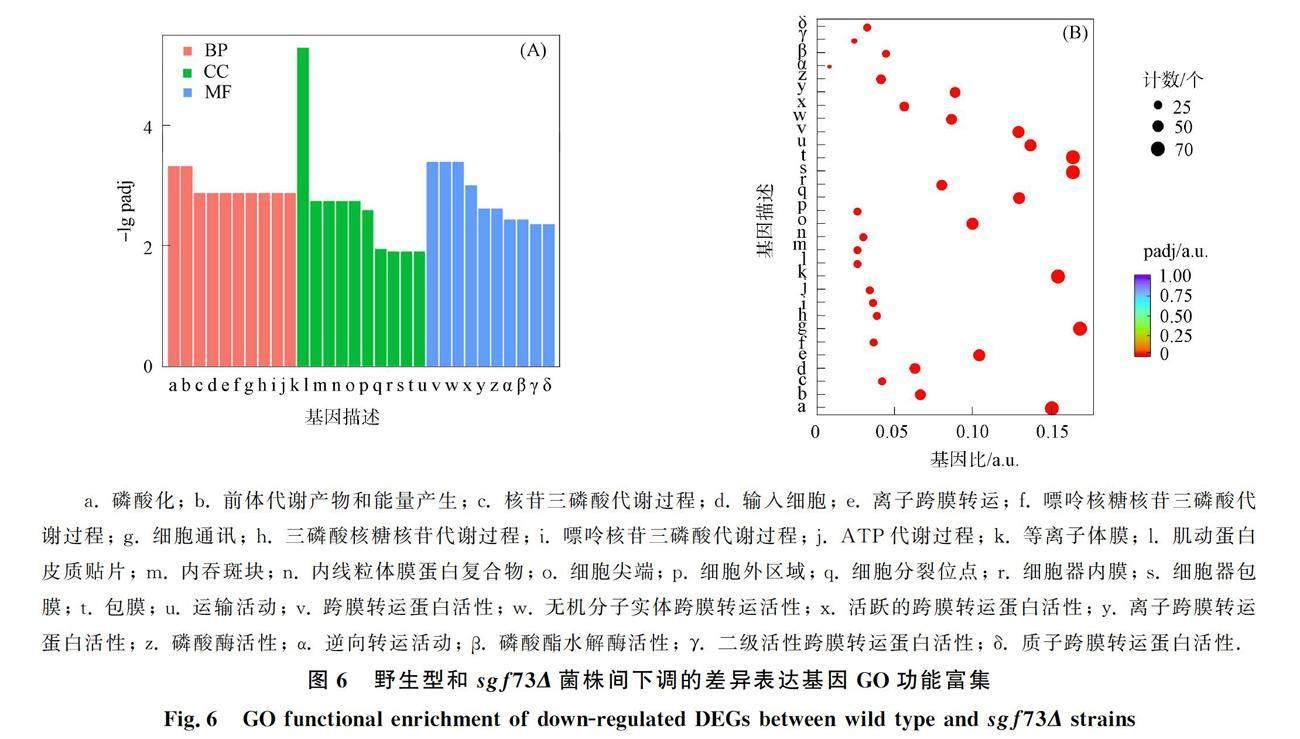
对野生型和sgf73Δ菌株的差异基因进行GO富集分析,包括对生物过程(BP)、 细胞组分(CC)和分子功能(MF)进行分析比较,并选取上调和下调的差异表达基因GO富集最显著的30个类别绘制柱状图和散点图,
结果分别如图3~图6所示. 由图3~图6可见,与野生型相比,sgf73Δ菌株中的差异表达基因富集到201个GO类别,包括122个生物过程、 47个细胞组分和32个分子功能. 其中,在生物过程中,代谢和能量合成过程被显著富集,特别是磷酸化過程以及前体代谢物和能量的产生过程,分别有82,40个下调基因被富集; 在细胞组分中,胞质核糖体部分有63个上调基因被显著富集; 在分子功能中,有关跨膜转运蛋白活性和转运活动的71个下调基因被显著富集.
a. 减数分裂细胞周期调节; b. 跨膜运输; c. 阴离子跨膜转运; d. 离子跨膜转运; e. 减数分裂细胞周期正向调节; f. 谷氨酰胺家族氨基酸代谢过程; g. 谷氨酰胺家族氨基酸分解代谢过程; h. 多生物过程调节; i. 离子传输; j. 细胞金属离子稳态; k. 细胞外区域; l. 胞质核糖体; m. 等离子体膜; n. 质膜组成部分; o. 胞质部分; p. 细胞壁; q. 外部封装结构; r. 细胞质大核糖体亚单位; s. 细胞质小核糖体亚单位; t. 质膜固有成分; u. 跨膜转运蛋白活性; v. 运输活动; w. 无机分子实体跨膜转运活性; x. 离子跨膜转运蛋白活性; y. 核糖体结构组成; z. 磷酸酶活性; α. 阴离子跨膜转运蛋白活性; β. 离子反转运体活性; γ. 二级活性跨膜转运蛋白活性; δ. 有机阴离子跨膜转运蛋白活性.
a. 减数分裂细胞周期调节; b. 跨膜运输; c. 阴离子跨膜转运; d. 离子跨膜转运; e. 减数分裂细胞周期正向调节; f. 谷氨酰胺家族氨基酸代谢过程; g. 谷氨酰胺家族氨基酸分解代谢过程; h. 多生物过程调节; i. 离子传输; j. 细胞金属离子稳态; k. 细胞外区域; l. 胞质核糖体; m. 等离子体膜; n. 质膜组成部分; o. 胞质部分; p. 细胞壁; q. 外部封装结构; r. 细胞质大核糖体亚单位; s. 细胞质小核糖体亚单位; t. 质膜固有成分; u. 跨膜转运蛋白活性; v. 运输活动; w. 无机分子实体跨膜转运活性; x. 离子跨膜转运蛋白活性; y. 核糖体结构组成; z. 磷酸酶活性; α. 阴离子跨膜转运蛋白活性; β. 离子反转运体活性; γ. 二级活性跨膜转运蛋白活性; δ. 有机阴离子跨膜转运蛋白活性.
a. 细胞质翻译; b. 翻译; c. 酰胺生物合成工艺; d. 多肽生物合成工艺; e. 细胞酰胺代谢过程; f. 肽代谢过程; g. 核糖体生物起源; h. 核糖核蛋白复合物的生物发生; i. 核糖体大亚单位生物发生; j. 细胞质翻译延伸; k. 胞质核糖体; l. 胞质部分; m. 核糖体亚基; n. 核糖体; o. 细胞质大核糖体亚单位; p. 细胞质小核糖体亚单位; q. 大核糖体亚单位; r. 小核糖体亚单位; s. 浓缩染色体内着丝粒; t. 浓缩染色体; u. 核糖体结构组成; v. 分子结构活性动; w. 核糖体RNA结合; x. 辅助因子跨膜转运蛋白活性; y. ATP酶调节活性; z. 蛋白质异源二聚活性性; α. 硫化合物跨膜转运蛋白活性; β. 翻译伸长因子活性; γ. 未折叠蛋白结合; δ. 有机阴离子跨膜转运蛋白活性.
a. 磷酸化; b. 前体代谢产物和能量产生; c. 核苷三磷酸代谢过程; d. 输入细胞; e. 离子跨膜转运; f. 嘌呤核糖核苷三磷酸代谢过程; g. 细胞通讯; h. 三磷酸核糖核苷代谢过程; i. 嘌呤核苷三磷酸代谢过程; j. ATP代谢过程; k. 等离子体膜; l. 肌动蛋白皮质贴片; m. 内吞斑块; n. 内线粒体膜蛋白复合物; o. 细胞尖端; p. 细胞外区域; q. 细胞分裂位点; r. 细胞器内膜; s. 细胞器包膜; t. 包膜; u. 运输活动; v. 跨膜转运蛋白活性; w. 无机分子实体跨膜转运活性; x. 活跃的跨膜转运蛋白活性; y. 离子跨膜转运蛋白活性; z. 磷酸酶活性; α. 逆向转运活动; β. 磷酸酯水解酶活性; γ. 二级活性跨膜转运蛋白活性; δ. 质子跨膜转运蛋白活性.
2.5 差异基因KEGG 富集分析
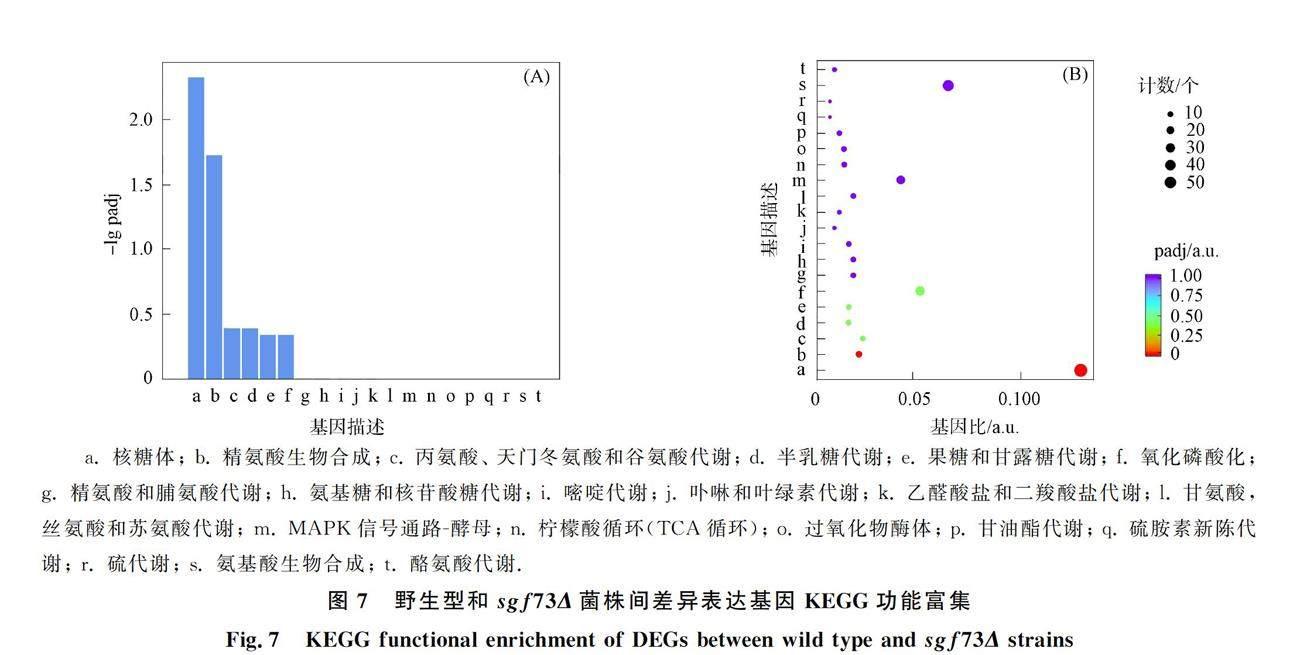
为进一步研究sgf73基因缺失后细胞分裂异常的关键通路,对野生型和sgf73Δ菌株的差异表达基因进行KEGG富集分析,结果表明,有452个差异基因成功富集并注释在80条通路中,选取上调和下调差异表达基因KEGG富集最显著的20个通路绘制成柱状图和散点图,如图7所示. 上调的差异表达基因主要富集在核糖体通路中,如图8所示. 在下调的差异表达基因KEGG富集分析中(图9),差异基因富集在氧化磷酸化、 半乳糖代谢、 精氨酸生物合成、 果糖和甘露糖代谢、 柠檬酸循环(TCA 循环)和MAPK等多条信号通路中,结果列于表5.
野生型和sgf73Δ菌株间差异表达基因的代谢通路富集如图10所示. 由图10可见, 富集最集中的通路为MAPK信号通路,该通路由高度保守的MAPKKK、 MAPKK和MAPK丝/苏氨酸蛋白激酶组成,通过蛋白磷酸化方式进行调控,参与真核生物细胞的周期调节、 细胞生长、 分化和凋亡过程. 在该途径中,有14个基因被显著富集,下调基因有12个,分别为git5,cki1,cki2,ptc1,ksg1,rgf2,rho1,bgs1,bgs3,gpd1,stt4和cdc25.
a. 核糖体; b. 精氨酸生物合成; c. 丙氨酸、 天门冬氨酸和谷氨酸代谢; d. 半乳糖代谢; e. 果糖和甘露糖代谢; f. 氧化磷酸化; g. 精氨酸和脯氨酸代谢; h. 氨基糖和核苷酸糖代谢; i. 嘧啶代谢; j. 卟啉和叶绿素代谢; k. 乙醛酸盐和二羧酸盐代谢; l. 甘氨酸,丝氨酸和苏氨酸代谢; m. MAPK信号通路-酵母; n. 柠檬酸循环(TCA循环); o. 过氧化物酶体; p. 甘油酯代谢; q. 硫胺素新陈代谢; r. 硫代谢; s. 氨基酸生物合成; t. 酪氨酸代谢.
a. 核糖体; b. DNA復制; c. 硫代谢; d. 丙氨酸、 天门冬氨酸和谷氨酸代谢; e. 半胱氨酸和蛋氨酸代谢; f. 精氨酸生物合成; g. 真核生物中的核糖体生物发生; h. 嘧啶代谢; i. 叶酸生物合成; j. 核苷酸切除修复; k. 剪接体; l. 氨基酸生物合成; m. 基底切除修复; n. 精氨酸和脯氨酸代谢; o. 嘌呤代谢; p. 减数分裂-酵母; q. 赖氨酸生物合成; r. 辅助因子生物合成; s. 各种类型的N-聚糖生物合成; t. 甘氨酸、 丝氨酸和苏氨酸代谢.
a. 氧化磷酸化; b. 半乳糖代谢; c. MAPK信号通路-酵母; d. 精氨酸生物合成; e. 果糖和甘露糖代谢; f. 柠檬酸循环(TCA循环); g. 自噬-酵母; h. 甘油酯代谢; i. 氨基糖和核苷酸糖代谢; j. 次生代谢产物生物合成; k. 卟啉和叶绿素代谢; l. 类固醇生物合成; m. 酪氨酸代谢; n. 碳代谢; o. 甘油磷酸酯代谢; p. 硫胺素新陈代谢; q. 乙醛酸盐和二羧酸盐代谢; r. 淀粉和蔗糖代谢; s. 膜泡输运中的SNARE相互作用; t. 糖酵解/糖异生.
调控细胞周期和细胞骨架稳定性的cki1,cki2,cdc25等差异基因被显著富集.
cki1和cki2均属于CK1 家族激酶,参与调节细胞周期、 染色体分离和细胞分化过程; cdc25基因参与细胞周期的调控,当DNA受损或不完全复制时,该酶下调表达或不表达以阻止细胞周期进展[23]; rgf2和rho1基因同属于RHO家族基因,其中rho1基因通过与蛋白激酶Pkc1的相互作用控制下游信号通路Pkc1-Mpk1 MAP激酶级联反应,进而调控细胞在热休克胁迫条件下肌动蛋白极化过程[24],而rgf2基因在细胞分裂间期和隔膜期定位于细胞末端,参与调节肌动蛋白细胞骨架和细胞壁合成过程; stt4编码的1-磷脂酰肌醇 4-激酶 STT4可补偿性调节磷酸肌醇合成,进而调控肌动蛋白细胞骨架组织. 肌动蛋白作为细胞骨架的重要组成部分,是真核细胞中最丰富的蛋白质之一,参与细胞运动、 细胞内囊泡运输及细胞分裂过程. 在裂殖酵母细胞中, 有adf1(编码共丝蛋白)和imp2(编码收缩环蛋白 Imp2)两种基因; adf1基因缺失导致肌动蛋白解聚速率降低、 收缩环组装异常和收缩速率降低; imp2基因与小鼠 pstpip1基因(编码脯氨酸-丝氨酸-苏氨酸磷酸酶相互作用蛋白)同源,该基因缺失后胞质分裂显示出缺陷,并影响细胞完整性[16]. sgf73基因缺失后导致肌动蛋白形成的分裂环在有丝分裂中维持时间极显著延长,收缩时间显著延长,导致调控肌动蛋白细胞骨架过程受损. stt4和rgf2基因在sgf73Δ菌株中均下调表达,表明sgf73基因缺失后导致参与肌动蛋白形成分裂环及分裂环收缩的系列过程受损.
在细胞有丝分裂期间,多种关键基因功能缺失可导致细胞分裂过程中纺锤体组装缺陷,细胞极化生长过程受损,如aug7基因编码Augmin亚基7,该基因突变可导致γ-微管蛋白在有丝分裂纺锤体的定位改变,使纺锤体异常伸长[25]; cut7基因编码驱动蛋白5,在人类、 果蝇和裂殖酵母中,该基因缺失可导致单极纺锤体的产生和染色体分离失败; eml3基因编码微管相关蛋白3,该基因编码的蛋白被细胞周期蛋白依赖性激酶(Cdk1)磷酸化后,可促进与Augmin亚基和γ-微管蛋白复合物的结合,对纺锤体组装和着丝粒连接有重要作用,敲除该基因影响纺锤体装配检查点,导致染色体聚集和细胞分裂的延迟[26]. sgf73Δ菌株形成点状纺锤体菌株有显著差异(P<0.05),形成棒状和单极纺锤体的菌株与野生型菌株有极显著差异(P<0.01). 表明sgf73基因敲除导致纺锤体形成缺陷,单极纺锤体增加,不利于有丝分裂中染色体的正确分离,导致细胞周期受阻及细胞极化生长受损. cdc25,cki1,cki2基因在sgf73Δ菌株中均下调表达,表明sgf73基因缺失导致细胞周期受阻,细胞极化生长过程受损.
综上所述,本文通过对粟酒裂殖酵母野生型及sgf73基因敲除型菌株的转录组分析,筛选出1 714个差异表达基因,其中934个基因上调,780个基因下调,这些差异基因主要富集在MAPK信号通路中调控菌株产孢、 细胞分裂和维持细胞骨架稳定的过程. 研究表明,sgf73基因参与粟酒裂殖酵母菌株的有性生殖及有丝分裂中纺锤体组装和肌动蛋白环收缩的过程,为粟酒裂殖酵母菌生长代谢规律研究提供了一定科学依据.
参考文献
[1] HOFFMAN C S, WOOD V, FANTES P A. An Ancient Yeast for Young Geneticists: A Primer on the Schizosaccharomyces pombe Model System [J]. Genetics, 2015, 201(2): 403-423.
[2] 袁荣美,丁祥,谭秀梅,等. 线粒体外膜转位酶基因tom70缺失对裂殖酵母细胞动力学的影响 [J]. 南京师大学报(自然科学版), 2020,43(3): 120-128. (YUAN R M, DING X, TAN X M, et al. Loss of tom70 (Translosage of Outer Mitochondiral 70) Results in Changes of Cell Dynamics in Fission Yeast [J]. Journal of Nanjing Normal University (Natural Science Edition), 2020,43(3): 120-128.)
[3] 朱娟娟, 郑少阳, 李炎杰, 等. 不同酿酒酵母对脐橙果酒发酵特性的影响 [J]. 南方农业学报, 2017,48(5): 870-875. (ZHU J J, ZHENG S Y, LI Y J, et al. Effects of Different Yeasts on Fermentation Characteristics of Navel Orange Wine [J]. Journal of Southern Agriculture, 2017,48(5): 870-875.)
[4] HSU C H, CHEN Y J, YANG C N. Loss of Function in SAGA Deubiquitinating Module Caused by Sgf73 H93A Mutation: A Molecular Dynamics Study [J]. J Mol Graph Model, 2019,91: 112-118.
[5] WU P Y, RUHLMANN C, WINSTON F, et al. Molecular Architecture of the S.cerevisiae SAGA Complex [J]. Mol Cell, 2019,15(2): 199-208.
[6] KHLER A, SCHNEIDER M, CABAL G G, et al. Yeast Ataxin-7 Links Histone Deubiquitination with Gene Gating and Mrna Export [J]. Nat Cell Biol, 2008, 10(6): 707-715.
[7] YANG H, LIU S, HE W T, et al. Aggregation of Polyglutamine-Expanded Ataxin 7 Protein Specifically Sequesters Ubiquitin-Specific Protease 22 and Deteriorates Its Deubiquitinating Function in the Spt-Ada-Gcn5-Acetyltransferase (SAGA) Complex [J]. J Biol Chem, 2015, 290(36): 21996-22004.
[8] DENG X, ZHOU H, ZHANG G, et al. Sgf73, a Subunit of SAGA Complex, Is Required for the Assembly of RITS Complex in Fission Yeast [J]. Sci Rep, 2015, 5: 14707-1-14707-9.
[9] SHEN Y Q, SHERMAN J W, CHEN X Y, et al. Phosphorylation of CDC25C by AMP-Activated Protein Kinase Mediates a Metabolic Checkpoint during Cell-Cycle G(2)/M-Phase Transition [J]. J Biol Chem, 2018, 293(14): 5185-5199.
[10] 周幸, 周楠, 余垚, 等. 裂殖酵母SAGA各亚基亚细胞荧光定位分析 [J]. 遗传, 2014, 36(2): 169-180. (ZHOU X, ZHOU N, YU Y, et al. Subcellular Fluorescence Localization of Analysis of All SAGA Subunits in Fission Yeast (Schizosaccharomyces pombe) [J]. Hereditas, 2014,36(2): 169-180.)
[11] 方佩佩,王世清,李静,等. 耐酒精酿酒酵母大气压等离子体诱变条件的建立及选育 [J]. 酿酒科技, 2016(9): 31-37. (FANG P P, WANG S Q, LI J, et al. Establishment of the Conditions of Atomspheric Plasa-Inducing Mutation of S.cerevisiae and Breeding of an Ethanol-Tolerant Strain [J]. Liquor-Making Science & Technology, 2016(9): 31-37.)
[12] 宋志強,丁祥,唐贤,等. 松乳菇子实体两个发育时期的转录组分析 [J]. 浙江农业学报, 2020,32(2): 337-347. (SONG Z Q, DING X, TANG X, et al. Transcriptome Analysis of Fruiting Bodies of Lactarius deliciosus at Two Developmental Stages [J]. Zhejiang Agriculturae Zhejiangensis, 2020,32(2): 337-347.)
[13] MORIGASAKI S, SHIMADA K, IKNER A, et al. Glycolytic Enzyme GAPDH Promotes Peroxide Stress Signaling through Multistep Phosphorelay to a MAPK Cascade [J]. Mol Cell, 2008, 30(1): 108-113.
[14] WIERENGA R K, KAPETANIOU E G, VENKATESAN R. Triosephosphate Isomerase: A Highly Evolved Biocatalyst [J]. Cell Mol Life Sci, 2010, 67(23): 3961-3982.
[15] AHN J, WON M, CHOI J H, et al. Small Heat-Shock Protein Hsp9 Has Dual Functions in Stress Adaptation and Stress-Induced G2-M Checkpoint Regulation via Cdc25 Inactivation in Schizosaccharomyces pombe [J]. Biochem Biophys Res Commun, 2012,417(1): 613-618.
[16] MORITA R, TAKAINE M, NUMATA O, et al. Molecular Dissection of the Actin-Binding Ability of the Fission Yeast α-Actinin, Ain1, in vitro and in vivo [J]. J Biochem,2017,162(2): 93-102.
[17] MALLET P L, LAROCHELLE M, BACHAND F. Multiple Transcriptional and Post-Transcriptional Pathways Collaborate to Control Sense and Antisense RNAs of Tf2 Retroelements in Fission Yeast [J]. Genetics, 2017, 205(2): 621-632.
[18] FRANCOIS M, DONOVAN P, FONTAINE F. Modulating Transcription Factor Activity: Interfering with Protein-Protein Interaction Networks [J]. Semin Cell Dev Biol, 2020,99: 12-19.
[19] FUKUNISHI K, MIYAKUBI K, HATANAKA M, et al. The Fission Yeast Spore Is Coated by a Proteinaceous Surface Layer Comprising Mainly Isp3 [J]. Mol Biol Cell, 2014,25(10): 1549-1559.
[20] MATSUDA E, SUGIOKA-SUGIYAMA R, MIZUGUCHI T, et al. A Homolog of Male Sex-Determining Factor SRY Cooperates with a Transposon-Derived CENP-B Protein to Control Sex-Specific Directed Recombination [J]. Proc Natl Acad Sci U S A, 2011,108(46): 18754-18759.
[21] KHALAJ V, AZIZI M, ENAYATI S, et al. NCE102 Homologue in Aspergillus fumigatus Is Required for Normal Sporulation, Not Hyphal Growth or Pathogenesis [J]. FEMS Microbiol Lett, 2012, 329(2): 138-145.
[22] YAMAOKA T, IMADA K, FUKUNISHI K, et al. The Fission Yeast Synaptobrevin Ortholog Syb1 Plays an Important Role in Forespore Membrane Formation and Spore Maturation [J]. Eukaryot Cell, 2013, 12(9): 1162-1170.
[23] KARLSSON-ROSENTHAL C, MILLAR J B. Cdc25: Mechanisms of Checkpoint Inhibition and Recovery [J]. Trends Cell Biol, 2006,16(6): 285-292.
[24] NOMURA W, INOUE Y. Contribution of Phosphatidylserine to Rho1- and Pkc1-Related Repolarization of the Actin Cytoskeleton Under Stressed Conditions in Saccharomyces cerevisiae [J]. Small GTPases, 2019, 10(6): 449-455.
[25] HOTTA T, KONG Z, HO C M, et al. Characterization of the Arabidopsis augmin Complex Uncovers Its Critical Function in the Assembly of the Acentrosomal Spindle and Phragmoplast Microtubule Arrays [J]. Plant Cell,2012,24(4): 1494-1509.
[26] LUO J, YANG B Y, XIN G W, et al. The Microtubule-Associated Protein EML3 Regulates Mitotic Spindle Assembly by Recruiting the Augmin Complex to Spindle Microtubules [J]. J Biol Chem, 2019,294(14): 5643-5656.
(責任编辑: 单 凝)

