跑台运动对db/db小鼠心肌PPARα信号通路的影响研究
孙 易 ,张 怡 ,丁树哲 *
糖尿病是目前世界上最常见的慢性疾病之一。糖尿病心血管并发症是导致糖尿病患者死亡的主要原因,且其发病机理在于代谢失调和胰岛素抵抗的共同作用(杨宗璐 等,2021;Young et al.,2002)。心肌细胞具有很高的能量需求,其中大部分是通过脂肪酸氧化获得的,其余30%来自于葡萄糖和乳酸代谢(Neely et al.,1972)。然而,对于糖尿病患者来说,葡萄糖摄取、糖酵解和丙酮酸氧化等过程受到抑制,脂肪代谢活动上调,从而产生心肌脂变、过量ROS 生成和心肌细胞死亡等问题。已有研究认为,作为决定脂肪酸氧化能力的重要代谢因子(Bugger et al.,2014),过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)可能通过激活脂肪酸摄取和β 氧化相关基因调控糖尿病心肌代谢(Finck et al.,2002; Lee et al.,2017)。有证据表明,PPARα-/-小鼠不易发生糖尿病诱导的心脏肥大,而心脏特异性PPARα 过表达的糖尿病小鼠则表现出心肌细胞脂质堆积(Finck et al.,2003; 蔡欢 等,2016)。此外,miR-30c 及GLP-1(glucagon-like peptide-1,胰高血糖素样肽-1)也被认为通过PPARα 信号通路参与改善糖尿病心肌病(Wu et al.,2018;Yin et al.,2019)。运动训练一直被认为是干预糖尿病温和、有效的手段,能通过阻碍ROS 堆积、改善线粒体功能、抑制心肌凋亡通路、改善心肌纤维化等途径改善糖尿病心脏病变和心功能,并促进心肌代谢由脂肪酸氧化向葡萄糖供能转化(Delfan et al.,2020; Seo et al.,2019; Wang et al.,2020)。然而,目前鲜见探索PPARα 在运动缓解糖尿病心肌代谢失调中作用的研究,且糖尿病和运动干预对PPARα 表达的影响也尚存争议,考虑这可能与采用的动物模型和运动训练强度不同有关(陈国庆 等,2014; 张崇林 等,2018;Lee et al.,2010)。
除代谢失调外,胰岛素抵抗是导致糖尿病心肌病变发生的另一重要原因,其中,MG53 表达上调可能是导致糖尿病心肌胰岛素抵抗的因素之一(齐洁 等,2016; Liu et al.,2015)。MG53 是一种TRIM 家族蛋白,在骨骼肌和心肌中特异性表达。基于转基因动物模型(MG53Tg及MG53-/-)的研究显示,作为一种E3 泛素连接酶,MG53 可能通过诱导胰岛素受体(insulin receptor,IR)和胰岛素受体底物1(insulin receptor substrate 1,IRS1)降解促进胰岛素抵抗(Song et al.,2013)。除介导胰岛素抵抗外,MG53还被认为抑制糖代谢相关基因表达,上调脂代谢相关基因,且上述过程是通过上调PPARα 及其靶基因实现的(Hu et al.,2018;Liu et al.,2015)。然而,在自然生理病理条件下,MG53 是否参与各组织胰岛素抵抗尚未定论。有研究显示,肥胖及2 型糖尿病患者及模式鼠中可见血清MG53 水平升高,且采用单克隆抗体中和血MG53 能提高db/db小鼠胰岛素敏感性(Wu et al.,2019)。
db/db小鼠是一种应用广泛的自发性2 型糖尿病模型。db/db小鼠的心脏在10~14 周龄时即出现心肌代谢改变、收缩功能减弱等特性,因此适宜用于糖尿病心血管病变相关研究。基于此,本研究探索12 周跑台训练对db/db小鼠心肌代谢和胰岛素抵抗的作用,并分析PPARα和MG53 在其中的作用。
1 材料与方法
1.1 实验动物
20 只SPF 级6 周龄雄性db/db(BSK.Cg-Dock7m +/+Leprdb/JNju)小鼠和20 只m/m(C57BLKS/JNju)小鼠,购于南京大学模式动物研究所。db/db小鼠和m/m小鼠系通过杂合子db/m小鼠交配繁殖获得。在后代的3 种表型中,黑色肥胖者为db/db小鼠,具有2 型糖尿病的典型特征,灰色瘦小者为m/m小鼠,常用作对照鼠,小鼠均经过基因型鉴定。小鼠分笼饲养,环境温度(22±2) ℃,空气湿度(50±10)%,12 h/12 h 昼夜节律,自由摄食饮水。适应性喂养1 周后,小鼠随机分为4 组:db/db对照组(DC,n=10),db/db运动组(DE,n=10),m/m对照组(MC,n=10)和m/m运动组(ME,n=10)。测量并记录各组小鼠体质量和空腹血糖值。
1.2 跑台运动干预方案
跑台运动干预方案以已有研究为基础(Broderick et al.,2017; Sennott et al.,2008):第1 周,小鼠以7.0~13.3 m/min 的速度运动15~20 min,一周4 次。第2 周,小鼠以13.3 m/min的速度运动30~45 min,一周6 次,周日休息。第3~12 周,上述运动速度和频率维持不变,每日连续运动1 h,周日休息。小鼠运动训练时间为20:00—21:00。在第12 周,再次测量各组小鼠体质量和空腹血糖值。
1.3 腹腔胰岛素耐量(IPITT)实验
末次运动结束12 h 后,每组随机选取5 只小鼠进行IPITT 实验。小鼠禁食4 h,从尾部静脉取血测空腹血糖值(ACCU-CHEK 血糖测试仪)。腹腔内注射胰岛素(2 U/kg)后30、60、90、120 min 分别取血并测量血糖值。
1.4 组织获取
IPITT 实验结束当天,小鼠过夜禁食。每组随机抽取3 只小鼠进行胰岛素刺激。采用异戊烷(4%~5%)吸入对小鼠进行麻醉,随后腹腔注射5 U/kg 胰岛素,10 min 后取心脏。其余小鼠经眼眦取血后采用颈部脱臼法处死,取心脏,冲洗、称重,迅速装入已标记的冻存管中,立即置于液氮中速冻,后转存至-80 ℃冰箱保存待测。
1.5 血清生化检测
采用IPITT 实验中所取血液,4 ℃下1 100 g 离心15 min获得血清。采用试剂盒检测血清甘油三酯(A110-1,南京建成)和总胆固醇(A111-1,南京建成)含量。
1.6 RNA提取和Real-Time PCR
根据TRIzol(Invitrogen)方法从30 mg 冻存心肌组织提取总RNA。采用分光光度法测量RNA 的浓度和纯度。引物(表1)根据NCBI和PrimerBank 设计,由生工生物工程(上海)股份有限公司合成。利用TOYOBO FSQ-101 试剂盒从总RNA 反转录合成cDNA。采用ABI StepOne 实时荧光定量PCR 仪检测相关基因的mRNA 表达量,β-actin为内参。数据采用2-ΔΔCt法进行分析。
1.7 蛋白定量
取30 mg 心肌组织,冰上剪碎,于裂解液中匀浆。4 ℃下12 000 g 离心20 min,取上清液,BCA 法测量蛋白浓度后变性。采用10%分离胶电泳,蛋白转至PVDF 膜。4 ℃下一抗(表2)孵育过夜,洗膜后室温下二抗避光孵育2 h。显影后采用Alpha FC2 凝胶成像系统扫膜并进行灰度值分析,β-actin 为内参。
表2 抗体信息Table 2 Antibodies Information
1.8 数据统计分析
实验结果以平均值±标准误表示,统计软件为IBM SPSS Statistics 23,绘图软件为Graphpad prism 7。组间差异采用双因素方差分析检验;糖尿病模型和跑台运动两个干预因素间存在交互作用时,采用简单效应分析(least significant difference,LSD)检测一个自变量在另一个自变量各水平上的差异。小鼠体质量和空腹血糖在干预前后的差异采用重复测量双因素方差分析进行检验。采用线性回归对PPARα 蛋白表达与Cpt1b、Acadm、Acadvl、Acaa2和Pdk1 的mRNA 表达间的相关性进行检验,并计算相关系数(R)和P。P<0.05 表示具有显著性差异。
2 研究结果
2.1 糖尿病和跑台运动对心脏质量、血清指标和IPITT 的影响
4 个实验组间小鼠心脏质量无显著差异(图1)。MC、ME、DC 和DE 组小鼠血清胆固醇变异系数(coefficience of variation,CV)值分别为8%、13%、25%和22%;MC、ME、DC 和DE 组小鼠血清甘油三酯CV 值分别为13%、22%、13%和18%。尽管个别CV 值较高,但总体符合小鼠血清指标的离散特征。经双因素方差分析检验发现,与MC 组相比,DC 组小鼠血清总胆固醇和甘油三酯含量显著升高;与DC 组相比,DE 组小鼠血清总胆固醇和甘油三酯含量显著降低。IPITT 测试中,DC 组的曲线下面积(AUC)比MC 组显著增加,DE 组比DC 组显著降低。上述结果表明,糖尿病导致小鼠血脂含量增加,胰岛素耐量降低,且12 周跑台运动干预对上述变化有明显改善作用。
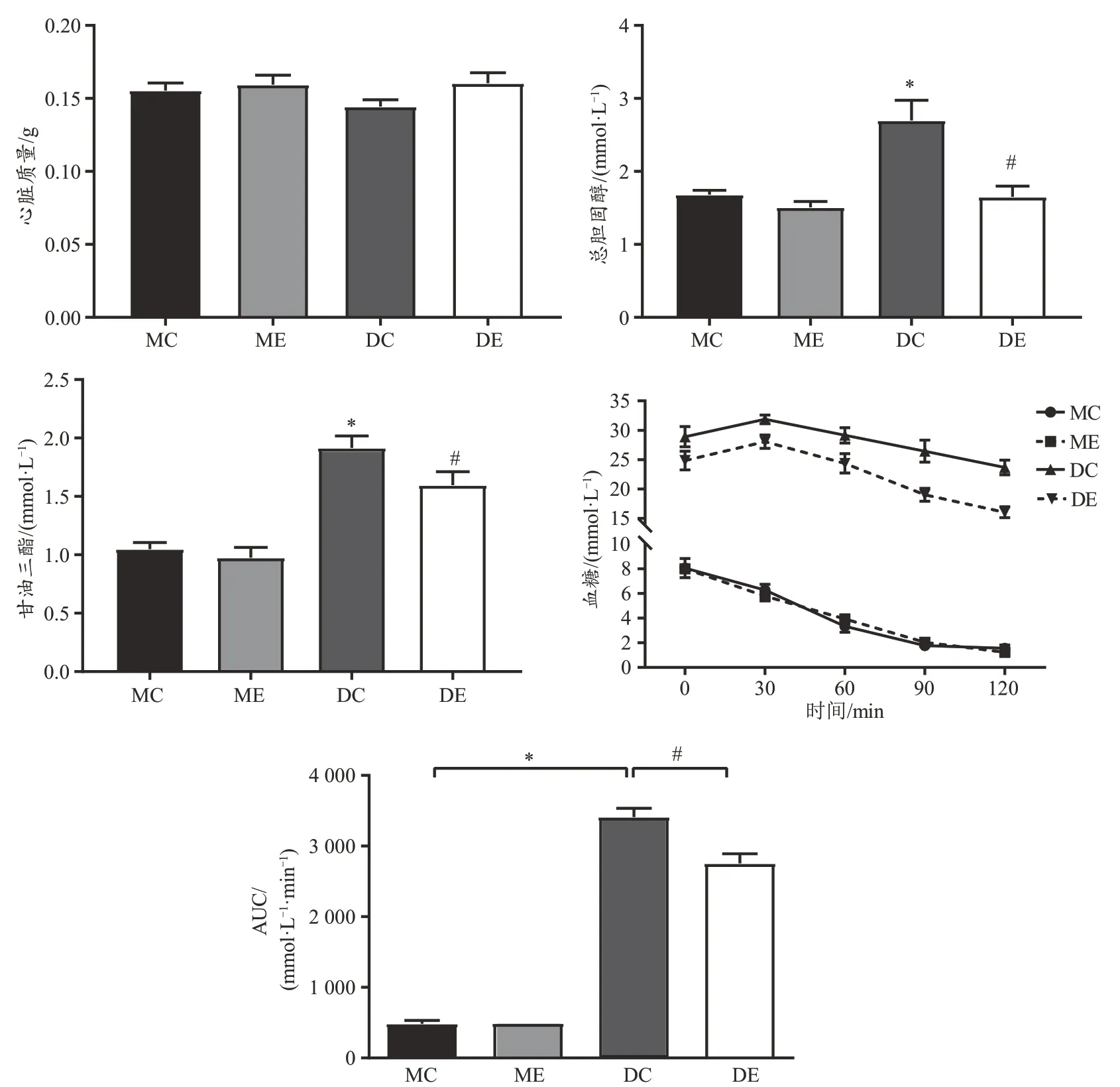
图1 小鼠基本特征示意图Figure 1.Basic Characteristics of the Mice
2.2 各组小鼠体质量与空腹血糖的变化
本研究分别在运动干预前(适应性喂养期)和运动干预的最后一周测量各组小鼠的体质量和空腹血糖值。结果显示(图2),运动干预前,与MC 组相比,DC 组的体质量和空腹血糖均显著升高。运动干预后,与MC 组相比,DC 组的体质量和空腹血糖均显著升高;与DC 组相比,DE 组的空腹血糖显著降低。与运动干预前相比,运动干预后各组小鼠体质量均显著增长,DC 组和DE 组空腹血糖显著升高。

图2 运动干预前后,小鼠体质量与空腹血糖变化示意图Figure 2.Changes of Body Weights and Fasting Blood Glucose of Mice Pre and Post Exercise Intervention
2.3 糖尿病和跑台运动对心功能相关基因mRNA 表达的影响
本研究检测了ANF、BNF、α-MHC、β-MHC、Actc1、Myl2、Itga5 和Caspase-3 共8 种心功能相关指标的基因表达。结果显示,与MC 组相比,DC 组ANF 和BNF 的mRNA表达显著降低,且跑台运动显著改善db/db小鼠的ANF 表达(图3)。与MC 组 相 比,DC 组α-MHC 和β-MHC 的mRNA 表达呈相反的变化,其中,α-MHC 表达降低,β-MHC表达升高;跑台运动显著增加db/db小鼠的α-MHC 表达。与MC 组相比,DC 组小鼠心肌Actc1 的mRNA 表达呈下降的趋势(P=0.051),且跑台运动对正常鼠和糖尿病鼠的Actc1 表达分别有降低和升高的作用。4 个实验组间未见Myl2、Itga5 和Caspase-3 的mRNA 表达有显著差异。

图3 糖尿病和跑台运动对心功能相关基因mRNA的影响Figure 3.Effects of Diabetes and Treadmill Running on mRNA Expression of Genes Related to Cardiac Function
2.4 糖尿病和跑台运动对脂肪和糖代谢以及PPARα信号通路的影响
本研究检测了PPARα 的蛋白表达,以及脂肪代谢相关酶(Cpt1b、Acadm、Acadvl 和Acaa2),糖代 谢相关酶(Pdk1、Pdk2)和PPARα 信号通路关键分子的mRNA 表达水平。结果显示,与MC 组相比,DC 组心肌Cpt1b、Acadm、Acadvl 和Acaa2 的mRNA 表达均显著升高;与DC 组相比,DE 组心肌中上述指标的表达显著降低(图4)。与MC 组相比,DC 组Pdk1 的mRNA 表达显著升高;与DC 组相比,DE 组Pdk1 的mRNA 表 达 显 著 降 低。PPARα 是 脂 肪代谢的关键调节因子。与MC 组相比,DC 组PPARα 的蛋白水平显著升高;与DC 组相比,DE 组PPARα 的蛋白水平显著降低。与MC 组相比,DC 组CD36、PGC-1β 和Fabp3 的mRNA 水平显著升高;与DC 组相比,DE 组CD36 的mRNA表达显著降低。

图4 糖尿病和跑台运动对脂肪和糖代谢以及PPARα信号通路影响示意图Figure 4.Effects of Diabetes and Treadmill Running on Metabolism of Fat and Glucose and PPARα Signaling Pathway
2.5 PPARα与Cpt1b、Acaa2和Acadvl之间的相关性分析
本研究对PPARα 的蛋白表达与Cpt1b、Acadm、Acadvl、Acaa2 和Pdk1 的mRNA 表达间进行了相关性分析。结果显示,PPARα 与Acadm(P=0.55)和Pdk1(P=0.20)间不存在线性相关;PPARα 与Acaa2(P=0.049,R=0.43)和Acadvl(P=0.034,R=0.50)间呈正相关;PPARα 与Cpt1b 间存在相关的趋势(P=0.072,R=0.40;图5)。
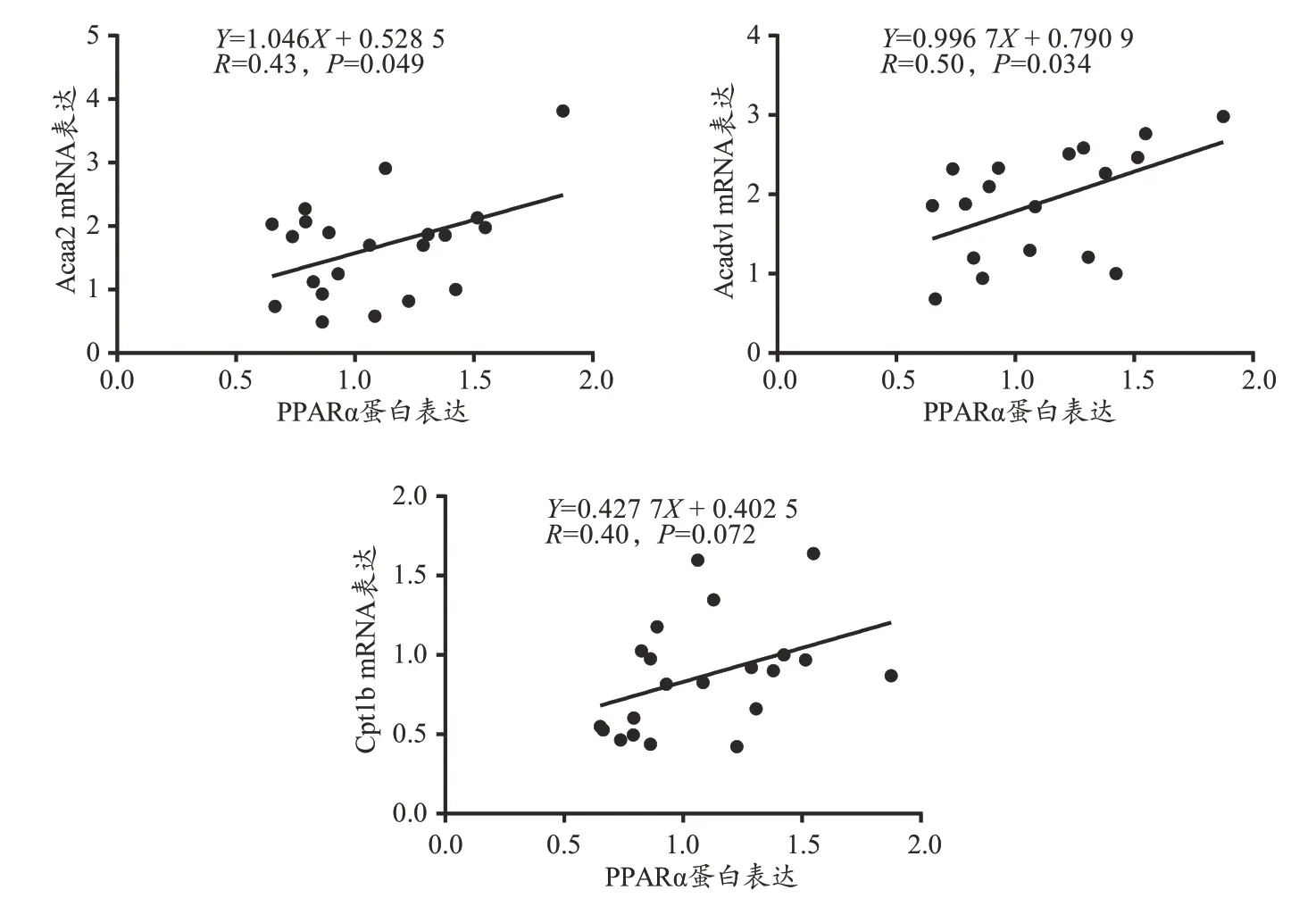
图5 PPARα与Acaa2、Acadvl和Cpt1b间的相关性分析Figure 5.Correlation Analysis among PPARα,Acaa2 and Acadvl and Cpt1b
2.6 糖尿病和跑台运动对MG53的mRNA和蛋白表达水平影响
本研究检测了MG53 的mRNA 和蛋白表达水平。结果显示,与MC 组相比,DC 组MG53 的mRNA 表达水平显著升高;与DC 组相比,DE 组MG53 的mRNA 表达显著降低(图6)。然而,4 个实验组间MG53 的蛋白表达未见显著差异。
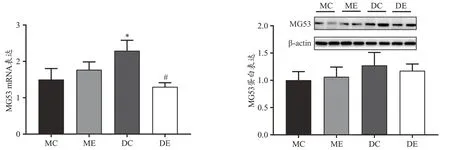
图6 糖尿病和跑台运动对MG53表达影响示意图Figure 6.Effects of Diabetes and Treadmill Running on the Expression of MG53
2.7 糖尿病和跑台运动对心肌胰岛素抵抗的影响
本研究检测了胰岛素信号通路中β-IR、IRS1 和AKT的总蛋白,以及急性胰岛素刺激下磷酸化蛋白表达水平。结果显示,4 个实验组间β-IR、IRS1 和AKT 的总蛋白表达无显著差异(图7)。与MC 组相比,DC 组胰岛素刺激下β-IR 和AKT 的磷酸化水平显著降低,IRS1 的磷酸化水平显著升高;与DC 组相比,DE 组胰岛素刺激下β-IR 和AKT的磷酸化水平显著升高,IRS1 的磷酸化水平显著降低。MC 组与DC 组间GLUT4 蛋白表达未见显著差异;与DC组相比,DE 组的GLUT4 蛋白水平显著增加。

图7 糖尿病和跑台运动对心肌胰岛素抵抗影响示意图Figure 7.Effects of Diabetes and Treadmill Running on Cardiac Insulin Resistance
3 讨论
心肌底物代谢异常和胰岛素抵抗是糖尿病小鼠心脏的显著病理特征,然而致其发生的分子机制并不完全明确,PPARα 和MG53 在上述过程中的作用也有待进一步探索。本研究中,通过对db/db和m/m小鼠实施12 周跑台运动干预,PPARα 参与糖尿病小鼠心肌脂肪代谢异常和跑台运动对脂代谢的改善作用。而与预期不同,在当前实验背景下,MG53 没有参与糖尿病心肌胰岛素抵抗。
一般认为,心脏肥大、糖尿病心肌病以及心力衰竭等疾病或病理状态往往伴随着心脏收缩、舒张功能的变化,同时,若干相关基因也表现出转录异常(如α-MHC 和β-MHC)。α-MHC 基因表达下调和β-MHC 基因表达上调与心肌收缩功能受到抑制有关(齐洁 等,2021;Chang et al.,2011; Lasheras et al.,2016;Plante et al.,2015)。本实验中,可见db/db小 鼠心肌α-MHC 和β-MHC 的mRNA 表达分别降低和升高,此外,跑台运动显著缓解了糖尿病所致的α-MHC 转录下调。上述结果表明,db/db小鼠心肌收缩功能可能受损,且跑台运动对其有缓解作用。此外,本研究还检测了ANF 和BNF 的mRNA 表达情况。ANF 和BNF 是心肌细胞产生的激素,对体外培养的心肌细胞具有抗肥大作用(Gutkowska et al.,2009;Woods,2004)。本研究中,db/db小鼠心肌ANF 和BNF 的mRNA 表达显著降低,且跑台运动改善糖尿病小鼠ANF 的mRNA 表达。然而,本研究并未对上述指标的蛋白表达进行检测,且对小鼠心脏质量进行测量发现,4 个实验组间未见显著差异,因此尚不能判断db/db小鼠是否存在心肌肥大。最后,本研究还检测了Actc1 的表达水平。Actc1 是编码α-心肌肌动蛋白的基因,与心脏收缩活动有关。研究显示,db/db小鼠心肌Actc1 的mRNA 表达有下降的趋势(P=0.051),且跑台运动显著上调db/db小鼠的Actc1 表达,这表明跑台运动可能使db/db小鼠心肌收缩加强,该结果也与已有证据相吻合(Cox et al.,2013)。然而,跑台运动下调了对照鼠心肌Actc1 的表达,目前对此尚无合理解释。心功能相关基因表达的检测结果表明,本研究中db/db小鼠的心功能与2 型糖尿病的病程发展相吻合,且跑台训练对其有改善作用。然而,本研究的不足之处在于,没有采用超声心动图对小鼠的心功能进行直接测定,因此,上述基因表达结果只能作为间接证据,支持跑台训练对糖尿病小鼠心功能的正面影响。
有研究表明,糖尿病小鼠存在系统性糖、脂代谢异常,且运动干预能改善甚至逆转上述变化(刘军 等,2020)。本研究中,db/db小鼠血清总胆固醇和甘油三酯含量显著增加,且跑台运动显著降低上述指标。其次,db/db小鼠IPITT 结果的AUC 与对照鼠相比显著升高,且在12 周跑台训练后显著降低。此外,db/db小鼠的空腹血糖水平也在运动干预后显著降低。上述结果证实了db/db小鼠存在系统性糖、脂代谢异常,且有氧运动干预可显著缓解db/db鼠机体糖、脂代谢紊乱,并改善其胰岛素抵抗状态。
除了系统代谢异常外,糖尿病患者心肌的糖、脂代谢也发生紊乱,表现为几乎完全倚赖脂肪酸氧化以供能(田阁 等,2018)。本研究检测了小鼠心肌中脂肪氧化相关酶的mRNA 表达,发现db/db小鼠心肌Cpt1b、Acadm、Acadvl和Acaa2 的mRNA 表达上调,且12 周跑台运动显著抑制Cpt1b、Acadm、Acadvl 和Acaa2 的表达。上述结果表明,长期有氧训练能有效逆转糖尿病胰岛素抵抗所致的脂肪酸代谢紊乱。在脂肪氧化供能增加的同时,糖尿病心肌中葡萄糖代谢也受到抑制。事实上,基于人类被试的研究显示,细胞内脂质浓度与胰岛素敏感性呈负相关(Krssak et al.,1999)。脂肪酸氧化增加会激活PDK,随后磷酸化并抑制PDH(曾芳桂,2017;Lee et al.,2017)。本研究中,可见db/db小鼠心肌Pdk1 的mRNA 表达显著增加,这可能由脂肪酸氧化增多所致;跑台运动可显著下调Pdk1的mRNA 表达,表明运动训练对心肌糖代谢紊乱的保护作用。此外,本研究还探索了心肌GLUT4 的变化,这是对心肌葡萄糖摄取能力的直观反映。一般认为,运动对心肌代谢的保护作用部分是通过GLUT4 的上调实现的(许瀚 等,2020;Lehnen et al.,2010; Schaun et al.,2017)。本研究中,12 周跑台训练诱导db/db小鼠心肌GLUT4 的蛋白水平上调。然而,对照组小鼠心肌GLUT4 的表达并未因运动发生变化,且这与以往的发现相一致(Osborn et al.,1997)。对上述结果的分析认为,这可能是由于对照组小鼠的GLUT4 水平已经处于正常范围,因此不会因运动训练而进一步上调。此外,还有一种可能的原因——由于对照组小鼠的运动能力较高,因此同样的运动刺激不足以诱导其心肌GLUT4 水平发生变化。
2 型糖尿病动物模型往往表现为心肌脂肪酸摄取、氧化增加,一般认为这主要是由血清脂肪酸、甘油三酯水平升高,以及PPARα 活动增强所致(Bugger et al.,2014)。PPARs 是核脂质激活受体,调控脂质代谢通路的诸多基因(Francis et al.,2003)。在PPARs 的3 种亚型中,PPARα 在肝脏、心脏和骨骼肌中高度表达,并通过转录调控脂肪酸代谢相关酶调节脂质和能量稳态。目前,PPARα 在肥胖、高脂膳食(high-fat diet,HFD)等引起的肝脏病变(如非酒精性脂肪肝)中的作用已得到证实,然而鲜见其在心脏中的作用研究。此外,尽管基于转基因模型的研究认为PPARα 过表达可模拟糖尿病心肌病变(Finck et al.,2003),然而也有证据显示,有些研究中糖尿病大鼠心肌可见PPARα 表达升高(Lee et al.,2010)。上述矛盾结果的产生可能与模式鼠所处的糖尿病阶段不同有关。Saunders 等(2008)认为,糖尿病早期可见心肌PPARα 表达上调,所致的脂肪酸氧化增强有利于维持心肌能量代谢。然而,在糖尿病晚期,心肌细胞对脂肪酸的过量摄取导致PPARα表达下调,同时PPAR-γ 表达上调,从而导致心肌细胞脂毒性加重。本研究发现,19 周龄db/db小鼠心肌PPARα 表达显著上调。此外,在对PPARα 靶基因[FAT、CD36、FABP和肌肉CPT1 等]的表达水平做进一步检测发现,此阶段db/db小鼠心肌CD36、PGC-1β 和Fabp3 的mRNA 表达均显著上调,且12 周跑台训练能降低db/db小鼠PPARα 和CD36的表达,这表明PPARα 信号通路参与运动训练对db/db小鼠心肌代谢紊乱的改善作用。此外,相关性分析的结果也佐证了PPARα 对脂质代谢的正调控作用。
作为导致糖尿病心肌病变的另一重要因素,胰岛素信号通路受损在本研究中也表现明显,其中,db/db小鼠心肌AKT 磷酸化受到抑制。此外,12 周跑台训练显著改善了p-β-IR、p-IRS1 和p-AKT 的表达,表明有氧训练保护并改善糖尿病心肌受损的胰岛素信号通路。在调控胰岛素信号通路的一系列因子中,MG53 是近年备受关注。已有证据显示,MG53 参与一系列生理、病理过程,包括心肌和骨骼肌膜修复、心肌缺血预适应以及调控胰岛素敏感性等(Zhang et al.,2016)。然而,在体环境中MG53 是否参与介导胰岛素抵抗尚存争议。Song 等(2013)认为,db/db小鼠骨骼肌中可见MG53 表达上调,而Yi 等(2013)认为db/db小鼠MG53 表达与对照组未存在显著差别,对ob/ob小鼠及2 型糖尿病患者的骨骼肌样本进行检验,也未发现其MG53 的蛋白表达与各自对照组间存在显著差异。此外,尽管目前鲜见探索运动对MG53 影响的研究,但总体证据支持运动干预下调胰岛素抵抗骨骼肌中MG53 的表达。例如,8 周游泳运动能通过下调大鼠MG53 的mRNA 和蛋白表达分别改善HFD 及2 型糖尿病引起的骨骼肌胰岛素抵抗(唐艳婕 等,2014; Qi et al.,2016)。尽管如此,运动干预如何影响胰岛素抵抗心肌的MG53 表达尚无定论。本研究发现,db/db小鼠心肌MG53的mRNA 表达显著增加,且12 周运动干预能逆转此变化。然而,无论是糖尿病还是运动干预均未影响MG53 的蛋白水平。结合本研究中糖尿病和跑台运动对胰岛素抵抗的显著影响得出:在当前的实验设定下,MG53 未参与运动训练对db/db小鼠心肌胰岛素抵抗的改善作用。
综上所述,12 周跑台运动能显著改善db/db小鼠心肌底物代谢紊乱和胰岛素抵抗状态,且PPARα 信号通路在糖尿病心肌糖、脂代谢异常中具有重要作用。

