骨骼肌介导的运动神经保护效应:作用途径和分子机制
王少堃 ,王世强 , ,王一杰 ,郭凯林 ,胥祉涵
运动作为一种简便易行的非药物干预手段,惠及大脑及机体的多个器官。骨骼肌是机体运动系统的动力部分,传统上仅被认为是一种效应器官,在神经-体液的双重调节作用下通过收缩、牵拉骨骼带动肢体完成机体的动作执行。研究发现,骨骼肌还能够产生和分泌数百种生物活性分子,即肌细胞因子(myokines)。这些肌细胞因子以自分泌、旁分泌以及内分泌的方式,广泛参与调节机体的多种生理活动和病理过程(Kim et al.,2019)。肌细胞因子的发现,为探究骨骼肌与大脑之间的信息交流提供了重要基础。
由于受到血脑屏障(blood-brain barrier,BBB)的保护,大脑是一个相对独立的器官。作为运动诱导神经保护效应的关键性机制,运动状态下的骨骼肌收缩如何从外周对大脑产生效益仍缺乏系统研究。许多研究证实了骨骼肌在运动刺激下会产生并分泌多种肌细胞因子,这些肌细胞因子进入血液循环后以激素形式发挥生物学功能,其可透过BBB 作用于脑组织,产生促进神经发生、提高突触可塑性、增加脑血流量等一系列神经保护效应(Kim et al.,2019)。鉴于运动通过调控骨骼肌内分泌功能产生神经保护效应的机制,本研究探究运动时骨骼肌与大脑之间的其他分子联系,系统总结骨骼肌介导运动神经保护效应的作用途径和分子机制,从运动方式、运动强度和运动持续时间3 个方面进一步探讨促进脑健康的运动干预策略,旨在为运动神经保护效应的应用提供理论基础,为神经系统疾病的运动疗法提供更多可能性。
1 运动通过骨骼肌内分泌途径产生神经保护效应
1.1 脑源性神经营养因子
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养因子家族的一员,除在神经系统广泛表达外,骨骼肌也可表达和分泌BDNF,是目前研究成果相对较多的肌细胞因子(Kim et al.,2019)。
BDNF 与运动对神经系统疾病,如阿尔茨海默病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)和亨廷顿病(Huntington’s disease,HD)等的保护作用密切相关(任可欣,2021)。成熟的BDNF 能通过特异性结合位于神经细胞膜上的高亲和力酪氨酸激酶受体B(tyrosine kinase receptor B,Trk B),激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶B(protein kinase B,Akt)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及其下游的环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)、磷脂酶Cγ(phospholipase Cγ,PLCγ)及其下游的蛋白激酶C(protein kinase C,PKC)等信号转导通路,促进神经元生长、存活和树突发育,增强突触可塑性,从而增强认知功能,提 高 学 习 记忆与情 绪 调 控 能 力(Kowiański et al.,2018)。此外,BDNF 通过结合低亲和力p75 神经营养因子受体(p75 neurotrophin receptor,p75NTR)诱导神经元凋亡和树突萎缩,起到清除异常或突触可塑性受损的神经元的作用(Kowiański et al.,2018)。
运动可提高骨骼肌BDNF 的表达量,提高幅度与运动强度呈正相关,同时可以改善中枢神经系统的功能(宗博艺 等,2019)。运动还能够提高海马BDNF 的水平,促进海马细胞增殖,伴随海马体积增大,认知功能增强,可降低神经系统疾病的患病风险(Małczyńska et al.,2019)。由此推测,由于循环中完整的BDNF 可以通过一种高容量、可饱和的转运系统透过BBB 进入脑组织,骨骼肌来源的BDNF可能会对大脑产生效益(Małczyńska et al.,2019)。因此,尽管BDNF 主要在大脑产生,但运动诱导的神经保护效应至少可以部分解释为骨骼肌源性BDNF 的有益作用。
1.2 鸢尾素
鸢尾素(irisin)是2012 年发现的一种肌细胞因子,它在过氧化物酶体增殖物激活受体-γ 共激活因子-1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)的调控下,由含Ⅲ型纤连蛋白结构域蛋白5(fibronectin type III domain-containing protein 5,FNDC5)在合成后迅速被蛋白水解酶剪切修饰而成,随后分泌进入血液循环(Young et al.,2019)。作为运动敏感基因,正常生理状态下,骨骼肌PGC-1α 表达水平较低,但当受到运动刺激时,PGC-1α 的表达水平会迅速提高,同时显著提高FNDC5 和鸢尾素的表达水平(Jodeiri Farshbaf et al.,2021)。
研究发现,鸢尾素在调节脑内BDNF 的表达中发挥了重要作用。在海马体中,PGC-1α 结合雌激素受体α 后能上调FNDC5 和BDNF 的表达,敲除PGC-1α 基因会使FNDC5和BDNF 表达量均降低(Wrann et al.,2013)。在初级皮质神经元中,过表达FNDC5 能使BDNF 表达增加,若采用RNA 干扰对FNDC5 表达进行干扰,会引起BDNF 表达下降(Wrann et al.,2013)。外周鸢尾素具有激活其他组织中PGC-1α 基因的作用(Young et al.,2019)。因此,运动时骨骼肌产生的鸢尾素经血液循环透过BBB 进入脑组织,能激活PGC-1α/FNDC5/BDNF 通路,促进BDNF 表达。
除了调节BNDF 表达外,循环鸢尾素进入脑组织后,还参与维持神经元的功能稳态。鸢尾素通过激活信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路诱导神经元增殖,促进海马神经发生(Moon et al.,2013);通过激活Akt 和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)1/2 信号通路抑制炎症信号通路,减少大脑缺血情况下由氧化应激和炎症造成的神经元损伤(Li et al.,2017)。
研究发现,不同的运动强度会对外周鸢尾素水平产生不同的影响。在一次性急性跑台运动中,高强度运动(80%V˙O2max)可引起受试者外周鸢尾素水平升高,但低强度运动(40%V˙O2max)却不能使鸢尾素水平发生变化(Tsuchiya et al.,2014)。Löffler 等(2015)指出,急性大强度的运动能引起血清鸢尾素水平迅速、短暂升高,而长期的运动训练对血清鸢尾素水平没有显著影响。因此,一定的运动强度可能是调控骨骼肌鸢尾素表达进而产生运动神经保护效应的必要条件。
1.3 组织蛋白酶B
组织蛋白酶B(cathepsin B,CTSB)是一种蛋白水解酶。Moon 等(2016)发现,CTSB 是一种肌细胞因子,且与运动促进海马神经元的生长、存活以及空间记忆的形成密切相关。在Moon 等(2016)的体外实验中,将腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)激动剂AICAR 加入L6 成肌细胞培养基中以模拟运动效果,发现培养液中CTSB 水平升高;动物实验方面,运动可以诱导小鼠骨骼肌CTSB 基因的表达,提高血浆的CTSB 水平,同时增强海马BDNF 的表达和神经发生,提高空间记忆能力。敲除了骨骼肌CTSB 基因的小鼠在自愿运动后没有出现这种情况,并在被强迫游泳时表现出抑郁症状。当外周静脉注射重组CTSB 至CTSB 基因敲除小鼠体内15 min 后,血液和脑组织中CTSB 蛋白水平均明显提高,并引起BDNF mRNA 和蛋白水平的提高;在人体实验中,运动可提升受试者外周CTSB 水平,同时提高其记忆力。研究显示,运动时CTSB 促进海马神经元存活和迁移、增强突触可塑性,是通过多功能蛋白P11 依赖性机制上调海马BDNF 和双皮质激素(doublecortin,DCX)表达实现的(Moon et al.,2016)。综上所述,运动可通过激活骨骼肌AMPK 通路诱导CTSB表达,CTSB 经血液循环透过BBB 引起海马BDNF 和DCX水平提高,产生促进神经发生、增强学习记忆等神经保护效应。
1.4 胰岛素样生长因子1
胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)是胰岛素多肽家族的一员。IGF-1 在调节神经系统的结构与功能中发挥关键作用,并与运动改善神经系统疾病患者的认知功能和学习记忆能力密切相关(Lewitt et al.,2019)。
运动能刺激骨骼肌产生并分泌IGF-1,提升循环IGF-1水平(Kim et al.,2019)。IGF-1 水平的变化常伴有BDNF水平的变化,如1 型糖尿病患者血清IGF-1 和BDNF 的基础水平均低于正常个体,高强度间歇运动则能同时提高循环IGF-1 和脑组织BDNF 的水平(Żebrowska et al.,2018)。通过颈动脉注射IGF-1 会引起脑组织BDNF 水平的提高,而IGF-1 抗体或IGF-1 受体拮抗剂的中和作用则会抑制由运动诱导的海马BDNF 表达上调和神经元再生(于涛,2020)。研究显示,IGF-1 能通过激活海马MAPK 激酶(mitogen-activated protein kinase kinase,MEK)/ERK 和PI3K/Akt 通路诱导BDNF 表达和神经元增殖、分化,以发挥神经保护作用(Yuan et al.,2015)。
1.5 血管内皮生长因子
血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种血管生成调节因子,在诱导血管内皮细胞增殖、迁移和存活,提高血管通透性,促进血管再生中发挥重要作用(Fournier et al.,2012)。运动能诱导骨骼肌产生和分泌VEGF,同时引起海马VEGF 水平升高和神经元增殖。特异性敲除小鼠骨骼肌VEGF 基因或用静脉注射携带嵌合型VEGFR1 受体的腺相关病毒载体(adeno-associated virus,AAV)阻断循环VEGF 的信号转导,会导致小鼠海马血流量减少,削弱运动对海马VEGF 水平提高和神经发生的诱导作用(Lee et al.,2021; Rich et al.,2017)。VEGF 可以通过与海马血管内皮细胞以及神经元前体细胞的受体胎肝激酶-1(fetal liver kinase-1,Flk-1)结合,激活MEK/ERK 和PI3K/Akt 等信号通路,调控血管内皮细胞增殖、分化、迁移和通透性的改变,促进大脑血管生成和神经发生(Fournier et al.,2012)。若抑制Flk-1 的表达,会损害海马突触可塑性和情感、记忆的巩固(De Rossi et al.,2016)。
可见,骨骼肌源性VEGF 是诱导大脑血管生成、促进神经元增殖和分化、提高突触可塑性的重要因子,是运动神经保护效应的关键介质。
1.6 成纤维细胞生长因子21
成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)是机体代谢稳态的关键调节因子。骨骼肌可通过激活mTOR 蛋白复合体1(mTOR complex 1,mTORC1)和Akt 通路调控FGF21 的表达,循环FGF21 能透过BBB,结合位于下丘脑的受体FGFR1,使共受体β-Klotho 与FGFR1 发生二聚化和自磷酸化(Guridi et al.,2015),从而调节机体的交感神经活动和昼夜节律(Bookout et al.,2013)。若特异性敲除脑组织中的β-Klotho 基因,FGF21 则无法发挥上述生理作用(Bookout et al.,2013)。动物研究表明,FGF21在脑中能通过改善外周胰岛素敏感性、增强海马可塑性、恢复脑线粒体功能和减少神经元凋亡,增强胰岛素抵抗肥胖大鼠的认知能力(Sa-Nguanmoo et al.,2016)。
虽然抗阻训练和高强度间歇训练均能引起骨骼肌FGF21 水平的显著提升(He et al.,2018),但有研究显示,除了运动刺激外,饥饿和胰岛素刺激也可上调骨骼肌FGF21 的表达,在线粒体肌病小鼠模型中,骨骼肌FGF21的表达水平亦显示提高(Keipert et al.,2014)。因此,尽管骨骼肌源性FGF21 能在中枢神经系统中发挥重要调节作用,但可能较多的是由除运动外的其他应激诱导的,未来需要进一步揭示运动如何通过调控骨骼肌FGF21 的表达产生神经保护效应。
1.7 肌源性脂肪细胞因子
1.7.1 瘦素
瘦素(leptin)是一种多肽类激素,许多神经系统疾病的发病过程涉及瘦素的代谢异常(Guo et al.,2017; Watanabe et al.,2021)。运动可使骨骼肌产生瘦素,运动后循环瘦素的水平显著提升(田振军 等,2013)。中枢神经系统存在大量瘦素受体,循环瘦素可通过BBB 上的LepRa 受体可饱和转运机制或者脑脊液进入中枢神经系统,与相应受体结合后参与大脑生理功能的调节(Schulz et al.,2010)。瘦素通过与位于下丘脑的受体LepRb 结合,激活Janus 酪氨酸激酶2(Janus family tyrosine kinases-2,JAK2)/STAT3、PI3K 和ERK1/2 通路,调控机体能量平衡和代谢稳态(彭瑾 等,2021);与海马神经元上的受体结合,激活JAK2/STAT3 和PI3K/Akt 通路,促进神经祖细胞增殖和海马神经发生,调节突触功能,提高情绪调控和学习记忆能力(Garza et al.,2012)。瘦素还可通过激活AMPK 和PGC/过氧化物酶体增殖活化受体(peroxisome proliferators-activated receptors,PPAR)通路,改善神经元线粒体功能,增强神经元存活,减少神经元凋亡(程瑾 等,2014)。
1.7.2 脂联素
脂联素(adiponectin,ADN)是一种生物活性多肽,参与了神经系统疾病的发病机制(张小曼 等,2012)。运动能够诱导骨骼肌产生ADN,ADN 透过BBB 进入脑组织后,通过与海马体上的受体ADNR1结合,激活ADNR1/AMPK通路,发挥促进神经元增殖和神经发生的作用(Yau et al.,2014)。ADN 还能通过AMPK 途径降低ROS 水平以减少神经元凋亡,并促进脑血管内皮细胞产生一氧化氮,使脑血管发生扩张,提高脑血流量(Qiu et al.,2011)。ADN基因敲除会削弱运动对海马神经发生的诱导能力(Qiu et al.,2011)。
综上所述,瘦素和ADN 与神经系统疾病密切相关。运动可刺激骨骼肌产生并分泌瘦素和ADN,瘦素和ADN进入脑组织后能发挥一系列神经保护作用,其有望成为治疗神经系统疾病的新靶点。
运动通过骨骼肌内分泌途径产生神经保护效应的机制如图1 所示。
2 运动通过骨骼肌能量代谢途径产生神经保护效应
2.1 乳酸
乳酸是常见的能量代谢产物,其可借助单羧酸转运蛋白(monocarboxylate transporters,MCTs)透过BBB 进入脑组织(El Hayek et al.,2019),发挥以下神经保护作用:1)乳酸可激活神经元中的N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体及其下游ERK 信号通路,刺激突触可塑性相关基因的表达,促进长时程增强和记忆的形成(Yang et al.,2014)。2)乳酸可通过结合BBB 上的羟基羧酸受体1(hydroxycarboxylic acid receptor 1,HCAR1)促进脑内VEGF 的表达和血管再生,敲除了HCAR1 基因的小鼠在运动后没有出现这种情况(Morland et al.,2017)。乳酸结合HCAR1 后,还能抑制腺苷酸环化酶活性,降低海马cAMP 水平,有助于缓解认知功能障碍(Morland et al.,2015)。3)乳酸可提高神经元BDNF 的表达水平,增强认知功能。在El Hayek 等(2019)的动物实验中,将乳酸注射至小鼠腹腔,会引起海马BDNF 和Trk B 水平的提高,同时增强小鼠的学习记忆能力。若用MCT 抑制剂阻碍外周乳酸进入脑组织,运动后小鼠脑中BDNF 的表达水平不会升高。进一步研究显示,乳酸对脑内BDNF 的调控作用是通过NAD+依赖的组蛋白去乙酰化酶沉默信息调节因子1(sirtuin 1,SIRT1)介导的,运动和腹腔注射乳酸均可引起海 马SIRT1 表 达 增 加,SIRT1 通 过 激 活PGC-1α/FNDC5/BDNF 通路来提高脑内BDNF 的水平(Müller et al.,2020)。
综上所述,运动时骨骼肌通过无氧代谢产生的乳酸在进入血液循环后,可透过BBB 作用于大脑,上调BDNF 和VEGF 的表达,从而增强神经可塑性,提高血管再生能力,改善认知功能。
2.2 α-酮戊二酸
α-酮戊二酸是一种能量代谢中间产物,运动时骨骼肌中的三羧酸循环和谷氨酸脱氨基反应均可产生大量的α-酮戊二酸。α-酮戊二酸能通过调节TET 蛋白的酶活性来影响中枢神经系统的结构与功能(Lio et al.,2019)。TET蛋白是一类依赖于α-酮戊二酸和二价铁离子起催化作用的双加氧酶,通过参与调节DNA 甲基化和DNA 去甲基化之间的动态平衡,在机体的生长、发育和衰老过程中发挥至关重要的作用。TET 可通过调控神经发育相关基因中5-羟甲基胞嘧啶(5-hydroxymethylcytosine,5hmC)的含量来影响大脑的发育(Li et al.,2014)。TET 基因敲除的小鼠神经元活性基因失调,出现神经元凋亡和突触可塑性严重受损的情况(Rudenko et al.,2013)。TET 还能催化脑内BDNF 基因启动子上的5-甲基胞嘧啶(5-methylcytosine,5mC)生成5hmC,引起DNA 去甲基化,促使BDNF 基因表达(Ambigapathy et al.,2015)。TET 基因缺失会导致海马神经元生成受到抑制,空间记忆和认知能力受损(Rudenko et al.,2013)。
TET 发挥作用的酶活性受到α-酮戊二酸水平的影响(Lio et al.,2019)。运动可通过提高骨骼肌α-酮戊二酸的水平增加TET 活性,促进BDNF 表达和海马神经发生,从而促进大脑发育,增强认知功能和学习记忆(Yuan et al.,2020)。
运动通过骨骼肌能量代谢途径产生神经保护效应的机制如图2 所示。

图2 运动通过骨骼肌能量代谢途径产生神经保护效应Figure 2.Exercise Induces Neuroprotective Effects through Skeletal Muscle Energy Metabolism
3 运动通过骨骼肌抗炎途径产生神经保护效应
神经炎症是指在中枢神经系统中发生的局部炎症,神经炎症功能紊乱会引起认知功能障碍,诱发神经系统疾病。外周炎症可通过多种机制破坏BBB 的正常功能,从而使外周炎症细胞和促炎细胞因子易于通过BBB 或淋巴管进入脑组织,导致神经炎症的发生和发展(黄晓雯 等,2021)。运动可通过诱导骨骼肌产生外周抗炎效应来缓解神经炎症,进而改善神经系统疾病。
3.1 运动通过调控骨骼肌IL-6 表达发挥抗炎作用
运动能够通过调控多种肌细胞因子的表达参与机体免疫功能的调节过程,以白细胞介素-6(interleukin-6,IL-6)最具代表性。IL-6 作为一种促炎细胞因子参与了神经炎症反应,并与多种神经系统疾病的发病过程密切相关(刘秋燕 等,2019)。
研究发现,静息状态时人体骨骼肌IL-6 处于非常低的水平,急性运动可使循环IL-6 水平呈指数型升高,运动结束时或不久后能达到近基础水平100 倍的峰值(Pedersen,2013)。急性运动诱导IL-6 的骤升,能触发外周抗炎级联反应,促进抗炎细胞因子(如IL-1ra 和IL-10)的产生,抑制IL-1α、IL-1β 和TNF-α 等促炎细胞因子的释放,降低机体的氧化应激(章岚 等,2014)。慢性运动对骨骼肌IL-6 的调控有所不同。流行病学研究显示,体力活动水平与循环IL-6 的基础水平呈负相关(Sponder et al.,2017)。耐力训练会降低IL-6 基础水平,也会降低急性运动引起骨骼肌IL-6 水平升高的幅度,却上调了IL-6R 受体的表达,据此推测耐力运动使得骨骼肌对IL-6 的分泌产生适应(Sponder et al.,2017)。
综上所述,不同类型的运动可作用于IL-6 的不同方面,从而改善机体的炎症状态。急性运动刺激骨骼肌释放大量的IL-6,可引发外周抗炎效应,间接缓解神经炎症;慢性运动可使骨骼肌对IL-6 产生适应,降低IL-6 基础水平,阻碍其进入脑组织。
3.2 运动通过调控犬尿氨酸代谢过程发挥抗炎作用
色氨酸是一种必需氨基酸,通常在肝脏中代谢为犬尿氨酸(kynurenine,KYN)。KYN 有2 条代谢途径:一条是大部分的KYN 代谢为3-羟基犬尿氨酸(3-hydroxykynurenine,3-HKYN),并进一步代谢为喹啉酸(quinolinic acid,QA);另一条途径是代谢为犬尿喹啉酸(kynurenic acid,KYNA)。QA 极具神经毒性,能通过诱发神经元损伤引起神经功能退行性改变(秦宇 等,2020)。KYNA 能够对抗QA 产生的神经毒性作用。KYN 向KYNA 的转化,是由犬尿氨酸氨基转移酶(kynurenine aminotransferase,KAT)催化的(秦宇 等,2020)。正常情况下,KYN 和KYNA 维持着动态平衡。当机体处于炎症或应激状态时,促炎细胞因子可促使KYN 向QA 方向代谢,损害BBB 的完整性,导致外周QA易于进入脑组织。因此,KYN代谢通路被认为是连接神经炎症与神经系统疾病的主要途径(Agudelo et al.,2014)。
运动能通过激活骨骼肌PGC-1α/PPARα/δ 通路上调KAT 表达,循环KAT 水平的提高促使外周组织中的能借助L 型 氨 基 酸 转 运 蛋 白1(L-type aminoacid transporter 1,LAT1)轻松透过BBB 的KYN 代谢为不能透过BBB 的KYNA,缓解神经炎症(Agudelo et al.,2014)。KYNA 还可通过激活G 蛋白偶联受体35(G protein coupled receptor 35,GPR35)刺激脂肪组织中抗炎基因的表达,减少外周炎症反应,降低病理性谷氨酸的水平以发挥保护BBB 的作用,维持神经系统微环境的稳态(Fallarini et al.,2010)。
可见,运动刺激下的骨骼肌可作为抗炎器官为机体创造良好的抗炎环境,通过调控IL-6 表达和KYN 代谢过程缓解外周和神经炎症,降低神经毒害作用,进而减少认知功能损伤,预防和改善神经系统疾病(图3)。
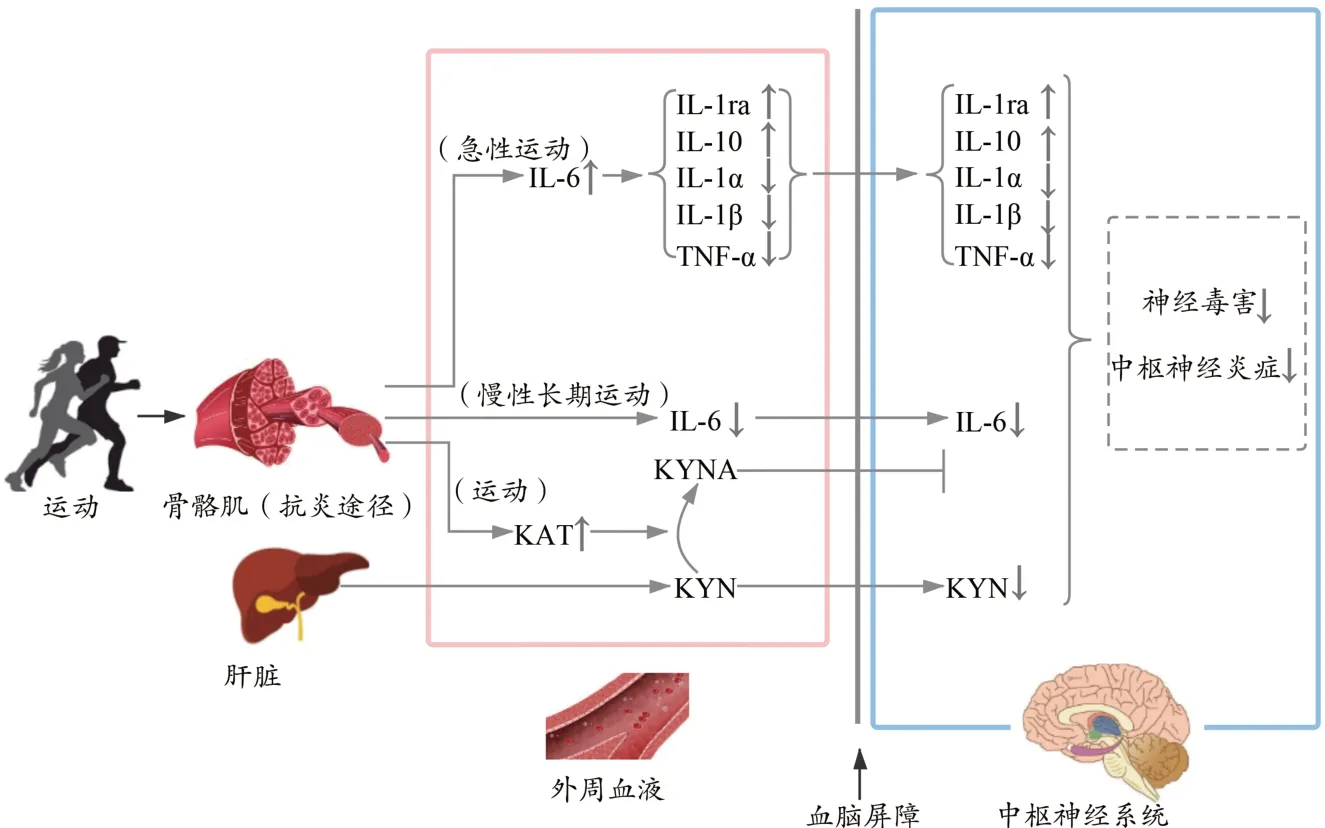
图3 运动通过骨骼肌抗炎途径产生神经保护效应Figure 3.Exercise Induces Neuroprotective Effect through Skeletal Muscle Anti-inflammatory Pathway
4 骨骼肌介导的运动神经保护效应途径及基于该途径的运动干预策略
4.1 骨骼肌介导的运动神经保护效应途径
基于以上分析,骨骼肌介导运动神经保护效应有以下3 条途径:1)运动通过调控骨骼肌内分泌功能上调肌细胞因子相关基因的表达,肌细胞因子以激素的形式作用于脑组织,产生神经保护效应;2)运动可促进骨骼肌能量代谢,代谢产物乳酸和α-酮戊二酸可进入中枢神经系统,产生神经保护效应;3)运动可诱导骨骼肌外周抗炎效应,缓解神经炎症。这3 条途径均显示骨骼肌在运动神经保护效应中发挥了重要的介导作用。在这3 条途径中,存在对运动具有敏感性的骨骼肌基因或蛋白(如PGC-1α、AMPK 等),作为该途径的启动者,通过调控目的基因的表达和代谢产物的合成,从外周向脑组织传递神经保护性调节信号,从而改善神经系统疾病(图4)。

图4 骨骼肌介导的运动神经保护效应途径Figure 4.The Pathways of the Skeletal Muscle Mediated Exercise-Induced Neuroprotective Effects
4.2 骨骼肌介导的神经保护效应运动干预策略
4.2.1 运动方式
有氧运动与抗阻运动是临床上常见的2 种促进脑健康的运动方式。有氧运动被广泛证实具有促进骨骼肌分泌细胞因子、改善认知记忆相关脑区结构与功能、延缓认知衰退的作用(Kwon et al.,2020)。规律性的有氧运动还能有效改善机体慢性炎症状态,降低神经系统疾病的患病风险(周永战 等,2019);抗阻运动可对炎症进行有效干预,相较于有氧运动,其是改善由肥胖和肌肉丢失导致的慢性炎症的较佳运动方式(徐唯,2016)。抗阻运动能够明显地诱导神经肌肉适应,增加骨骼肌的肥厚程度,提高骨骼肌基础代谢率,预防骨骼肌萎缩,从而对骨骼肌功能和大脑认知等产生效益(Chow et al.,2021)。研究发现,将有氧运动与抗阻运动相结合,无论是对于机体炎症反应(徐唯,2016)、骨骼肌能量代谢(田野 等,2015)还是大脑认知(Sumińska,2021),其干预效果均比单一运动方式更佳。因此,将有氧运动与抗阻运动相结合,可为神经保护效应运动干预策略的临床应用提供更多新思路。
4.2.2 运动强度
运动强度是制定运动干预策略的关键要素,不同的运动强度表现出不同的干预效果。相较于低强度运动,中等强度和高强度运动能显著提高血清BDNF、IGF-1 等肌细胞因子的水平,改善认知功能和学习记忆能力(Fernández-Rodríguez et al.,2021; Jeon et al.,2017)。在许多神经系统疾病的运动干预中,中等强度和高强度运动显示出比低强度运动更明显的改善效果(Balchin et al.,2016)。从骨骼肌能量代谢的角度来说,运动负荷越高,机体血乳酸水平越高,产生的神经保护效应更加持久。研究证实,单次高强度间歇训练能使血乳酸水平和循环BDNF、VEGF水平显著提高;长期高强度间歇训练有利于改善脑血管功能,提高认知和记忆能力(胡静芸 等,2021;宗博艺 等,2021)。此外,高强度间歇训练和中等强度持续训练均能激活IL-6 抗炎效应,提高外周抗炎细胞因子的水平,降低机体的氧化应激和炎症反应(Hoekstra et al.,2017)。可见,中等强度和高强度的运动在骨骼肌介导的神经保护效应中能够发挥更好的诱导作用。
4.2.3 运动持续时间
在骨骼肌介导的运动神经保护效应中,无论是内分泌、能量代谢还是抗炎途径,均通过骨骼肌产生的生物分子向脑组织传递调节信号来实现。研究证实,运动后这些生物分子的外周水平会依次呈现出升高、到达峰值、降低的总体变化趋势(He et al.,2018)。因此,若想获得长久的运动神经保护效应,应通过长期的骨骼肌活动使有益的外周生物分子处于较高水平。事实上,许多研究表明,相较于短时间的运动,长时间的运动对延缓认知衰退、提高学习记忆等具有更好的效果(张连成 等,2020)。
综上所述,长时间、中高强度、有氧与抗阻相结合的运动,可能会最大限度地发挥骨骼肌介导的神经保护效应。由于技术上的限制,目前大多数相关研究是在动物模型和体外系统中进行的,临床证据相对缺乏,较多的流行病学和临床关注运动对大脑结构和功能产生的直接影响。未来需进一步明确不同的运动方式、运动强度、运动持续时间和频率等对骨骼肌内分泌、能量代谢和抗炎功能的影响及其与脑健康之间的联系,综合考虑年龄、性别、疾病和遗传等影响因素,探索针对不同人群的个性化运动干预策略。
5 总结与展望
5.1 总结
运动不仅是促进认知功能、提高学习记忆和情绪调控能力的有效方式,更是预防和改善神经系统疾病的重要手段。本研究以“运动-骨骼肌-大脑”为主线,系统地总结运动通过骨骼肌产生神经保护效应的3 条途径和分子机制,指出长时间、中高强度、有氧与抗阻相结合的运动是促进脑健康的有效干预策略。
5.2 展望
虽然国内外相关研究为骨骼肌介导运动神经保护效应提供了依据,但仍然存在一些问题:1)蛋白质组学研究发现,骨骼肌能合成并分泌数百种肌细胞因子,现有对肌细胞因子的认识和研究可能只是“冰山一角”,未来还需进一步筛选其他能够参与介导运动神经保护效应的肌细胞因子,并探索其相应受体;2)由于人体是一个有机整体,运动刺激骨骼肌产生的生物活性分子是否通过作用于机体的其他组织调节其靶向大脑的相关因子活性从而改善大脑功能,仍需进一步研究;3)目前对于运动通过骨骼肌诱导神经保护效应的炎症机制知之甚少,随着脑膜淋巴管的发现,今后需更加深层次地揭示外周炎症与神经系统疾病的联系。

