全雄黄颡鱼红头病病原菌的分离鉴定
马士杰,郭锦志,魏娇,付立霞
(扬州大学动物科学与技术学院,江苏 扬州 225009)
黄颡鱼(Pelteobagrus fulvidraco)在分类上隶属鲇形目、鲿科、黄颡鱼属,又名昂刺鱼、黄辣丁、黄姑鱼,生存水温为0~38 ℃,最适宜的生长水温为22~28 ℃,多栖息于缓流多水草的湖周浅水区和入湖河流处,营底栖生活,尤其喜欢生活在静水或缓流的浅滩处以及腐殖质多和游泥多的地方。杂食性,自然条件下以动物性饲料为主,鱼苗阶段以浮游动物为食,成鱼则以昆虫及其幼虫、小鱼虾、螺蚌等为食,也吞食植物碎屑。分布于老挝、越南、中国、朝鲜、俄罗斯西伯利亚东南部,在中国分布于珠江、闽江、湘江、长江、黄河、海河、松花江及黑龙江等水系。其营养丰富,味道鲜美,是我国常见的一种淡水名优养殖鱼类[1]。普通黄颡鱼产量低,个头小,品质参差不齐,难以满足市场需求,且鲿科鱼类雄性要比雌性鱼生长速度快很多,倘若增加雄鱼的占比,则可以大大增加养殖效益,于是一种通过性逆转与雌核发育的方法产出的全雄黄颡鱼问世了[2]。研究表明,这种全雄黄颡鱼无论是养殖产量、出塘规格还是养殖效益、营养价值,均远高于普通的黄颡鱼[3]。
在黄颡鱼的养殖过程中,常出现一种季节性的流行性细菌疾病。病鱼腹部膨大,鱼体各部位有不同程度的充血,头顶部位出现红点状溃烂,严重时头顶部开裂并有出血带,呈现典型的“红头”症状,常被称为“红头病”。该病高发于春季和秋季,主要危害黄颡鱼种或成鱼。红头病蔓延速度快,致死率高,防治困难,常给殖户造成严重的经济损失[4]。
研究发现,导致不同养殖区域黄颡鱼发病的致病菌有所不同,分别为迟缓爱德华菌(Edwardsiella tarda)、爱德华菌(Edwardsiella ictaluri)或同属的爱德华菌亚种[4-5]。现以患红头病的全雄黄颡鱼为研究对象,从其病灶处分离纯化得到病原菌,通过形态、生理生化特征、16S rRNA 等方面鉴定,以及药敏和斑马鱼人工感染试验,分析其药敏特性及致病性,以期为全雄黄颡鱼“红头病”的防治提供参考。
1 材料与方法
1.1 样品、菌种来源
全雄黄颡鱼购自高邮董氏特种水产养殖公司,体长为(14±1)cm,体质量为(54±5)g;斑马鱼购自广东省惠州市惠城区球记养殖场,体长为(3.5±0.5)cm,体质量为(0.6±0.1)g。从患病全雄黄颡鱼病灶处分离纯化得到受德华菌株YCH;杀鱼爱德华菌SHK 和SHL、迟缓爱德华菌ET-1 和ET-13 来自实验室保存。
1.2 试剂和仪器
LB 肉汤(LB)、脑心浸出液肉汤(BHI)、胰蛋白胨大豆肉汤(TSB)、SS 琼脂(SS)由北京陆桥技术股份有限公司提供;革兰染色液、细菌微量生化反应管及药敏纸片由杭州滨和微生物试剂有限公司提供;基因组提取试剂盒TIANamp Bacteria DNA Kit、胶回收试剂盒TIANgel Mini Purification Kit 由天根生化科技(北京)有限公司提供;Premix Taq(plus dye)、DNA A-Tailing Kit、pMD 19-T Vector Cloning Kit、Prime STAR HS (Premix)、DL 2000 DNA Marker 和DL 5000 DNA Marker 由宝日医生物技术(北京)有限公司提供;所有引物(表1)由生工生物工程(上海)股份有限公司合成;麻醉剂MS-222由美国默克公司提供。主要仪器设备有无菌操作台(苏州净化设备有限公司)、电泳仪(北京六一生物科技有限公司)、PCR 仪伯乐生命医学产品(上海)有限公司。

表1 引物及其序列①
1.3 菌种的分离及纯化
从实验室选取病症较为典型的濒死黄颡鱼,用75%乙醇对其体表消毒,无菌剖检。用接种环取其头部溃烂处及肝脏、肾脏组织,于BHI 平板上划线,放入28 ℃培养箱培养48 h。选取平板上大小、形状、色泽一致的优势单个菌落,接种到5 mL的BHI 液体培养基中,放入28 ℃摇床于170 r/min过夜振荡培养活化。次日待试管内液体培养基浑浊,用接种环蘸取适量菌液,再次于BHI 平板上划线,选取大小、形状、色泽一致的优势单个菌落,进行反复划线培养,直至获得纯培养。取部分菌液装入离心管,于8 000 r/min 离心15 min,加入无菌磷酸盐缓冲液(PBS)清洗、吹打,使菌液与PBS 充分接触,将清洗后的菌液以1∶1 的比例与30%的BHI 甘油混合,充分涡旋封口,于-80 ℃保存备用。
1.4 YCH 菌体特征及生理生化
1.5 16S rRNA 序列分析
采用TIANGEN 小提基因组试剂盒,提取YCH的基因组,提取步骤参照说明书。将提取好的基因组作为模板,利用引物27 F/1492 R 进行PCR 扩增。反应体系50 μL,正反向引物各1 μL,模板2 μL,Premix Taq 酶25 μL,ddH2O 21 μL。PCR 反应程序如下:95 ℃预变性5 min;95 ℃变性30 s、58 ℃退火30 s,72 ℃延伸2 min,循环30 次;72 ℃再延伸5 min;于4 ℃保存。
待PCR 反应结束后于1%琼脂糖凝胶中进行电泳,再于紫外灯分析仪下对凝胶进行切胶回收所需目的片段,连接pMD19-T Vector 载体,并转化入大肠杆菌,挑选阳性菌落,提取质粒送生工生物工程(上海)股份有限公司进行序列测定。将测序得到的序列与NCBI 数据库中细菌基因序列进行分析比对,筛选相关性最高的细菌序列,通过MEGA11 中的Align组件进行序列排列后,采用邻接法(Neighbor-Join Method)构建系统发育树,并通过自举法(Bootstrap)进行可信度检验,自举时重复次数设置为1 000。
1.6 药物敏感试验
采用Kirby-Bauer 纸片扩散法,对分离的优势菌株YCH 进行药敏试验,并参照说明书对数据分析。在超净工作台,将优势菌株YCH 接种至BHI液体培养基中,28 ℃振荡培养24 h 后,用无菌PBS洗涤并稀释调整至5×107~5×108CFU/mL;取100 μL菌悬液,用灭菌的涂布棒均匀地将菌液涂布于BHI平板上,用灭菌的镊子将药敏纸片贴附于培养基上,倒置于28 ℃恒温培养箱中培养48 h,测量药敏纸片的抑菌圈直径(mm)。根据杭州滨和微生物试剂有限公司提供的药敏判定标准,进行数据分析与结果判定。
1.7 人工感染试验
攻毒菌株YCH 接种于BHI 液体培养基,28 ℃、180 r/min 振荡培养至对数生长期后(OD600约为0.6),离心收集菌体,用pH 值为7.2~7.4 PBS 洗涤3 次,10 倍梯度稀释成5 种不同浓度(2.3×109,2.3×108,2.3×107,2.3×106和2.3×105CFU/mL)菌悬液备用,同时进行平板计数,以获得更为精确的菌液浓度。
试验共设置6 组,分别为1 个空白对照组和5 个试验组,将健康的斑马鱼暂养7 d 后,每组20 尾,于规格相同的水族箱中。试验组分别注射上述5 种不同浓度的菌株YCH,对照组则注射无菌PBS。注射前,用质量浓度50 mg/L 的MS-222 麻醉剂将待注射鱼麻醉,防止注射时鱼体挣扎,导致机械损伤。攻毒方式为腹腔注射,注射剂量为20 μL。试验期间,对人工感染后的斑马鱼正常喂食,对养殖水体连续充气、换水,连续观察7 d,记录每日发病和死亡数量,并对感染发病斑马鱼再次进行细菌的分离鉴定(新分离出的菌株命名为YCH-2),最后根据Reed-Muench 公式[10]计算菌株YCH 对斑马鱼的半数致死量(LD50)。
1.8 特异性引物检测
使用特异性引物ESC-F、ESC-R,对YCH、YCH-2及爱德华其他菌属进行PCR 扩增鉴定[8]。PCR的反应条件为:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,78 ℃延伸5 min,循环30 次;72 ℃再延伸5 min;于4 ℃保存。
2 结果与分析
2.1 分离菌株的形态特征
从患病黄颡鱼体内分离获得1 株优势菌株,在BHI 培养基平板划线涂板于28 ℃培养箱培养,24 h 后可见生长缓慢的菌落,48 h 后可见菌落逐渐明显,呈圆形、透明或半透明,边缘整齐,灰白色或者无色的细小微凸起菌落,见图1(a);经革兰染色、1 000 倍油镜观察显示,分离菌株YCH 为革兰阴性菌,呈红色短杆状,见图1(b)。

图1 菌株YCH 的形态特征
2.2 16S rRNA 基因序列
以YCH 菌株基因组作为模板,经扩增得到的16S rRNA 片段大小约为1 466 bp(图2)。测序结果显示,YCH 菌株16S rRNA 扩增产物与Gen Bank 中爱德华菌的相似度高达99%,YCH 菌株16S rRNA 基因序列分子系统发育树显示,菌株YCH与爱德华菌为一支(图3)。
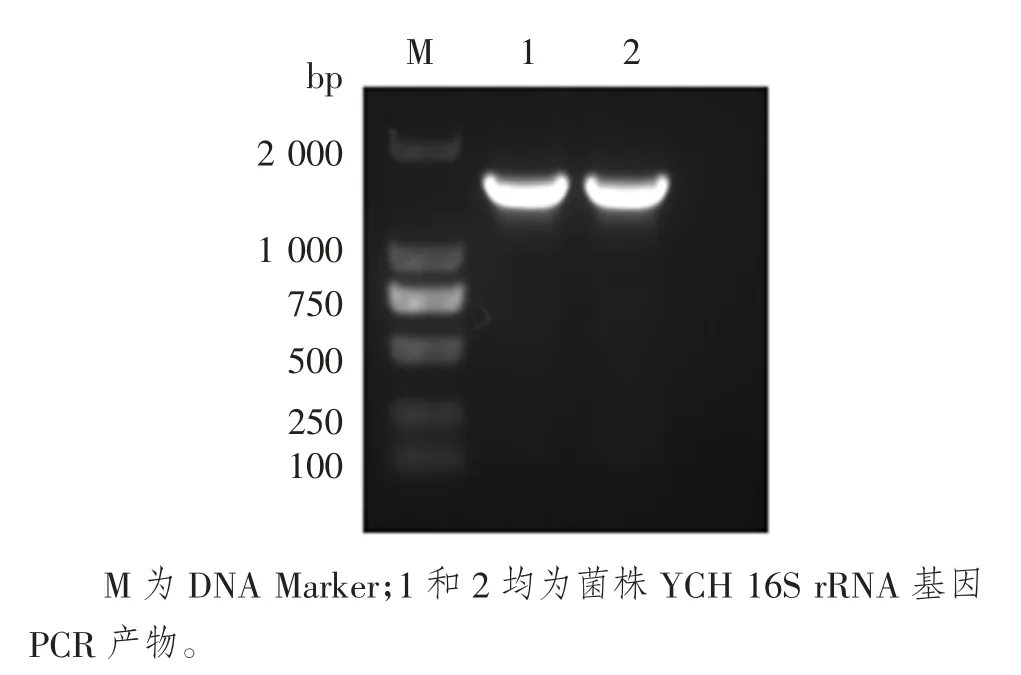
图2 16S rRNA 基因的PCR 产物
2.3 生理生化鉴定
通过系列微量生化反应管,对分离菌株YCH进行鉴定。结果显示,分离菌株YCH 与赖氨酸、葡萄糖、麦芽糖等试剂反应呈阳性,与精氨酸、枸橼酸盐、甘露醇、水杨素、硫化氢、七叶灵等试剂反应呈阴性(表2),与参照菌株爱德华菌JXHS 数据一致,与迟缓爱德华菌ATCC15947 的数据较为相似;菌株YCH 和参照菌株JXHS 的硫化氢为阴性,而迟缓爱德华菌ATCC15947 的硫化氢为阳性。
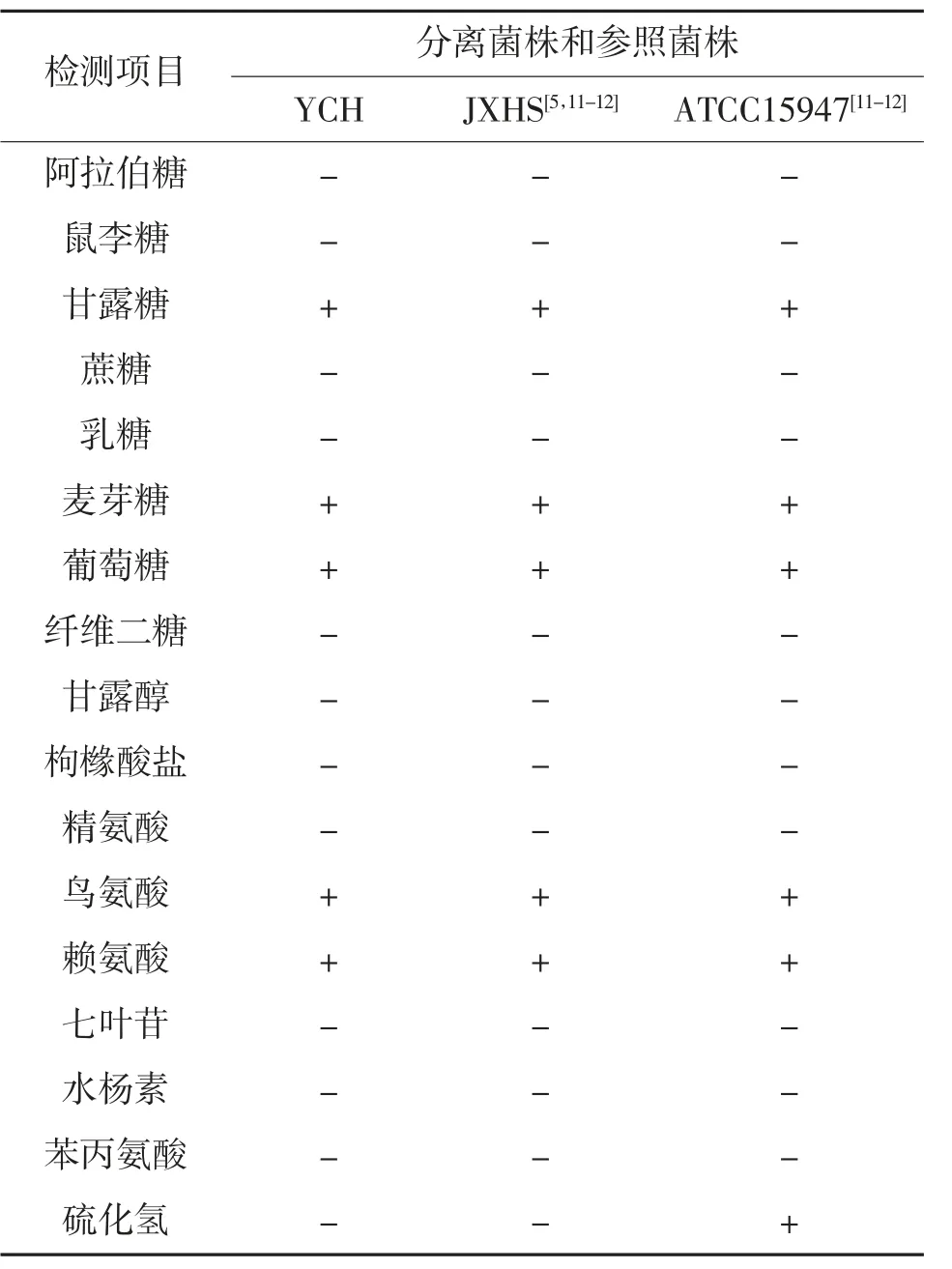
表2 菌株YCH 的生理生化特性①
2.4 药敏
菌株YCH 对35 种药物的敏感性见表3。由表3可见,菌株YCH 对红霉素、四环素、诺氟沙星、环丙沙星、氨曲南、头孢西丁、氧氟沙星和妥布霉素等8种药物耐药,对青霉素、克林霉素及卡那霉素中度敏感,而对其他24 种测试药物,包括苯唑西林、大观霉素、万古霉素、氯霉素、左氟沙星、多黏菌素B、头孢他啶、链霉素、呋喃妥因和头孢唑啉、头孢呋辛等则均为敏感。
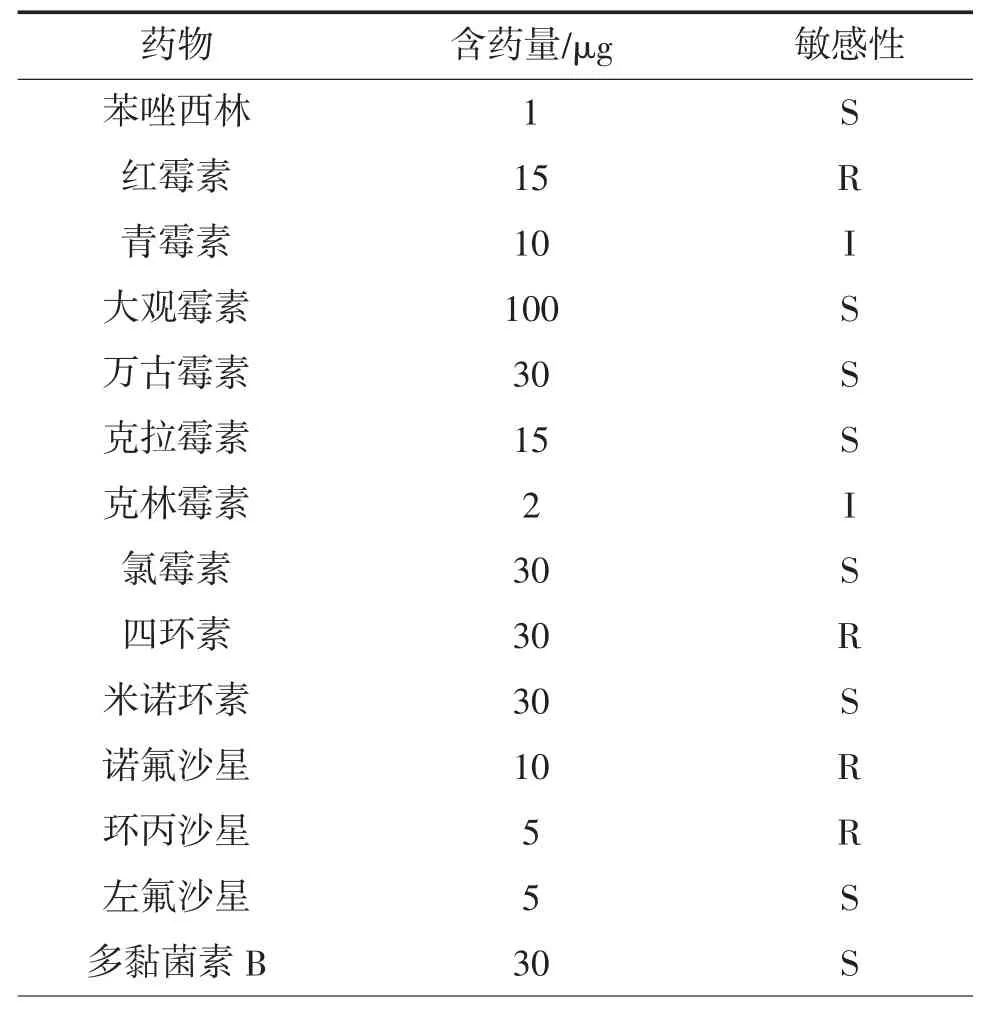
表3 菌株YCH 对35 种药物的敏感性①
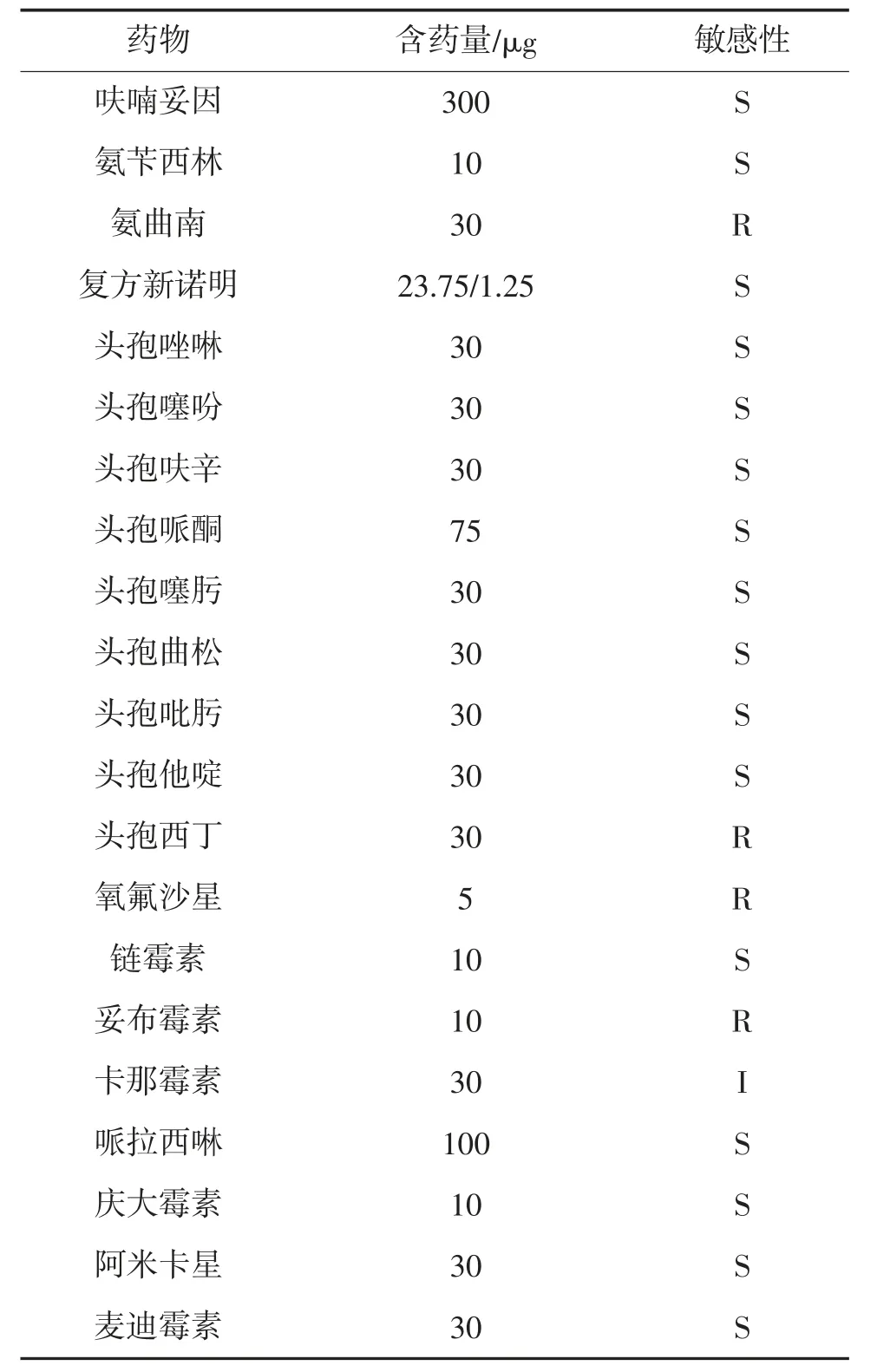
续表
2.5 人工感染后症状
人工感染健康的斑马鱼后,高浓度组注射1 d后就开始出现死亡,对照组未见异常。2~4 d 为各组发病死亡高峰期,被感染的斑马鱼出现与自然发病黄颡鱼相似的症状,鱼腹部鼓起并伴有腹水、体表充血、皮肤溃烂、眼球外突,虽未见头部裂开,但头部出现明显的肿胀突起(图4)。试验结束时,对照组斑马鱼没有出现死亡,试验组中菌株浓度为2.3×109和2.3×108CFU/mL 组死亡率最高,均为100%;其次是2.3×107CFU/mL 组,死亡率为68.4%;2.3×106和2.3×105CFU/mL 组死亡率较低,分别为7.4%和0。根据Reed-Muench 方法计算,菌株YCH 对斑马鱼的LD50为2.3×105CFU。从死亡病鱼体内能再次分离到细菌,且形态特征及理化特性等方面均与所述菌株YCH 完全一致。分离菌株YCH 对斑马鱼的人工感染试验结果见表4。
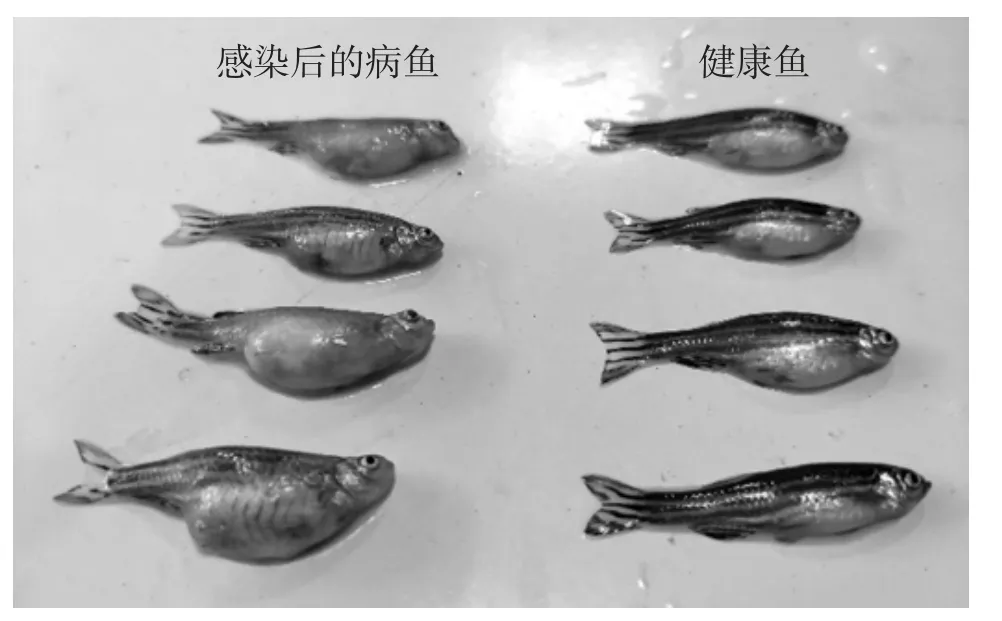
图4 健康斑马鱼和被感染后的病鱼对比
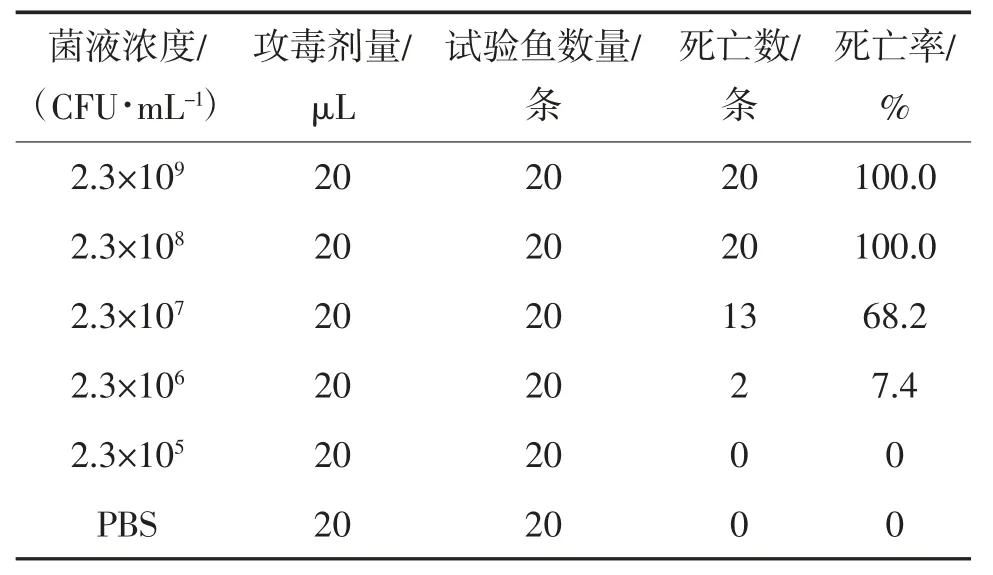
表4 分离菌株YCH 对斑马鱼的人工感染试验结果
2.6 特异性引物
特异性引物检测结果显示,从患红头病的全雄黄颡鱼体内分离的菌株YCH 及再次人工感染斑马鱼后分离所得菌株YCH-2,均可用ESC-F、ESC-R扩增出129 bp 的预期目的条带,而同组的其他菌株均未扩增出条带(图5)。
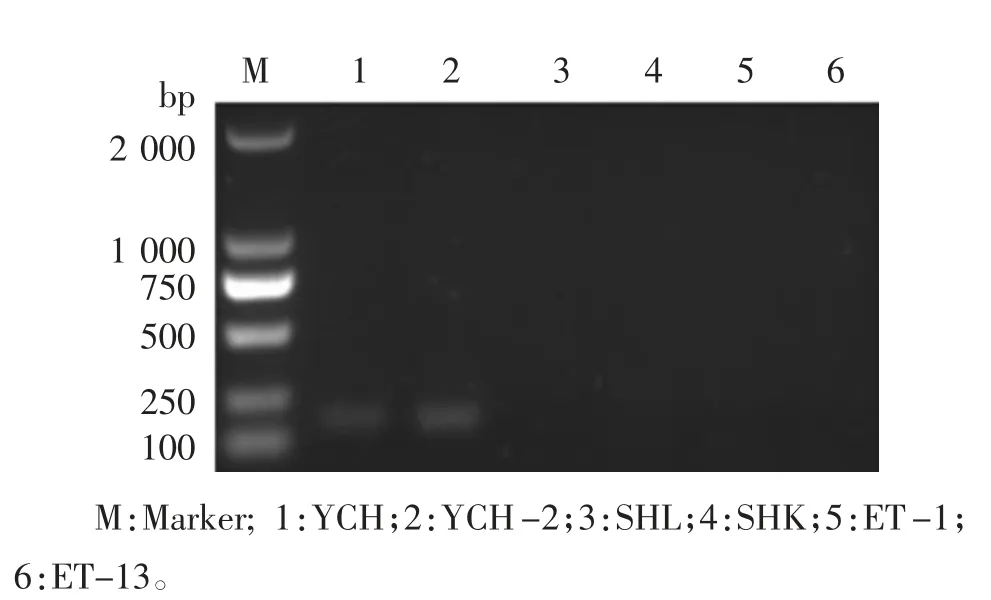
图5 种特异性引物对爱德华菌分离菌株的鉴别
3 讨论
黄颡鱼在规模化人工养殖中易感染各种疾病,导致头部发红的主要致病菌为爱德华菌。爱德华菌属分为爱德华菌、保科爱德华菌(Edwardsiella hoshinae)和迟缓爱德华菌,其中迟缓爱德华菌的分布和宿主范围比保科爱德华菌和爱德华菌更加广泛[13]。爱德华菌是导致鲇形目鱼类发病的一种常见致病菌,于1979 年在美国的斑点叉尾(Ictalurus punctatus)体内首次分离获得[14]。流行病学与病理特征分析发现,爱德华菌和迟缓爱德华菌导致的疾病分为急性型与慢性型,其中急性型发病速度快,会导致鱼体内脏功能衰退,若救治不及时,一周内就会导致大量死亡;慢性型则通常呈阶段性,初期发病鱼表征不明显,先出现体表不同程度的病变,随之摄食量减少;随病程发展,出现停食、头顶部充血、发红、溃烂等现象,并伴随体表溃烂、泄殖孔红肿充血,头部由最初的溃烂直至露出头骨及脑组织。
斑马鱼作为一种新型的脊椎模式生物,具有繁殖能力强、个体小、易养殖等诸多优点[15]。在毒性试验中有着非常有利的生物学特性,使其成为感染研究中重要的模型生物之一。刘春等[16]以斑马鱼为试验动物,研究与爱德华菌同属的迟缓爱德华菌的致病力并得到证实。Hawke 等[17]于2011 年在美国不同州实验室的斑马鱼体内,分离得到了爱德华菌。本试验认为,爱德华菌感染鲇形目鱼类比较多,从斑马鱼身上分离得到爱德华菌,且症状与黄颡鱼人工感染症状相似,感染的斑马鱼在1~2 周内快速死亡。在国内斑马鱼养殖场中,也在病鱼体内分离到了爱德华菌,回归感染致死率可达80%[18]。说明斑马鱼可作为爱德华菌毒性试验的模式动物,代替黄颡鱼做人工感染试验。
本研究从患有“红头病”的全雄黄颡鱼中,分离纯化获得优势菌体YCH。该菌株的形态特征、生理生化指标以及16S rRNA 的基因序列分析比对结果显示,菌体YCH 为爱德华菌。药敏试验结果显示,苯唑西林、大观霉素、左氟沙星、多黏菌素B、头孢他啶、链霉素和头孢呋辛等成分的药物对该病菌的生长有抑制作用,这对日后爱德华菌的防治及研究有着积极的推进作用。
本试验的药敏数据在实际生产中仅作参考,在水产养殖中,应选择合适的国标鱼药,同时,需注意用药量,避免产生耐药性。由于“红头病”的病灶通常位于鱼脑部,很多药物无法很好地直击病灶处,且爱德华菌在环境温度适宜的情况下暴发迅速,养殖户常常来不及反应而造成经济损失。因此,在养殖过程中,要注重饲料配比,适当添加维生素等微量元素,以增加鱼体抵抗力。同时要注重养殖水质,提升养殖水环境质量。疾病防治原则是以预防为主,防治结合。

