壮医针刺对神经病理性疼痛大鼠的镇痛作用及其机制研究
廖文彦,廖炼炼▲,莫巧明,艾文杰,邹文静,梁英业,兰蕾,秦祖杰,蒙晓明,张锦超,梁欣,唐林涛,田永强
(1.广西中医药大学附属国际壮医医院,广西南宁 530201;2.广西中医药大学第一附属医院,广西南宁 530023;3.广西中医药大学研究生学院,广西南宁 530001)
疼痛的发生十分广泛,被称为第五大生命体征,是一种在人体受到内外因素损害时极易引发的不适感。国际疼痛研究协会(IASP)对神经病理性疼痛(neuropathic pain,NPP)的最新定义为:由躯体感觉神经系统的损伤和疾病直接造成的疼痛[1]。NPP是一种常见的慢性疼痛类型[2],可由多种因素诱导发生,在中国[3]、美国[4]、欧洲[5]均有较高的发病率,不仅给患者躯体和心理两方面造成痛苦,产生了昂贵的医疗费用,还给患者造成工作效率低下等消极影响,带来了相当的经济损失[6]。现代医学常用的药物疗法仅能对NPP患者的部分症状具有一些缓解作用,且长期使用此类药物可带来不同程度的不良反应[7]。寻求治疗NPP的有效方法,解除患者身心痛苦,减轻社会医疗成本和经济负担的需求极为迫切,也是当今医学界研究的热点。传统医学疗法在疼痛的治疗上有其独特的优势,特别是外治疗法受到了众多学者的关注和研究[8-10],其中壮医针刺疗法对于疼痛治疗的有效性和安全性在临床上得到了广泛认可[11]。但对于壮医针刺疗法治疗疼痛的相关作用机制研究目前仍属空白。IKKβ是神经病理性疼痛病理生理机制中重要的关键因子[12],该因子与NPP的发生发展关系密切,其表达升高可引起下游炎症因子在体内含量增加,从而引起炎症反应刺激组织神经末梢造成疼痛。有研究发现miR-429对IKKβ的表达具有下调作用[13]。本研究从上述机制切入,以动物实验方法探索验证壮医针刺疗法治疗疼痛的分子生物学机制。
1 材料与方法
1.1 实验动物实验选取50只雄性成年SD大鼠(湖南斯莱克景达实验动物有限公司提供),体重均为250~300 g,生产许可证编号:SCXK(湘)2019-0004,使用许可证编号:SYXK(桂)2019-0001。动物进行7天适应性喂养后开始实验。实验全过程严格按照广西中医药大学相关规定及科学伦理规范进行,广西中医药大学实验动物伦理委员会对实验进行审批及监管。
1.2 主要试剂RIPA细胞裂解液(C1053,北京普利莱基因技术有限公司);BCA蛋白定量试剂盒(BCA Protein Assay Kit)(E-BC-K318-M,Elabscience);内参一抗:Mouse Anti-β-Actin(HC201,TransGen Biotech,1/2000);二抗:HRP conjugated Goat Anti-Mouse IgG (H+L) (GB23301,Servicebio,1/2000);目的一抗:Rabbit Anti IKKβ (AF6009,Affinity,1/1000)。Trizon Reagent(CW0580S,CWBIO);超纯RNA提取试剂盒(CW0581M,CWBIO);miRNA提取试剂盒(CW0627S,CWBIO);HiScript Ⅱ Q RT SuperMix for qPCR (+gDNA wiper)(R223-01,Vazyme);ChamQ Universal SYBR qPCR Master Mix(Q711-02,Vazyme);miRNA 1st Strand cDNA Synthesis Kit (by stem-loop)(MR101-02,Vazyme);miRNA Universal SYBR qPCR Master Mix(MQ101-02,Vazyme);50×TAE缓冲液(T1060,Solarbio);6×DNA Loading Buffer(GH101-01,TRANS);50 bp DNA Ladder(MD108,TIANGEN);Gsafe Red plus核酸染料(GK20002,GLPBIO);琼脂糖粉(75510-019,Invitrogen);ELISA检测试剂盒(武汉伊莱瑞特,96T,E-EL-R0012)。
1.3 实验仪器全自动样品快速研磨仪(Tiss-12,上海净信实业发展有限公司);高速台式冷冻离心机(H1750R,湖南湘仪实验室仪器开发有限公司);微型离心机(D1008E,SCJLOGEX);旋涡混合器(XH-C,常州越新仪器制造有限公司);全自动酶标仪(SuPerMax 3100,上海闪普);紫外分光光度仪(NP80,NanoPhotometer);电泳仪(DYY-8C,北京六一生物科技有限公司);普通PCR扩增仪(TC-EA,杭州博日科技有限公司);荧光PCR仪(CFX ConnectTM实时,伯乐生命医学产品〔上海〕有限公司);超高灵敏度化学发光成像系统仪(Chemi DocTM XRS+,伯乐生命医学产品〔上海〕有限公司)。
1.4 研究方法
1.4.1 动物分组将50只SD大鼠随机分为5组:正常组、假手术组、模型组、非经非穴组、壮医针刺组,每组10只。
1.4.2 神经病理性疼痛模型大鼠制备按照相关文献的方法[14],对大鼠L5脊神经进行手术结扎造模(SNL模型)。具体操作为:大鼠常规备皮消毒,以10%水合氯醛溶液按照4 mL/kg的给药量腹腔注射麻醉。选取大鼠双侧髂后上棘水平连线与脊柱相交处左侧部位,沿与脊柱平行方向纵行切开一约2 cm切口,将皮肤、筋膜、肌肉等逐层分离,并将切口撑开,使L5椎体横突充分暴露,以咬骨钳分离椎体与横突之间的骨质,使L5脊神经充分暴露,将该神经以5-0规格粗细手术缝线做双层结扎,以避免缝线脱落。完成结扎后缝合伤口。操作中应避免牵拉脊神经。模型组、非经非穴组、壮医针刺组以上述手术造模,假手术组则仅暴露脊神经几分钟,不结扎,其他步骤同上。完成手术操作后,观察大鼠是否出现术侧后肢外翻,趾间距变窄、跛行、自发性抬足、不敢着地等情况,并检测大鼠机械性刺激缩足阈值(PWMT)是否降低,以判断SNL模型是否造模成功。
1.4.3 行为学观察PWMT观测[8]:测试之前先将大鼠放入铁笼20 min适应。使用不同粗细规格的von-Frey纤维丝接触刺激大鼠左后足中央。纤维丝粗细代表不同刺激强度(g)。操作时刺激强度由小到大,每种强度下重复5次刺激,每次刺激之间间隔3 s。大鼠在同一刺激强度下出现缩足反应≥3次则记录为阳性,此强度为该大鼠的PWMT。本实验重复操作3次,取3次实验结果的平均值为大鼠最终PWMT。
1.4.4 干预方法造模完成后,正常组、假手术组和模型组不进行干预,仅观察。壮医针刺组:于造模完成后第1天开始,采用0.16 mm×13 mm针灸针进行针刺干预,针刺穴位包括手背一环10穴、内上桩、内中桩、内下桩、足背一环7穴。针刺深度3 mm,斜刺进针,留针30 min。穴位具体定位为:手背一环10穴定位,取大鼠前肢第五掌骨桡侧距掌指关节3 mm处。内上桩、内中桩、内下桩、足背一环7穴定位,在大鼠足背横纹中点至第二、第三足趾跖蹼缘上方纹头之间分4等份,以足背中间点为中心,以1等份为半径沿足背形状作一圆环。在足背圆环上按时钟的1~12时刻分成12等份,每时刻处为1个穴位,共12个穴位。连续干预14天。非经非穴组:于造模完成后第1天开始,每天针刺距离相应穴位3 mm处假穴位点,留针30 min。连续干预14天。
1.4.5 动物组织取材干预结束并完成行为学观测后,在实验进行的第14天,以水合氯醛腹腔注射麻醉大鼠,取静脉血并无痛处死,取出大鼠L4~6脊髓背角组织,迅速放入液氮罐,待冷却后保存于-80 ℃冰箱。
1.4.6 免疫印迹检测采用免疫印迹法(Western Blot)测定大鼠L4~6节段脊髓背角组织中蛋白含量水平。将大鼠击碎组织放入试管中,加入细胞裂解液,研磨匀浆后放入离心机离心,提取组织总蛋白,测定浓度。将标本放入电泳仪电泳,随后进行转膜,凝胶成像分析,测定出蛋白条带及内参蛋白条带灰度值,计算出蛋白的表达水平。
1.4.7 ELISA检测将大鼠静脉血离心提取血清,放入酶标仪按照ELISA检测试剂盒说明书步骤检测出血清表达水平。
1.4.8 PCR检测将大鼠L4~6节段脊髓背角组织裂解匀浆后运用荧光免疫PCR技术检测其miR-429表达水平。按照试剂说明书操作步骤提取RNA,使用紫外分光光度计测定样品浓度、纯度。电泳后进行逆转录反应,将PCR管插入普通PCR扩增仪中,50 ℃条件下保持15 min,然后转到85 ℃条件下保持5 s。采用(2-ΔΔct)法计算miR-429相对表达量,引物序列如表1。

表1 PCR检测引物序列

2 结 果
2.1 PWMT检测结果术前(第0天)各组大鼠之间的PWMT检测结果比较差异无统计学意义(P>0.05);术后第1天模型组、非经非穴组、壮医针刺组PWMT检测结果较正常组、假手术组降低(P<0.01),模型组、非经非穴组、壮医针刺组之间的PWMT检测结果比较差异无统计学意义(P>0.05);术后第14天壮医针刺组的PWMT检测结果高于模型组和非经非穴组(P<0.01)。见表2、图1。
2.2 各组大鼠miR-429表达的变化造模后第14天,正常组大鼠脊髓背角组织中miR-429表达处于高水平,高于模型组、非经非穴组、壮医针刺组大鼠脊髓背角组织中miR-429表达水平(P<0.01),与模型组、非经非穴组相比,壮医针刺组干预miR-429表达水平上调,差异有统计学意义(P<0.05)。见图2。
2.3 各组大鼠IKKβ表达的变化造模后第14天,正常组大鼠IKKβ蛋白表达处于低水平,与正常组相比,模型组脊髓背角组织IKKβ蛋白表达水平升高(P<0.01),与模型组、非经非穴组相比,壮医针刺组可下调大鼠脊髓背角组织IKKβ蛋白表达水平(P<0.01)。见图3。
2.4 各组大鼠血清IL-1β含量的变化造模后第14天,正常组大鼠血清IL-1β含量处于低水平,与正常组、假手术组相比较,模型组血清IL-1β含量升高(P<0.01),与模型组、非经非穴组相比较,壮医针刺组可下调大鼠血清IL-1β含量(P<0.05)。见图4。

表2 各组大鼠PWMT比较

图1 各组大鼠术前(第0天)、术后第1天、术后第14天PWMT比较

注:与正常组及假手术组比较,*P<0.01,与壮医针刺组比较,#P<0.05
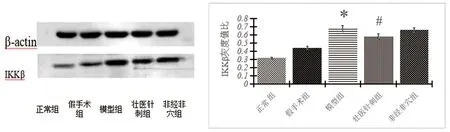
注:与正常组、假手术组比较,*P<0.01;与模型组、非经非穴组比较,#P<0.01

注:与正常组及假手术组比较,*P<0.01;与模型组及非经非穴组比较,#P<0.05
3 讨 论
壮医学虽无神经病理性疼痛之称谓,但壮医学理论对人体多种疼痛病症均有论述[15]。通过对神经病理性疼痛的病理生理机制进行分析,发现壮医学“三道两路”理论及“筋结”致痛学说可与之相契合[16]。在壮医学理论中,“三道两路”是指“水道”“谷道”“气道”三道和“火路”“龙路”两路。在人体生理状态下,三道分别主司水液代谢、食物运化、气机循环职责,而在两路之中,龙路是指人体血液循环的系统,火路则可与现代医学中人体的神经系统相对应[17-18]。壮医学中有“因结致痛”的说法,即三道两路不通,气血瘀堵结聚从而引起疼痛,涵盖了对疼痛的基本病机和治疗原则两个方面的认识,概括了在相关病理性因素的作用下,如机械性压迫、劳损而造成的肌肉痉挛、损伤性炎症等,导致局部组织受力不平衡,产生病理性损伤,在壮医理论中认为这是气血堵塞于经筋,凝结阻塞而造成疼痛[19-20]。气与血在人体密不可分,两者相互配合发挥生理功能。在壮医理论中,龙路是血液流动循环的通道,气推动血在龙路中运行,火路是将人体接收内外刺激传入大脑(壮语称为“巧坞”)并将相关反应信号传出的途径,作用与现代医学中的神经系统相类似。故基于壮医学理论对神经病理性疼痛的认识大致可概括为:局部组织在各种病理因素的作用下,气血结聚不通,造成龙路的血液循环异常,龙路的畅通受到影响或者相关病理性因子在龙路中积聚,同时因为龙路血液循环的异常或相关病理性因子的刺激,对火路产生作用,产生相关疼痛信号并通过火路传入大脑(“巧坞”),造成神经病理性疼痛发病。
本实验选取的壮医针刺穴位为手背一环10穴、内上桩、内中桩、内下桩、足背一环7穴,体现了壮医针刺疗法所遵循的“天圆地方”的配穴理论指导原则[21]。该理论以取象比类的思维,将中国古代哲学思想中的“天圆地方”运用到壮医临床实践。在该理论看来,“天圆”意为如圆环一般机动、灵动,在配穴时着重使用环穴。“地方”则代表稳固、平衡,即通过动态的调节以达到人体稳固健康的平衡状态。手背一环10穴位于手部,为天部环穴之一,由于手部运动频率高,且能完成人体最精巧复杂的动作,神经末梢分布丰富且敏感,大脑中与手部对应的皮层面积最大,故壮医认为手部与“巧坞”(大脑)的关联紧密,通过刺激手部穴位,可将针刺的刺激迅速传至大脑,调动人体形成良性反馈循环,改善疼痛状况。内上桩、内中桩、内下桩又合称“地内三桩”,为地部穴,与天部上下对应,共同调整人体整体气血状况。足背一环7穴是足背环穴之一,该穴对于针刺刺激亦较为敏感,常用于治疗腰腿痛,治疗部位更偏于人体下部。上述诸穴合用可共奏通利人体气血,疏通三道两路之瘀阻以缓解疼痛之功。
白细胞介素-1β(IL-1β)广泛参与机体内多种生理病理过程,是最重要的促炎因子之一,在炎症发生的过程中,可诱导多种细胞因子的释放而产生或加重炎症刺激。且IL-1β还可使多种疼痛介质释放增加,导致疼痛的程度加剧[22]。
IKKβ是NF-κB 经典信号通路的重要因子,其活性环通过的丝氨酸磷酸化构成NF-κB 信号通路启动的必要因素。NF-κB通路广泛参与多种免疫反应、炎症表达、细胞凋亡等生物进程,是调控炎症反应的重要通路[23]。
miRNA(微小RNA,microRNA)具有单链结构,不具有编码蛋白质的功能,核苷酸长度在18~25个之间,对基因调控具有重要作用。miRNA在生物体中作用广泛,通过其介导的控制机制,可调控多种生理病理机制[24]。有研究表明[13],miR-429对IKKβ具有靶向调控作用,可下调IKKβ的表达,从而抑制IKKβ对疾病的影响。
在本研究中,术后第1天,模型组大鼠PWMT较正常组降低,术后第14天,壮医针刺组大鼠PWMT较模型组升高,表明实验造模成功,壮医针刺对SNL模型大鼠的疼痛具有改善作用。造模后第14天,模型组大鼠血清IL-1β含量较正常组升高,壮医针刺组血清IL-1β较模型组降低,表明造模导致大鼠神经损伤,炎症因子释放增加,激活炎症反应导致疼痛,经壮医针刺干预后炎症因子含量减少,减轻了神经所受到的炎症刺激,使疼痛得以缓解。术后第14天,模型组大鼠脊髓背角组织IKKβ表达较正常组增多,壮医针刺组大鼠脊髓背角IKKβ蛋白表达较模型组减少,表明SNL模型大鼠IKKβ蛋白表达升高,炎症信号通路活跃,诱发炎症反应造成疼痛,而壮医针刺干预可下调IKKβ蛋白表达水平,壮医针刺可能通过抑制炎症信号通路的活跃程度达到缓解疼痛的效果。术后第14天,模型组大鼠脊髓背角组织miR-429表达较正常组减少,壮医针刺组大鼠脊髓背角组织miR-429蛋白表达较模型组增多,表明NPP发生时,miR-429表达减少,从而削弱了其对IKKβ/NF-κB炎症通路的抑制作用,而壮医针刺干预可上调miR-429表达水平,壮医针刺可能通过增加miR-429的表达从而下调IKKβ以达到缓解疼痛的效果。
综上我们推断,壮医针刺或可以通过上调miR-429表达而抑制IKKβ/NF-κB炎症通路的活性,减少炎症因子IL-1β的释放,从而获得缓解NPP所造成的疼痛的效果。

