酢浆草叶片及花朵感夜运动的结构机制
赵猛, 王雪琴, 孙悦雯, 路美玲, 薛琼琼, 王云霞
酢浆草叶片及花朵感夜运动的结构机制
赵猛, 王雪琴, 孙悦雯, 路美玲, 薛琼琼, 王云霞
(山西师范大学生命科学学院,太原 030000)
为了解酢浆草()叶片和花朵的感夜性,采用半薄切片方法对其叶枕和花托进行形态解剖学观察。结果表明,黑暗处理酢浆草后叶片完全闭合,3枚叶片以叶轴为轴线向下紧贴闭合。黑暗处理8 h花瓣完全闭合并螺旋成束状,花萼紧贴螺旋的花瓣但不发生螺旋。叶片张开时屈肌侧皮层薄壁细胞收缩,伸肌侧皮层薄壁细胞膨大。叶片闭合时屈肌侧皮层细胞膨胀,伸肌侧表皮细胞和3~5层外皮层薄壁细胞收缩。花朵闭合时,花托基部的5个维管束收缩合并成2束明显分离的维管束群,且存在细胞壁加厚的现象;花托角隅处细胞膨胀。叶枕中的屈肌和伸肌细胞的收缩或膨胀控制酢浆草叶片的感夜运动,酢浆草花朵的感夜运动主要与花托基部的维管束群和花托角隅处细胞的膨大和收缩有关。
酢浆草;叶;花;感夜运动;解剖结构
叶枕是位于叶片基部的径向对称的结构,会由于运动细胞的膨压变化而进行膨压运动[1]。叶枕中沿维管束上下两侧皮层细胞的结构不同,上部细胞的细胞壁较厚,胞间隙小,而下部细胞则反之。叶枕细胞的细胞膜含有大量的水孔蛋白,可以控制细胞内外水分的快速交换,使得细胞体积迅速发生改变从而使叶片张开或闭合[2]。叶片打开时,叶枕部位伸肌细胞体积增大、轴向扩张,屈肌细胞体积减小、轴向收缩[3]。植物叶片运动有向上和向下闭合2种,花生()、合欢()、含羞草()、雨树()等为叶片向上闭合植物,酢浆草()、大豆()、刺槐()等则为向下闭合。酢浆草叶片向下闭合时,近轴侧细胞膨压增大,使得细胞膨胀体积增大;远轴侧细胞膨压减小,细胞收缩体积减小,从而使得叶片从近轴侧向远轴侧方向向下闭合。因此,类似于酢浆草这种叶片向下闭合的植物叶片的叶枕部位近轴侧(正面)为屈肌细胞,远轴侧(背面)为伸肌细胞[4]。植物感夜运动是感性运动的一种[5],在豆科(Legumi- nosae)、酢浆草科(Oxalidaceae)中尤为常见[6–7]。受到光照、温度,以及内源生物钟等多方面的调控,叶子和花在白天呈水平开展状态,夜晚叶和花瓣通过上升、下降或旋转来使其相对位置发生改变[8–10]。感夜运动是由叶基部运动细胞的交替膨胀和收缩引起的,阴离子和钾离子通道的离子流动所带来的渗透压的改变也促进了这一过程[11]。植物的感夜性运动在豆科植物中研究较多,叶片感夜性运动由叶枕控制[8],植物激素也参与植物对光的反应[12],植物感夜运动的调控是一个极为复杂的过程,受外界刺激和内部机理的共同调节[13]。
酢浆草科植物叶片在闭合时不同于大豆和刺槐的向下闭合,后者在闭合时叶片及着生叶片的叶轴均成下垂状态,且3枚叶片的叶脉与叶轴相互垂直;而酢浆草科植物则是以茎为轴线,紧贴向茎闭合,茎不发生弯曲或下垂。此外,酢浆草科植物不仅叶片具有感夜性,花朵同样也具有感夜性。在自然条件下,酢浆草花的开放是依赖热性还是光性,取决于开放前夜间的温度。而花朵闭合时间是由内源因素决定的,并且花被的长度在开放时比闭合时要长[14]。本研究对酢浆草的叶枕及花托基部进行显微结构观察,探究酢浆草科植物感夜性与豆科植物的区别,寻找叶片及花朵中与感夜运动有关的结构及其解剖学特征,进而为后续感夜运动的解剖学研究提供参考依据。
1 材料和方法
酢浆草()培养于山西师范大学生物学实验室培养箱中,将酢浆草种球种植于盛有与蛭石和营养土混合的塑料花盆中(埋于土下约1.5 cm),于25 ℃下光/暗周期为16 h/8 h, 大约7 d相继发芽, 从长出嫩叶到开花结果进行记录物候,幼苗出土大约10 d选取叶枕和进入盛花期的花朵制作半薄切片进行观察。将封好的装片置于光学显微镜下观察,并连接Image View系统进行拍照记录。
2 结果和分析
2.1 叶片及花朵开闭状态观察结果
在25 ℃光照下,酢浆草叶片完全打开,3枚叶片在同一水平面(图1:A),叶枕从叶片背面观察比较明显;黑暗处理0.5 h后开始逐渐闭合;在25 ℃下黑暗处理3 h时,单株酢浆草叶片完全闭合,丛生酢浆草在6~8 h后完全闭合,3枚叶片以叶轴为轴线向下紧贴闭合(图1: B),从顶部可以明显观察到叶枕,光照7~8 h后叶片重新完全打开。在25 ℃光照下花朵完全开放,5枚花瓣(图1: C)、花萼(图1: F)均向外展开无明显螺旋;25 ℃下黑暗处理4 h时,花朵渐渐闭合,处于半开放状态,花瓣向顺时针方向螺旋(图1: D),花萼微微向外开展但不发生旋转(图1: G);25 ℃下黑暗处理8 h时,花朵完全闭合,花瓣完全闭合并螺旋成束状(图1: E),花萼紧贴螺旋的花瓣但不发生螺旋(图1: H, I)。
2.2 叶枕运动细胞解剖结构
酢浆草叶枕运动细胞由表皮、皮层和维管柱组成(图2: A)。表皮细胞是最外一层厚壁细胞,细胞为长方形或椭圆形,排列整齐紧密,无胞间隙。其次是皮层,皮层位于表皮之内维管束之外,由多层薄壁细胞组成,形状不规则,细胞排列较为疏松, 具有胞间隙(图2: B, C)。最内层为维管柱,位于叶枕中央,紧接皮层之下,由多个紧密排列、形状各异的维管束组成,木质部内外两侧均有韧皮部包围, 且各个维管束之间无明显界限(图2: D)。整个维管柱将皮层薄壁细胞分为数量不等的2个不同区域, 并在维管束周围的鞘细胞中可以明显的观察到细胞壁增厚的现象以及淀粉粒的存在。
从横切面上看,叶片张开时,屈肌侧表皮细胞、皮层薄壁细胞收缩(图2: B),伸肌侧表皮细胞和3~5层外皮层薄壁细胞体积较大(图2: C),维管柱呈长圆柱形,无明显弯曲(图2: D);屈肌侧维管柱周围有3~4层皮层细胞存在细胞壁加厚的现象且其细胞质中含有1~8个淀粉粒,淀粉粒沿伸肌侧细胞壁分布;而伸肌侧维管束周围仅有1~2层细胞含有淀粉粒,沿伸肌侧细胞壁分布。在叶片闭合时(图2: E),屈肌侧皮层细胞膨胀,表皮处仍有皱缩现象存在(图2: F),伸肌侧表皮细胞和3~5层外皮层薄壁细胞收缩,体积较小(图2: G),维管柱呈弯刀形,向屈肌细胞侧弯曲,周围淀粉粒分布情况同叶片打开时基本一致(图2: H);此外,对比整体横切图可以明显观察到维管柱将整个叶枕分为细胞层数不等的2个区域,屈肌侧细胞有8~10层,伸肌侧细胞则更多,有11~15层。

图1 25 ℃下酢浆草叶片和花朵。A: 光照下叶片完全打开,3枚叶片处于同一水平面;B: 黑暗处理8 h叶片完全闭合,并以茎为轴线向下闭合;C: 光照下花朵完全开放,花瓣不发生螺旋;D: 黑暗处理4 h花朵半开放,花瓣向顺时针方向螺旋;E: 黑暗处理8 h花朵完全闭合,花瓣完全闭合并螺旋成束状;F: 光照下花朵完全开放,花萼随花瓣展开不发生螺旋;G: 黑暗处理4 h花朵半开放,花萼微微向外开展但不发生旋转;H: 黑暗处理8 h花朵完全闭合,花萼紧贴花瓣但不发生螺旋;I: 黑暗处理8 h花朵完全闭合时花萼侧面观。
从纵切面上看,叶片张开时,伸肌侧有多个褶皱程度较小的表皮细胞(图2: I),虽有褶皱存在,但均表现为膨胀状态,无细胞皱缩的现象(图2: J);屈肌侧有多个褶皱程度巨大的表皮细胞和皮层细胞,且表皮收缩最为明显(图2: K),维管柱上半段无明显弯曲,下半段略微偏向屈肌一侧,且弯曲不明显;淀粉粒主要分布在皮层细胞当中,在靠近维管柱的皮层细胞中含有较多的淀粉粒。在叶片闭合时(图2: L),屈肌侧细胞相互嵌合,无明显褶皱和胞间隙,且体积较大(图2: M);伸肌侧表皮细胞和皮层细胞急剧收缩(图2: N);维管柱上半段无明显弯曲,下半段偏向屈肌一侧,弯曲明显; 淀粉粒主要分布在维管柱周围的皮层细胞中。
2.3 花托基部的解剖结构
控制花瓣发生螺旋的部位存在于花托,故而对花托基部进行解剖观察。结果表明,酢浆草花有心皮5个,每个心皮内有1个或多个胚珠(图3: A),5个心皮向内在花托中央汇集形成侧膜胎座,具有大量的晶体(图3: B),外围则由花萼所包裹,二者之间具有较大的空隙(图3: C)。组成心皮的细胞主要是表皮细胞和薄壁细胞,细胞内都含有淀粉粒或晶体。表皮细胞壁加厚,细胞内淀粉粒均沿外侧分布;向内为一层充满原生质的较大的薄壁细胞;再向内为3~4层薄壁细胞,内部的淀粉粒分布散乱;最内层是一层长方形或长椭圆形的细胞,淀粉粒含量较少。花萼主要由表皮和形状各异的皮层薄壁细胞组成,细胞排列疏松,具有胞间隙,且在心皮背缝所对应的地方有维管束存在,维管束周围则伴有1个较大的细胞间隙。
从横切面上看,花朵开放和闭合时花托基部的整体结构、心皮聚集处以及心皮与花萼交界处,均无明显差别(图3: A~F)。从纵切面上看,子房类型为子房上位(图3: G, H),具合生雌蕊,5心皮5室。二者差别主要体现在2个方面:一是在花托基部, 二是在花托的角隅处。在花朵开放时,花托基部的5个维管束膨大分离呈分支状,且在维管束交汇处有一个膨大突起的球状细胞群,含有丰富的导管(图3: I);花托角隅处细胞收缩,与花萼纵面约呈163° (图3: K)。在花朵闭合时,花托基部的5个维管束收缩合并成2束明显分离的维管束群,无膨大突起的球状细胞群,且存在细胞壁加厚的现象(图3: J);花托角隅处细胞膨胀,与花萼纵面约呈130°(图3: L)。这表明,花朵的感夜运动与花托基部维管束群、花托角隅处细胞的收缩或膨大有关, 而这2种细胞的收缩或膨大则可能与该处的细胞壁加厚有关。此外,花托角隅处细胞的膨大或收缩则可能与花被长度在开时显著增加,闭合时略微增加有关。
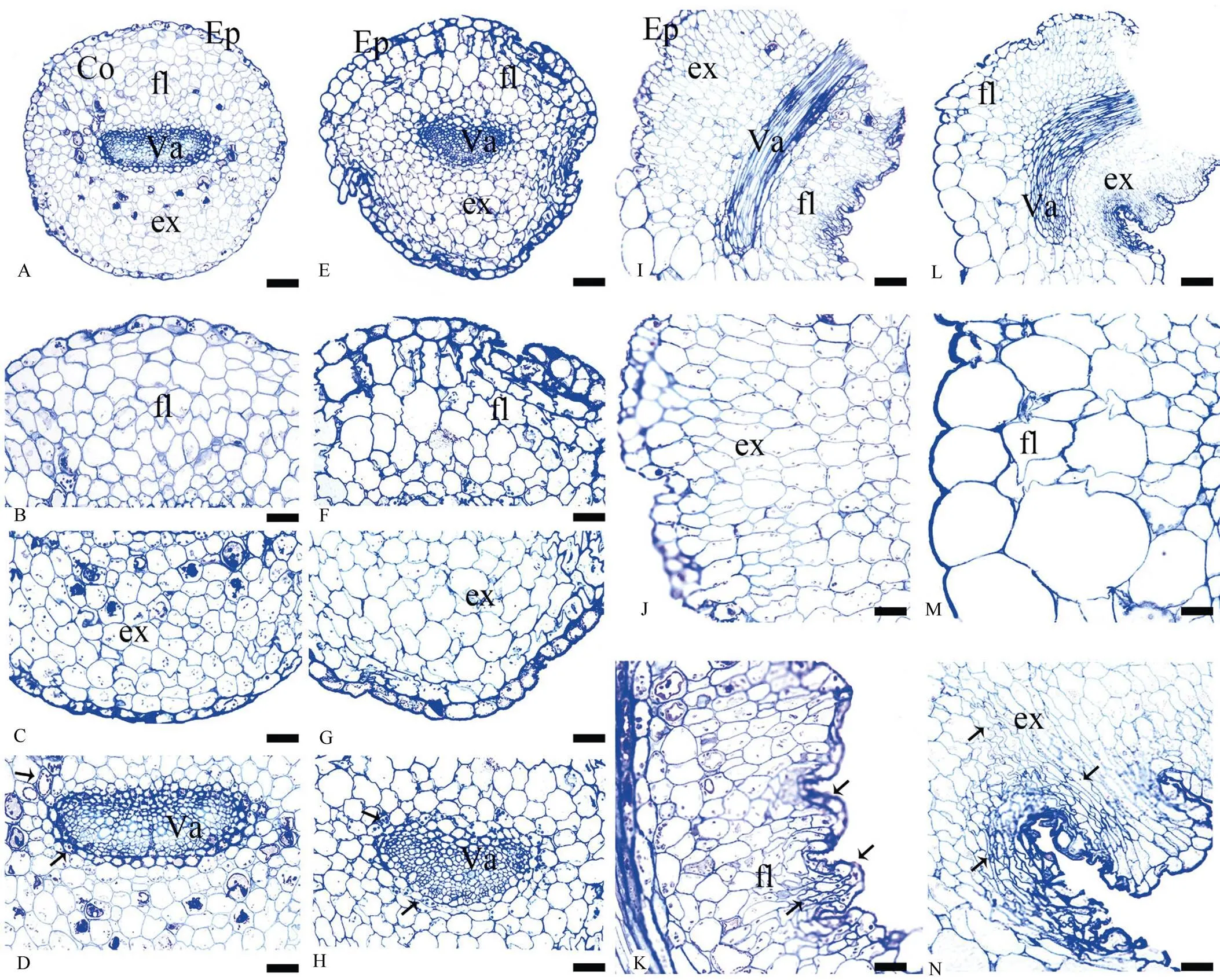
图2 酢浆草叶枕运动细胞的显微结构。A~G: 横切面; I~N: 纵切面。A: 叶片张开时的叶枕;B: 叶片张开时屈肌侧细胞;C: 叶片张开时伸肌侧细胞;D: 叶片张开时叶枕的维管柱结构,箭头示淀粉粒;E: 叶片闭合时的叶枕;F: 叶片闭合时屈肌侧细胞;G: 叶片闭合时伸肌侧细胞;H: 叶片闭合时叶枕的维管柱结构,箭头示淀粉粒;I: 叶片张开时叶枕;J: 叶片张开时伸肌侧细胞;K: 叶片张开时屈肌侧细胞,箭头示表皮和屈肌细胞收缩;L: 叶片闭合时的叶枕;M: 叶片闭合时屈肌侧细胞;N: 叶片闭合时伸肌侧细胞,箭头示表皮和伸肌细胞皱缩。Ep: 表皮; Co: 皮层; Va: 维管束; Cal: 花萼; Car: 心皮; Ov: 胚珠。标尺: A=397 μm; B=400 μm; C, D, F, G, H=227 μm; E=208 μm; I=333 μm; J=417 μm; K, L=147 μm; M, N=138 μm
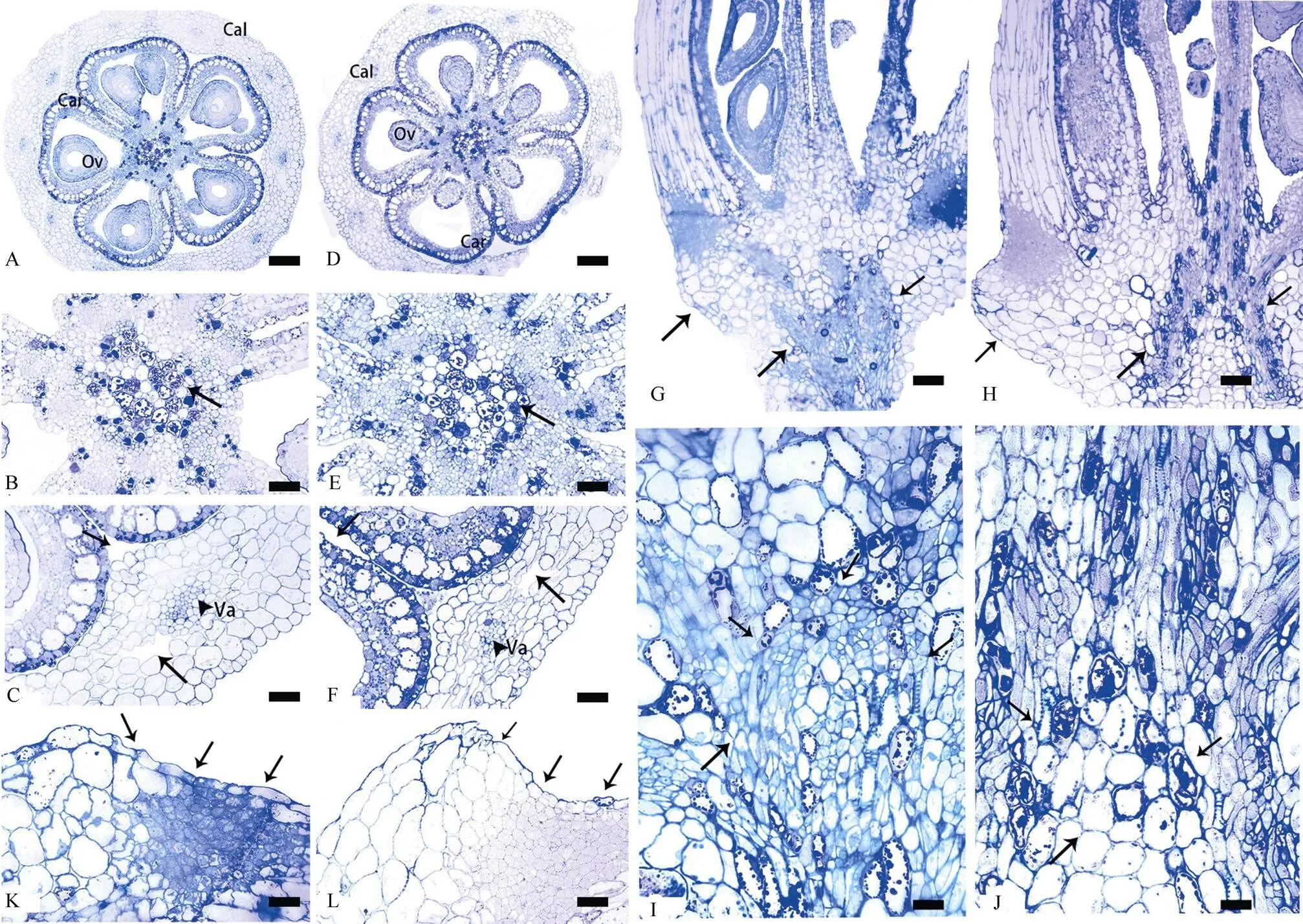
图3 酢浆草花托基部的显微结构。A~F: 横切面; G~L: 纵切面。A: 花开放时花托基部;B: 花开放时心皮聚集处,箭头示晶体;C: 花开放时花萼与心皮交界处,箭头示大空隙,三角示维管束;D: 花闭合时花托基部;E: 花闭合时心皮聚集处;F: 花闭合时花萼与心皮交界处,箭头示大空隙,三角示维管束;G: 花开放时花托基部,箭头示花托角隅和花托基部维管束群;H: 花闭合时花托基部,箭头示花托角隅处和花托基部维管束群;I: 花开放时花托基部维管束群,箭头示膨大突起的球状细胞群;J: 花闭合时花托基部维管束群, 箭头示没有球状突起,而是2个分离的维管束群;K: 花开放时花托基部角隅处,箭头示花托与花萼纵切面约为160°;L: 花闭合时花托基部角隅处,箭头示花托与花萼纵切面约为130°。Cal: 花萼; Car: 心皮; Ov: 胚珠; Va: 维管束。标尺: A, B=666 μm; C~F, K, L=227 μm; G, I, J=138 μm; H=455 μm
3 结论和讨论
植物的感夜运动由内外因素共同调控,内因主要是由生物钟、内源性化学因子[15]、离子通道[16]、水孔蛋白通道等调控[17];外因则是受光信号、光质[18]、温度等影响[19]。大豆、刺槐、酢浆草都属于叶片向下闭合的植物,大豆和刺槐叶片闭合时叶脉与叶轴相互垂直,而酢浆草叶脉与茎几乎相互紧贴至平行。虽闭合结果不同,但在闭合过程中均是向下闭合的,因而在开闭机制上存在一定的相似性。酢浆草叶片开闭时可以明显的观察到叶枕变化,故而初步认为酢浆草叶片的感夜运动和大豆刺槐一样,都与叶枕有关。本研究表明,酢浆草叶枕运动细胞在开闭时的状态明显不同,在叶片开放时屈肌细胞收缩,伸肌细胞膨胀;叶片闭合时屈肌细胞膨胀,伸肌细胞收缩;这一结构特征与同为一级叶枕向下闭合的雨树一致[4]。有研究报道豆科植物叶枕的维管束形状与叶片运动的类型和速度无关,含羞草科植物的维管束形状在不同开闭状态时不发生变化[20]。本研究表明酢浆草叶片的感夜运动与维管束形状和走向、淀粉粒分布无关,其开闭仅与屈肌和伸肌细胞的收缩或膨胀有关。
在自然条件下,酢浆草花被的长度在开放时比闭合时长[14],表明酢浆草花朵的感夜运动与花托基部的结构有关。花托基部的维管束群和花托基部角隅处的运动细胞在花朵的开闭时明显不同,表明酢浆草花的感夜运动与这两处细胞的膨大或收缩有关。
有研究表明,含羞草叶枕部位的表皮细胞与皮层薄壁细胞之间存在大量的胞间连丝、皮层薄壁细胞通过胞间连丝与相邻细胞连接,特别是与中央维管柱的厚角细胞相连接[21]。本研究结果表明,无论是叶枕还是花托基部的运动细胞均存在细胞壁增厚的现象,特别是叶枕中央维管柱外层的鞘细胞和花托基部的维管束群有明显的细胞壁增厚现象。另外,含羞草的薄壁细胞中会有一些分泌细胞存在, 分泌细胞之间彼此通过胞间连丝和纹孔进行信息交流[22]。我们推测运动细胞的收缩或膨胀可能与纹孔场或胞间连丝有关,此外在花托基部的维管束群中有大量的导管存在,这表明酢浆草叶枕和花托的运动细胞间快速交流也可能是依靠纹孔和胞间连丝。
综上,酢浆草叶片感夜运动主要与叶枕中的屈肌和伸肌细胞的收缩或膨胀有关,酢浆草花朵的感夜运动主要与花托基部的维管束群和花托角隅处细胞的膨大和收缩有关。此外,控制开闭的结构处常有细胞壁加厚的现象。
[1] LIU M. Study on the adaptive significance of flexistyly in(Zingiberaceae) [D]. Beijing: University of Chinese Academy of Sciences, 2007. [刘敏. 山姜属植物花柱卷曲运动机制适应性的研究[D]. 北京: 中国科学院研究生院, 2007.]
[2] LUO Y L. The physiological mechanism of the style curvature in(Zingiberaceae) [D]. Beijing: University of Chinese Academy of Sciences, 2008. [罗银玲. 山姜属植物花柱卷曲运动的生理机制[D]. 北京: 中国科学院研究生院, 2008.]
[3] SATTER R L, GORTON H L, VOGELMANN T C. The Pulvinus: Motor Organ for Leaf Movement [M]. Rockville: American Society of Plant Physiologists, 1990.
[4] UEDA M, NAKAMURA Y. Chemical basis of plant leaf movement [J]. Plant Cell Physiol, 2007, 48(7): 900–907. doi: 10.1093/pcp/pcm060.
[5] DAI Z W, LING R, ZHAO Y M, et al. Optimum reference gene selection of nyctinastic movement in‘Purpurea’ [J]. Mol Plant Breed, 2023, 21(2): 487–494. [戴中武, 凌瑞, 赵亚梅, 等. ‘紫叶’酢浆草感夜性运动最适内参基因的筛选[J]. 分子植物育种, 2023, 21(2): 487–494. doi: 10.13271/j.mpb.021.000487.]
[6] ZLINSZKY A, BARFOD A. Short interval overnight laser scanning suggest sub-circadian periodicity of tree turgor [J]. Plant Sign Behav, 2018, 13(2): e1439655. doi: 10.1080/15592324.2018.1439655.
[7] MINORSKY P V. The functions of foliar nyctinasty: A review and hypothesis [J]. Biol Rev, 2019, 94(1): 216–229. doi: 10.1111/brv.12 444.
[8] OIKAWA T, ISHIMARU Y, MUNEMASA S, et al. Ion channels regulate nyctinastic leaf opening in[J]. Curr Biol, 2018, 28(14): 2230–2238.e7. doi: 10.1016/j.cub.2018.05.042.
[9] SAMARAKOON U C, PEIRIS S E. Control of circadian rhythm- regulated nyctinastic movement in water lily (Willd.) flowers [J]. J Hort Sci Biotechnol, 2005, 80(2): 167–170. doi: 10. 1080/14620316.2005.11511911.
[10] WILKINS M B. Physiology of Plant Growth and Development [M]. London: McGraw-Hill, 1969: 648–669.
[11] MEN Z H, LI S X. Progress in the study of plant biorhythm [J]. J Biol, 2009, 26(5): 53–55. [门中华, 李生秀. 植物生物节律性研究进展[J].生物学杂志, 2009, 26(5): 53–55. doi: 10.3969/j.issn.1008-9632.2009. 05.053.]
[12] SU W, HOWELL S H. The effects of cytokinin and light on hypocotyl elongation inseedlings are independent and additive [J]. Plant Physiol, 1995, 108(4): 1423–1430. doi: 10.1104/pp.108.4.1423.
[13] ZHAO L L, WANG Y X, XUE Q Q, et al. Research progress of plant nyctinasty and its mechanism [J]. Chin Wild Plant Resour, 2020, 39(5): 49–54. [赵露露, 王云霞, 薛琼琼, 等. 植物感夜运动及其机制的研究进展[J]. 中国野生植物资源, 2020, 39(5): 49–54. doi: 10.3969/j. issn.1006-9690.2020.05.010.]
[14] TANAKA O, MURAKAMI H, WADA H, et al. Flower opening and closing of[J]. Bot Mag Tokyo, 1989, 102(2): 245–253. doi: 10.1007/BF02488567.
[15] UEDA M, TAKADA N, YAMAMURA S. Molecular approach to the nyctinastic movement of the plant controlled by a biological clock [J]. Int J Mol Sci, 2001, 2(4): 156–164. doi: 10.3390/i2040156.
[16] UEHLEIN N, KALDENHOFF R. Aquaporins and plant leaf move- ments [J]. Ann Bot, 2008, 101(1): 1–4. doi: 10.1093/aob/mcm278.
[17] VOLKOV A G, FOSTER J C, BAKER K D, et al. Mechanical and electrical anisotropy inpulvini[J]. Plant Sign Behav, 2010, 5(10): 1211–1221. doi: 10.4161/psb.5.10.12658.
[18] SATTER R L, GALSTON A W. Mechanisms of control of leaf move- ments [J]. Annu Rev Plant Physiol, 1981, 32: 83–110. doi: 10.1146/ annurev.pp.32.060181.000503.
[19] HOSHIZAKI T, HAMNER K C. Circadian leaf movements: Persi- stence in bean plants grown in continuous high-intensity light [J]. Science, 1964, 144(3623): 1240–1241. doi: 10.1126/science.144.3623. 1240.
[20] RODRIGUES T M, MACHADO S R. Pulvinus functional traits in relation to leaf movements: A light and transmission electron micro- scopy study of the vascular system [J]. Micron, 2008, 39(1): 7–16. doi: 10.1016/j.micron.2007.09.001.
[21] FLEURAT-LESSARD P. Ultrastructural features of the starch sheath cells of the primary pulvinus after gravistimulation of the sensitive plant (L.) [J]. Protoplasma, 1981, 105(3): 177–184. doi: 10.1007/BF01279216.
[22] FLEURAT-LESSARD P, ROBLIN G. Comparative histocytology of the petiole and the main pulvinus inL. [J]. Ann Bot, 1982, 50(1): 83–92.
Structural Mechanism of Nyctinastic Movement in Leaves and Flowers of
ZHAO Meng, WANG Xueqin, SUN Yuewen, LU Meiling, XUE Qiongqiong, WANG Yunxia
(Life Science College, Shanxi Normal University,Taiyuan 030000, China)
In order to understand the nyctinasty of leaves and flowers of, the leaf pillows and receptacles were studied by semi-thin section. The results showed that the leaves were completely closed after dark treatment, and three leaves were tightly closed downward with the leaf axis as the axis. The petals were completely closed and spiraled into bundles under dark for 8 hours, and the calyx clung to the spiral petals but did not spiral. The cortical parenchyma cells on the flexor side contracted and the parenchyma cells on the extensor side expanded when the leaf was opened. When the leaf was closed, cortical cells on the flexor side expanded, epidermal cells on the extensor side and parenchyma cells on the 3-5 layers of outer cortex contracted. When the flower closed, the five vascular bundles at the base of the container contracted and merged into two distinct vascular bundles, and the cell walls were thickened. Cells swell at corner of receptacle. Therefore, the contraction and expansion of flexor and extensor muscle cells in the leaf occipital control the nocturnal motion of the leaves of. The nocturnal motion of flowers is mainly related to the enlargement and contraction of the vascular bundles at the base of the receptorum and the cells at the corner of the receptorum.
; Leaf; Flower; Nyctinasty movement; Anatomical structure
10.11926/jtsb.4569
2021-11-12
2022-04-10
国家自然科学基金项目(31300157, 41571499); 山西省自然科学基金项目; 山西师范大学研究生创新性项目(2021Y496)资助
This work was supported by the National Natural Science Foundation of China (Grant No. 31300157, 41571499), the Project for Natural Science in Shanxi, and the Project for Graduate Innovation of Shanxi Normal University (Grant No. 2021Y496).
赵猛(1980年生),副教授,主要从事植物分泌结构研究。E-mail: zhaomeng@sxnu.edu.cn

