富血小板纤维蛋白中生长因子含量及释放周期的实验研究
林盘玉 许 放 赵良军
广西医科大学第一附属医院骨科,广西南宁 530021
富血小板纤维蛋白(platelet-rich fibrin,PRF)是第二代血小板浓缩物,含有转化生长因子-β3(transforming growth factor-β3,TGF-β3)、血小板源生长因子-AA(platelet-derived growth factor-AA,PDGF-AA)和胰岛素样生长因子-1(insulin-like growth factor,IGF-1)等多种生长因子,当机体组织出现损伤后,血小板被激活并释放生长因子,在组织创面愈合、血管生成及成软骨分化等过程中发挥重要作用[1]。PRF在凝血酶的作用下形成非溶性纤维蛋白,纤维蛋白进而促进血小板聚集,随着时间的推移,纤维蛋白在一定时期内被逐步降解,血小板分批被激活,能有效提高生长因子释放和利用效率[2]。目前相关研究主要集中于观察富血小板血浆(platelet-rich plasma,PRP)的短期效应,并没有充分观察整个释放时间段和释放趋势[3],有必要深入研究PRP及PRF中生长因子释放量与释放时间的关联性及影响因素,有助于扩大临床应用范围和深度。本研究通过对比PRP与PRF中TGF-β3、PDGF-AA和IGF-1生长因子含量及释放周期,探讨PRF的临床应用优势。
1 资料与方法
1.1 分组
课题组招募10名健康志愿者,签署试验知情同意书,本研究资料的收集符合医院医学伦理委员会的规定。在双侧肘静脉抽取2管血液,每管各5 ml,按随机数表法将左右两侧2管静脉血分为PRP组和PRF组,在相同条件下制备成PRP和PRF检测样本,备用。
1.2 ELISA法测定PRF中TGF-β3、PDGF-AA和IGF-1浓度
1.2.1 制备培养液 ①从10名健康志愿者双侧肘静脉各获取5 ml血液;②置入普通离心机内离心,制备PRP和PRF;③收集EP管内液体并记录样本量,-80℃冰箱留存,标本溶液待测。
1.2.2 测定PRF中TGF-β3、PDGF-AA及IGF-1浓度 ①样品准备:将EP管取出并融化,设置离心参数为2000 r/min,离心20 min,取上清液;②标准品准备:用1 ml的稀释溶液将标准品稀释到标准浓度,缓慢摇晃10 min,将原液稀释至10 ng/ml,然后在倍数比下稀释成以下浓度:1000、500、250、125、62.5、31.25、15.6 pg/ml,标准品的稀释液作为0 pg/ml;③按照TGF-β3、PDGF-AA、IGF-1试剂盒(美国Sigma公司,美国,批号:BJ-E687473)进行操作,酶标仪测定OD值,绘制标准品及待测样本OD值浓度曲线。
1.3 PRF显微结构
使用JCM-7000扫描电子显微镜(日本Olympus株式会社,型号:JCM-7000)观察PRF的显微结构。①将离心好的PRF标本置入含有2.5%戊二醛溶液的容器内,固定24 h,依次用PBS缓冲液反复冲洗标本,各3次,每次5 min;②将标本用25%、50%、75%、90%、100%不同浓度乙醇依次进行脱水,不同梯度每次15 min;③将标本用20 nm金离子溅射进行包裹镀膜,于金属拖上将标本进行粘连,并做好标记;④设置15 kV、8000×放大倍数等相关参数,应用扫描电子显微镜进行观察,采集PRF标本上、中、下3段的图像;⑤对PRF标本图像进行分析,并描述显微结构特点。
1.4 统计学方法
采用SPSS 17.0统计学软件进行数据处理,计量资料用均数±标准差()表示,采用t检验,相关性采用Pearson分析,P< 0.05为差异有统计学意义。
2 结果
2.1 PRP和PRF中TGF-β3、PDGF-AA和IGF-1的释放总量比较
PRP与PRF中TGF-β3、PDGF-AA、IGF-1的释放总量比较,差异无统计学意义(P> 0.05),见表1。
表1 PRP和PRF中TGF-β3、PDGF-AA和IGF-1的释放总量比较(ng/ml,)
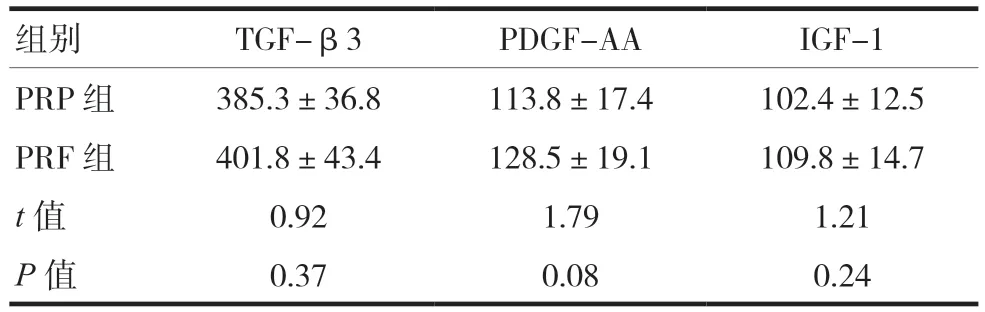
表1 PRP和PRF中TGF-β3、PDGF-AA和IGF-1的释放总量比较(ng/ml,)
注 TGF-β3:转化生长因子-β3;PDGF-AA:血小板源生长因子-AA;IGF-1:和胰岛素样生长因子-1;PRF:富血小板纤维蛋白;PRP:富血小板血浆
组别 TGF-β3 PDGF-AA IGF-1 PRP 组 385.3±36.8 113.8±17.4 102.4±12.5 PRF 组 401.8±43.4 128.5±19.1 109.8±14.7 t值 0.92 1.79 1.21 P值 0.37 0.08 0.24
2.2 PRP和PRF中生长因子释放周期情况
两组生长因子含量中TGF-β3最高,IGF-1次之,PDGF-AA最少;PRP中生长因子3 d内达到释放高峰,1周内缓慢释放;PRF中生长因子在1周内出现释放高峰,3周后释放趋于平稳,不同生长因子的释放高峰出现的时间点不同。
2.3 PRF结构
PRF呈淡黄色胶冻状,质地均匀,富有弹性,去除下层的红细胞碎块,双面加压后PRF呈膜片状物质,质地坚韧,主体部分呈淡黄色,下段少量红色(图1A~B);电镜扫描结果显示:PRF中胶原纤维束形态规则、结构清晰、表面光滑,纤维束之间相互交联缠绕,呈网状结构,内含血小板、白细胞和红细胞细胞等成分(图1C~D)。
3 讨论
血液主要由红细胞、白细胞、血小板和血浆等多种成分组成,其中红细胞约占44%,白细胞及血小板约占1%,通过设置不同离心参数,可制备出不同状态和结构成分的血小板浓缩物,包括PRP、PRF和生长因子浓缩物(concentrated growth factors,CGF),PRF是第二代血小板浓缩物,通过离心形成非纤溶性纤维蛋白,随着纤维蛋白逐步降解,滞纳于纤维蛋白内的血小板及白细胞逐渐被激活,进而释放生长因子[4-5]。
PRP和PRF中TGF-β3、PDGF-AA和IGF-1的释放曲线相似,释放总量一致,不同生长因子的释放高峰点及持续时间不同。PRF中3种生长因子释放总量对比,TGF-β3最高,IGF-1次之,PDGF-AA最少;生长因子在1周内出现释放高峰,随后逐渐下降,3周后释放趋于平稳;He等[6]研究发现PRF在2周内生长因子释放达到高峰,4周后释放趋于平稳,认为生长因子释放曲线具有一定的时间周期性,与本研究结果类似。本实验扫描电镜结果显示胶原纤维束呈网状交叉排列,直径1~2 μm、表面光滑,结构清晰、密度均匀、形态规则,内含大量细胞成分[7]。PRF横截面显示三维网状结构表面胶原纤维束密度及直径更大,中间更为疏松,纤维束间隙更大[8-9],这种特殊构型可能是离心过程中纤维蛋白与离心管壁碰撞引起的,四周致密及中间疏松多孔可以容纳更多的小分子物质,聚集的血小板沿着纤维束之间呈归巢式排列[10-11],血小板与生长因子通过化学键的方式聚集成块,表面致密的胶原纤维可以延缓血小板团块逃逸,随着纤维蛋白逐步降解,血小板被激活,从而延缓生长因子释放,特殊的三维网状构型是其发挥生物学作用的结构基础[12-13]。
PRF生长因子释放量及释放曲线受多种因素影响,生长因子主要来源于纤维蛋白、血小板、白细胞及其他成分,通过降低离心速度和缩短离心时间可以增加生长因子释放量,可能与包含更多未激活的白细胞有关,离心参数改变会引起网状构型变化,从而影响滞纳小分子物质的能力,其次,离心管类型也会影响血小板含量及分布[14];Kobayashi等[15]发现不同个体间血液成分也存在一定差异性,同样离心条件下PRF生长因子含量也不同,认为生长因子释放量受体内外多种因素影响。
综上所述,PRP和PRF能有效释放生长因子,且释放总量较为一致,但是由于PRF中纤维蛋白逐渐被降解,进而延长了生长因子的释放时间,其释放曲线具有一定的时间周期性。

