猪细小病毒BJ2 株的分离鉴定及全基因组序列分析
赵文影,张云静,白小飞,孙玉洁,郭玲花,黄柏成,田克恭
(1.国家兽用药品工程技术研究中心,河南 洛阳 471000;2.普莱柯生物工程股份有限公司,河南 洛阳 471000)
猪细小病毒(Porcine parvovirus,PPV)是造成母猪繁殖障碍的主要病原体之一,临床症状主要表现为母猪不育、流产、木乃伊胎以及延迟发情[1-2]。PPV属于细小病毒属成员,为无囊膜的负链单股线状DNA 病毒。PPV 共有7 个基因型,其中PPV2—7 型还未见分离成功的报道,对于新型细小病毒的致病力及免疫保护机制尚不清楚[3-4]。PPV1 型基因组全长约5 kb,包含2 个开放阅读框(Open reading frame,ORF),其中ORF1 编码非结构蛋白NS1、NS2和NS3,ORF2 编 码 结 构 蛋 白VP1、VP2 和VP3。PPV1 根据毒株组织嗜性和致病性差异分为四大类:第一类是以NADL-2为代表的弱毒株,第二类是以NADL-8 株为代表的强毒株,第三类是以Kresse株为代表的皮炎型强毒株,第四类是以IAF-83株为代表的肠炎型弱毒株[5-7]。前人研究表明,不同毒株的致病性差异或毒力强弱由VP1/VP2基因氨基酸位点替换所决定[8]。目前,GenBank 收录的PPV 弱毒株代表株基因序列包含有NADL-2 株、N 株和China株等,强毒株代表株基因序列包含Kresse 株、27a株、BQ株等。
1964 年,MAYR 等[9]在猪原代细胞培养物中首次分离到PPV,我国潘雪珠等[10]在1983 年首次分离到该病毒,随后国内各地陆续有PPV 病例报道[11-12]。目前,防控该病的主要手段是接种疫苗,但是由于PPV 的NS1 和VP2 氨基酸位点突变,造成现有疫苗不能对异源毒株提供良好的保护效果[13-14]。有研究表明,与其他细小病毒属的成员相比,PPV1 基因组的保守性更高[15-17]。前人对PPV 全基因组序列进行进化动力学分析表明,非结构蛋白每年每个位点氨基酸替代率约为10-5次,衣壳蛋白基因每年每个位点的核苷酸取代率约为10-4次,衣壳蛋白氨基酸高替换率与RNA病毒相似,提示PPV基因组具有遗传多样性[18-19]。
为深入了解PPV 的变异情况,对2020—2021年从江苏、河南和北京3 个省市收集的组织病料进行PCR 鉴定和检出率分析,并从PPV 阳性病料中进行病毒分离鉴定,通过PCR 扩增分离株全基因组核酸序列,对分离毒株的全基因组、VP2基因及推导氨基酸进行序列分析,以期为PPV 疫苗的研制奠定基础。
1 材料和方法
1.1 材料
1.1.1 主要试剂 Viral Nucleic Acid Extraction KitⅡ购 自 台 湾 旭 基 公 司;2×TransTaq®-T PCR SuperMix(+dye)、2×TransStart®FastPfu PCR SuperMix(-dye)、pEASY®-Blunt Cloning Kit 和Trans-T1 感受态细胞购自北京全式金生物公司;Premix ExTaq(2×)(Probe qPCR)、DNA Marker 和琼脂糖等均购自Takara 公 司;α-MEM 培 养 基 和0.25% 胰 酶 购 自Gibco 公司;胎牛血清(FBS)购自Cegrogen 公司;溴化乙淀溶液(EB)和50×TAE电泳缓冲液购自生工生物(上海)股份有限公司。PPV 鼠源单克隆抗体2D1由国家兽用药品工程技术研究中心提供,FITC 标记的兔抗鼠IgG购自Sigma公司,PPV HeN1202株病毒液由国家兽用药品工程技术研究中心提供。
1.1.2 临床样品 在2020—2021年从江苏、河南和北京3个省市共采集165份组织样品。
1.1.3 细胞 ST 细胞来源于美国菌种保藏中心(ATCC),由国家兽用药品工程技术研究中心保存。
1.2 方法
1.2.1 PPV 流行病学调查 采用PCR 检测方法对2020—2021 年从江苏、河南和北京3 个省市采集的临床病料进行猪细小病毒核酸检测。上游引物PPV-F(5′-TGGTCTCCTTCTGTGGTAGG-3′)和 下游 引 物PPV-R(5′-CAGAATCAGCAACCTCAC-3′)由天津金唯智有限公司合成,预期片段大小为445 bp。按照Viral Nucleic Acid Extraction Kit Ⅱ试剂盒提取病毒核酸。PCR 反应体系:2×TransTaq®-T PCR SuperMix(+dye)10 μL,上、下游引物各0.5 μL,RNase free dH2O 7 μL,模板2 μL。PCR 扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共35 个循环;最后72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测。
1.2.2 病毒的分离培养 称取阳性病料2 g,用剪刀剪碎后加入7 mL α-MEM 培养基,经研磨处理后,10 000 r/min 离心10 min,取上清液经0.22 μm 滤器过滤除菌后,分装备用。将处理后的组织研磨液用含2% FBS 的α-MEM 培养基2 倍稀释,然后接种于长至单层的ST 细胞,37 ℃孵育1 h 后,补加5 mL 含2% FBS 的α-MEM 培养基,同时设置正常细胞对照。培养72~96 h 收毒,或待细胞病变至80%时收毒。
1.2.3 电镜负染 取10 μL 病毒液滴于碳膜上,静置10 min;同时取10 μL 1%磷钨酸滴于干净的封口膜上;静置结束后,用滤纸吸取多余的病毒液,将铜网置于磷钨酸缓冲液上5~10 s,吸干多余磷钨酸,之后在电镜下观察病毒粒子形态。
1.2.4 间接免疫荧光试验(IFA)ST 细胞经0.25%胰酶消化后计数,按照2 万个/孔铺于96 孔板,置37 ℃、5%CO2培养箱培养。当细胞长至单层进行病毒液的接种,同时设置阴性对照和阳性对照(阳性对照孔接种HeN1202 株病毒液)。接毒后培养72 h从培养箱取出,PBS 洗涤3 次,200 μL/孔;加入预冷的80%丙酮,50 μL/孔,2~8 ℃固定30 min;弃去丙酮,PBS 洗涤3 次,200 μL/孔,3 min/次;加入1∶400稀释的PPV鼠源单克隆抗体2D1,50 μL/孔,置37 ℃作用30 min;弃去一抗,PBS 洗涤3 次,200 μL/孔,5 min/次;加入1∶500 稀释的FITC 标记的兔抗鼠IgG抗体,50 μL/孔,置37 ℃作用30 min;弃去二抗,洗涤3次,200 μL/孔,5 min/次,最后加入PBS,50 μL/孔,用荧光显微镜观察。
1.2.5 实时荧光定量PCR(qPCR)PPV qPCR 鉴定的上游引物(5′-TCACCAAACAATTAATAATAGC-3′)、下游引物(5′-GGTTCATCATCATTATATTGTG-3′)和探针引物(5′-FAM-ACACAGAAGCAACAGCAATTAGGC-BHQ1-3′)均由天津金唯智有限公司合成。按照Viral Nucleic Acid Extraction Kit Ⅱ试剂盒提取病毒核酸,作为模板。qPCR 反应体系:Premix ExTaqTM(2×)(Probe qPCR)10 μL,上、下游引物各0.4 μL,探针引物0.8 μL,RNase free ddH2O 6.4 μL,模板2 μL。PCR 扩增程序:95 ℃预变性90 s;95 ℃变性10 s,60 ℃30 s,共35 个循环,并在60 ℃处收集荧光。
1.2.6 PPV 基因组PCR 扩增 根据PPV HN2011 株(GenBank登录号:JX992846.1)序列设计5对引物用于PPV 基因组扩增(表1),引物由天津金唯智有限公司合成。使用2×TransStart®FastPfu PCR SuperMix(-dye)进行PPV全基因组序列PCR扩增。PCR反应体系:2×TransStart®FastPfu PCR SuperMix(-dye)25 μL,上、下游引物各1.5 μL,RNase free ddH2O 20 μL,模板2 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共35个循环;最后72 ℃延伸5 min。PCR 产物经1%琼脂糖凝胶电泳检测。将目的片段回收后,与pEASY®-Blunt载体25 ℃金属浴20 min进行连接,将连接产物转化至Trans-T1 感受态细胞,经PCR 鉴定为阳性的质粒送生工生物工程(上海)股份有限公司测序。

表1 引物序列信息Tab.1 Primers used in this study
1.2.7 PPV全基因组和VP2基因序列分析及遗传进化分析 首先使用SeqMan 软件拼接测序结果,然后使用MegAlign 软件将拼接结果与GenBank 收录的PPV 毒株序列(表2)进行全基因组和VP2基因核苷酸的一致性比对(Clustal W 法)。基于邻近法,使用MEGA 6.0 软件对VP2基因核苷酸序列构建系统进化树,并基于VP2基因推导氨基酸序列,分析PPV分子特征。

表2 PPV参考毒株序列信息Tab.2 Information of PPV reference strains
2 结果与分析
2.1 PPV流行病学调查结果
对2020—2021年采集的病料进行PCR检测,经统计,河南PPV 核酸检出率为37.5%,江苏PPV 核酸检出率为8.3%,北京PPV 核酸检出率为3.5%(表3);从年份来看,与2020 年相比,2021 年PPV 核酸检出率明显升高(表4)。

表3 2020—2021年不同省市PPV核酸检测结果Tab.3 Result of PPV nucleic acid detection in different provinces from 2020 to 2021

表4 2020—2021年PPV核酸检测结果Tab.4 Result of PPV nucleic acid detection from 2020 to 2021
2.2 临床样品PPV的分离
将PPV核酸阳性的病料上清接种于ST细胞,盲传2 代后开始出现细胞病变,表现为细胞内颗粒增多、细胞变圆、聚堆、拉网脱落,而对照细胞形态未见异常(图1)。将分离的PPV命名为BJ2。

图1 PPV感染细胞病变结果(100×)Fig.1 Cytopathic results of PPV infeced cells(100×)
2.3 PPV BJ2分离株的鉴定
2.3.1 PPV 分离株IFA检测 将BJ2株F4代病毒液接种于ST 细胞,48 h 后进行IFA 检测。结果显示,阳性对照细胞的细胞质可见特异性绿色荧光,接毒细胞的细胞质显示与阳性对照细胞一致的绿色荧光,正常细胞未见特异性荧光(图2)。

图2 PPV BJ2株IFA鉴定结果(100×)Fig.2 IFA identification results of PPV BJ2 strain(100×)
2.3.2 qPCR鉴定 采用qPCR 方法检测BJ2分离株F1~F3代病毒核酸,结果显示,F1~F3代病毒液CT 值依次为26.14、22.25、19.12,CT 值随代次增加而降低(图3),说明病毒在细胞传代培养中有增殖。

图3 PPV BJ2株增殖鉴定qPCR扩增曲线Fig.3 qPCR amplification curve of PPV BJ2 proliferation identification
2.3.3 电镜形态学观察 对PPV 病毒细胞培养物上清进行电镜负染观察,可见病毒粒子呈圆形、无囊膜,病毒粒子的直径约为20 nm(图4)。

图4 PPV BJ2株病毒粒子形态学观察Fig.4 Morphological observation of virions of PPV BJ2 strain
2.4 PPV BJ2株全基因组PCR扩增结果
采用PCR 方法扩增PPV BJ2 株全基因组片段1—5,其 大 小 分 别 为1 316、1 279、687、1 045、1 209 bp。PCR 结果显示,所扩增出的片段1—5 与预期目的条带大小相符(图5)。
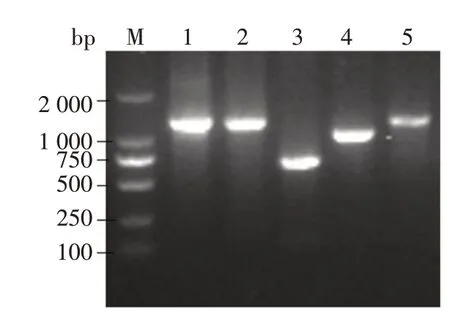
图5 PPV BJ2株全基因组PCR扩增结果Fig.5 PCR results of PPV BJ2 strain whole genome
2.5 PPV BJ2株全基因组序列分析
基于测序结果,利用MegAlign 软件,将PPV BJ2和HeN1202 株的全基因组序列与GenBank 收录的国内外18 株具有代表性毒株的全基因组序列进行分析。结果显示(图6),BJ2 株和HeN1202 株(实验室2019 年分离株)与常见毒株核苷酸一致性为95.5%~99.3%,其中BJ2 株与皮炎型强毒株Kresse株、英国Challenge株核苷酸一致性最高(99.3%),与27a 簇JY 株核苷酸一致性为99.0%,与弱毒株NADL-2 株核苷酸一致性为96.4%;HeN1202 株与国内HNZK-1 株核苷酸一致性最高(99.3%),与BJ2株核苷酸一致性为95.9%,与27a 簇JY 株核苷酸一致性最低(95.5%)。
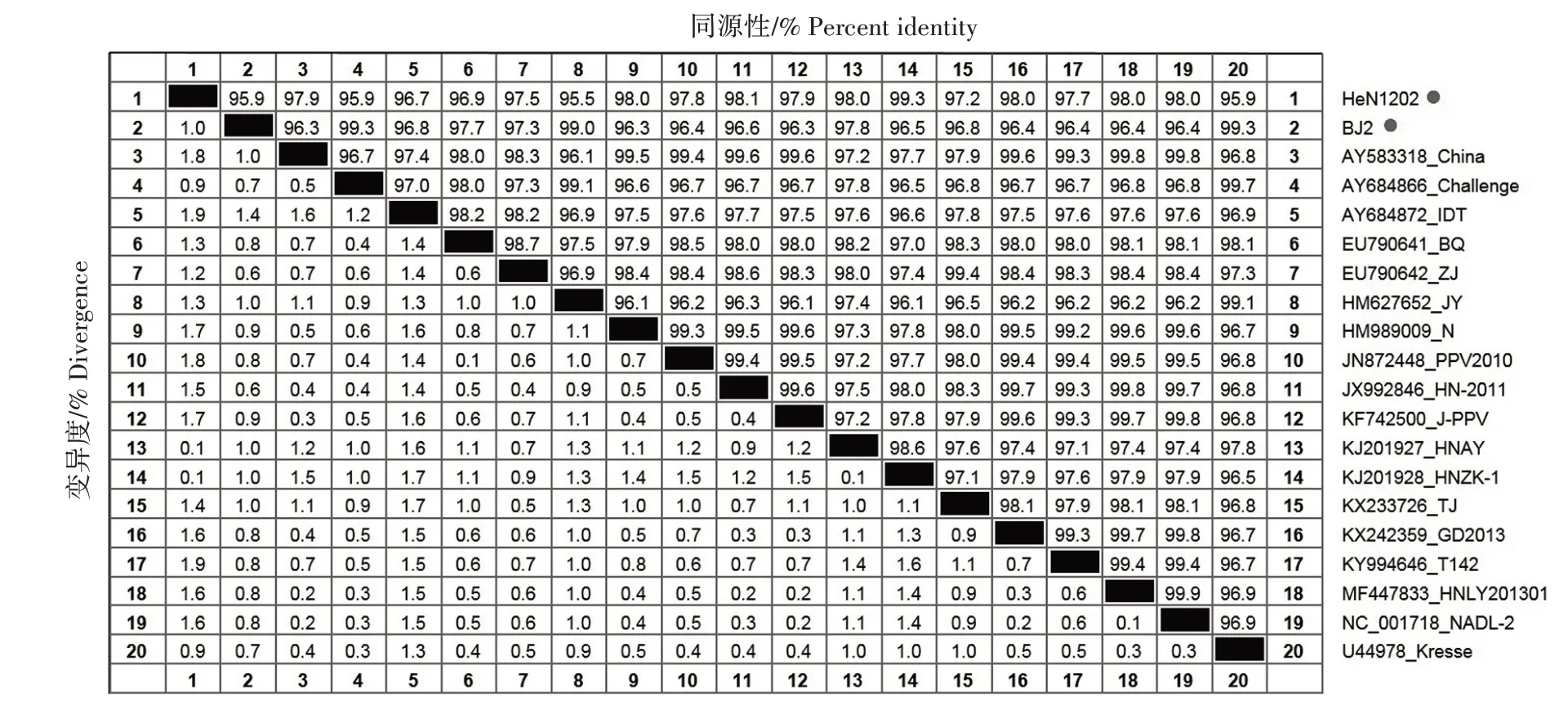
图6 PPV全基因组核苷酸一致性分析Fig.6 The full genome nucleotide identity analysis of PPV
2.6 PPV BJ2株VP2基因序列和推导氨基酸序列分析
将BJ2 株和HeN1202 株与弱毒株NADL-2 株、强毒株Kresse 株、Challenge 株及27a 株进行VP2基因核苷酸一致性和遗传进化树分析。结果显示,BJ2 株与强毒株Kresse 株、Challenge 株、27a 株亲缘关系较近(图7A),其核苷酸一致性依次为99.4%、99.4%、99.3%(图7B)。HeN1202 株与弱毒代表株NADL-2 株亲缘关系较近,其核苷酸一致性为99.0%(图7B)。

图7 PPV VP2基因序列分析Fig.7 Sequence analysis of PPV VP2 gene
将分离株VP2基因与GenBank上登录的PPV序列进行氨基酸序列比对,结果显示,分离株BJ2株与PPV 毒株VP2 氨基酸序列一致性为97.1%~99.7%(图7C)。BJ2 株与Kresse 株相比,共有3 个氨基酸位点存在突变(Q228E、A414T、E419Q);与27a 株相比,共有2 个氨基酸位点存在突变(S414T、T436P);与NADL-2 株相比,共有9 个氨基酸位点存在突变(T45S、I215T、Q228E、D378G、H383Q、A414T、E419Q、S436P、R565K)。HeN1202 株与PPV 毒株VP2 氨基酸序列一致性为97.1%~99.8%(图7C),与NADL-2 株相比,共有13 个氨基酸位点存在突变(E16A、T45S、I164L、H303Y、I320T、D378G、K407N、L391V、S436A、Q544R、I564M、R565K、Y570H)。BJ2 株和HeN1202株与已有代表毒株的VP2蛋白主要氨基酸位点突变情况见表5。

表5 PPV VP2蛋白主要氨基酸变异情况Tab.5 Amino acid variation of PPV VP2 protein
3 结论与讨论
猪细小病毒病由PPV 感染引起,以妊娠母猪流产、死胎和木乃伊胎为典型特征,仅通过临床症状很难与其他繁殖障碍性疾病进行区分。PPV 在世界范围内广泛传播和流行,严重影响养殖业的发展。PPV 可在猪肾或睾丸细胞中复制,包括PK-15细胞、SK6 细胞、ST 细胞等[8,27-29],在细胞周期的S 期晚期和G2 期早期可快速复制[30]。PPV 在细胞中的增殖可导致胞内颗粒样物质增多、变圆、堆积、拉网直至细胞死亡。本研究应用ST 细胞对病毒进行分离,成功从阳性病料中分离到1 株BJ2 株,出现典型的细胞病变;IFA 结果显示,接毒细胞的细胞质可见特异性绿色荧光。
PPV 基因组编码结构蛋白和非结构蛋白,结构蛋白又称为衣壳蛋白,分别为VP1和VP2,其分子质量分别为83 ku 和64 ku,VP2 水解后可产生VP3 蛋白,其分子质量为60 ku。上述3种蛋白质均具有诱导机体产生中和抗体的能力,且诱导能力的强弱为VP2>VP1>VP3,且VP2的基因序列可以作为遗传进化树的分类依据[21]。全基因组核苷酸序列分析表明,BJ2 株与皮炎型强毒株Kresse 株核苷酸一致性最高,HeN1201 株与HNZK-1 株核苷酸一致性最高。基于VP2基因序列构建系统发育树,发现BJ2株与德国27a 株处同一进化分支,说明我国的PPV分离株在进化分支上与德国27a 株相聚较近,证实国内PPVVP2基因抗原漂移,可能导致现有疫苗免疫效果不佳,这与HAO 等[12]的报道一致,中国PPV出现新的进化分支。ZEEUW 等[31]研究发现,在人工感染27a 株后再次感染异源毒株,不能对机体提供有效的免疫保护。目前,还未见针对27a 簇毒株疫苗的相关报道。
BERGERON 等[8]在对NADL-2 株和Kresse 株进行同素异形体的研究时发现,衣壳蛋白中的单个氨基酸的突变可能会影响病毒在细胞中的复制,NADL-2 株和Kresse 株基因组非编码区几乎相同,编码非结构蛋白的氨基酸均一致,仅在编码结构蛋白(VP1/VP2)的氨基酸中存在6 个氨基酸突变,且D378G、H383Q 和S436P 这3 个氨基酸位点的突变常被认为是造成组织嗜性差异的原因。CHAPMAN等[32]对PPV 结构蛋白进行3D 解析,发现436 aa位于衣壳亚基的3 倍刺突中心,这个位置被认为是各种细小病毒最重要的抗原表位区域[33]。但是关于PPV抗原漂移对中和活性的影响还有待进一步研究。本研究将BJ2 株、HeN1202 株与PPV 代表毒株进行VP2 氨基酸序列分析发现,与NADL-2 株、Kresse 株相比,BJ2 株228 位点由Q 突变为E、419 位点由E 突变为Q,这是27a 簇毒株独有的突变位点。此外,BJ2 株VP2 氨基酸436 位点和Kresse 株一致,BJ2 株可能与Kresse 株具有相同的组织嗜性,需进一步研究。HeN1202株与NADL-2株相比,仅378位点由D突变为G、436 位点由S 突变为A,各类氨基酸位点在病毒致病性中的作用尚不清楚。
本研究对2020—2021年江苏、河南和北京等省市的PPV 流行病学情况进行调查,结果显示,PPV平均检出率为19.4%,河南、北京、江苏的检出率分别为37.5%、3.5%、8.3%,与2020 年相比,2021 年PPV 核酸检出率明显升高。国内其他地区PPV 流行病学调查结果显示,阳性率为16.7%~40.0%[34-35]。说明PPV 仍然是影响养猪业的一大难题,PPV 毒株发生变异可能导致现有疫苗不能针对新发毒株对机体提供免疫保护。
本研究成功分离1 株PPV,测序分析表明,BJ2株全基因组与高致病性强毒株Kresse 株同源性最高;BJ2株VP2基因序列与强毒株Kresse株、Challenge株、27a 株同源性较高;对分离株VP2 氨基酸序列进行推导发现,与27a 株仅存在2 个氨基酸位点的差异,且具有Q228E 氨基酸位点的变化是类27a 簇独有分子特征。流行病学调查结果显示,河南省PPV检出率最高。

