高通量测序技术分析鲜食花生贮藏过程中真菌群落的的组成和变化
杨 慧,路风银,韩俊豪,谢永康,尚朝杰,李星仪
(河南省农业科学院 农副产品加工研究中心,河南 郑州 450002)
花生又名落花生,是我国重要的经济作物、食用作物和油料作物,是人们获得蛋白质的重要来源[1]。鲜食花生目前尚未有明确的定义,在花生产区一般指在收获后不经晾晒直接食用或煮熟食用的花生[2]。鲜食花生的食用方式可以最大限度地保留其营养成分,符合人们对健康、营养的追求,是一种营养、健康的绿色食品[3-4],深受消费者喜爱。同时,鲜食花生生育期短,可提高土地复种指数、增加农民收益[5-6]。因此,鲜食花生需求量和种植面积逐年增加,成为花生产业中重要的分支之一。
鲜食花生极不耐贮藏,销售周期短,难以满足周年市场需求,寻找切实可行的保鲜技术是实现鲜食花生周年供应的关键[2]。然而在贮藏保鲜过程中,鲜食花生因水分含量高、营养丰富,极易遭受各种真菌微生物的侵染,进而引起发霉、变质,严重影响其食用安全[7-8]。目前,关于鲜食花生的保鲜研究多集中在低温保鲜[9-10]、气调保鲜[11]、化学保鲜[12-13]等技术应用方面,而鲜食花生在贮藏过程中真菌微生物群落的变化规律鲜有研究。付英[14]研究表明,危害花生贮藏的菌类主要是曲霉属(Aspergillus)、青霉属(Penicillium)和镰孢菌属(Fusarium);JOFFE[15]研究发现,鲜花生荚果中可能存在109种真菌,主要种类为曲霉属、青霉属和镰孢菌属;王连平等[7]研究发现,不同地区新收获的新昌小京生新鲜花生果的优势菌为酵母菌、青霉菌、毛霉菌、曲霉菌、镰孢霉菌和交链孢霉菌,且带菌量随贮藏时间的延长显著增加。这些研究对鲜食花生真菌进行了分析鉴定,但鉴定方法传统、局限性大。
传统的微生物群落多样性研究主要通过生理生化试验及表型进行鉴定,存在耗时长、鉴定结果不精准等问题[16]。近几年,高通量测序技术作为新一代测序技术,相比于传统方法,具有操作简单、测定速度快、结果精准、用样量少、安全性和自动化程度高、分析全面等优点,已广泛应用于粮油[17-18]、肉制品[19-22]、水产品[23-24]等储藏过程中微生物多样性分析。基于此,采用高通量测序方法分析冷藏、常温2种贮藏环境下鲜食花生真菌微生物菌群变化,并分析微生物菌群的菌相构成及贮藏过程中菌群数量变化特点,旨在为鲜食花生贮藏过程中靶向抑菌保鲜及延长货架期提供参考。
1 材料和方法
1.1 材料与试剂
生鲜花生购于郑州市金水区赵东方蔬菜摊,品种为海花1号。
E.Z.N.A™Mag-Bind Soil DNA Kit试剂盒购自美国OMEGA 公司;Qubit 3.0 DNA 检测试剂盒购自美国Life Technologies 公 司;2×Hieff®C116P1Blood Direct Multiplex PCR Master Mix、Hieff NGS ™DNA Selection Beads 购自翌圣生物科技(上海)股份有限公司。
1.2 仪器与设备
Pico-21 台式离心机由美国Thermo Fisher 公司生产;GL-88B 涡旋混合器由海门市其林贝尔仪器制造有限公司生产;TND03-H-H 混匀型干式恒温器由深圳拓能达科技有限公司生产;DYCZ-21电泳槽由北京市六一仪器厂生产;FR-1000 凝胶成像系统由上海复日科技有限公司生产;Q32866 Qubit 3.0荧光计由美国Thermo Fisher 公司生产;ETC 811 PCR 仪由北京东胜创新生物科技有限公司生产;移液器由德国Eppendorf 公司生产。
1.3 方法
1.3.1 样品处理 生鲜花生经无菌水清洗、沥干水分后,用厚0.08 mm、120 mm×170 mm 的聚乙烯薄膜袋分装,每袋装约150 g,密封后分别置于(4±1)℃、(25±1)℃环境中进行贮藏,每隔4 d 测定一次指标,共测30 d。编号设置:冷藏组(4±1)℃标记为A,常温组(25±1)℃标记为B;0 d 标记为AB1,5~30 d 分别标记为2~7;样品编号方式为贮藏温度标记+贮藏时间标记,如A2表示冷藏5 d测定真菌序列的样品。
1.3.2 高通量测序 (1)基因组DNA 提取:花生用高温灭菌的剪刀剪碎后混匀,称取0.5 g样品放入无菌的2 mL样品管中,加入0.8 mL PBS溶液后涡旋振荡10 min,混匀后于10 000 r/min 室温离心3 min,弃置上层液体。然后按照E.Z.N.A™Mag-Bind Soil DNA Kit 试剂盒说明书提取样本的基因组DNA,之后用2%琼脂糖凝胶检测DNA完整性和Qubit 3.0试剂盒定量检测DNA 样本浓度。(2)PCR 扩增及建库:PCR 扩增及高通量测序主要委托生工生物工程(上海)股份有限公司完成。扩增引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)。第一轮PCR 反应体系(30 μL):2×Hieff®PCR Master Mix 15 μL、Primer F 1 μL、Index-PCR Primer R 1 μL、模板10~20 ng、ddH2O 9~12 μL;反应条件:94 ℃3 min→(94 ℃30 s→45℃20 s→65℃30 s)5 个 循 环→(94 ℃20 s→55 ℃20 s→72 ℃30 s)20 个 循 环→72 ℃5 min→10 ℃保存。第二轮PCR 反应体系(30 μL):2×Hieff®PCR Master Mix 15 μL、Primer F 1 μL、Index-PCR Primer R 1 μL、模 板10~20 ng、ddH2O 9~12 μL;反应条件:95 ℃3 min→(94 ℃20 s→45 ℃20 s→72 ℃30 s)5 个循环→72 ℃5 min→10 ℃保存。
1.4 生物信息学分析及数据处理
将测序得到的PE reads 根据overlap 关系进行拼接,区分样本后对序列进行质控和过滤,然后进行操作分类单元(Operational taxonomic unit,OTU)聚类分析和物种分类学分析。基于OTU 聚类进行物种多样性分析,基于分类学进行群落结构统计分析。用Microsoft Excel 2013 进行数据整理和分析,用Origin 2021软件进行作图。
2 结果与分析
2.1 鲜食花生贮藏过程中真菌群落Alpha多样性分析
为避免在高通量测序过程中由于引入错误或不可靠碱基等不可控因素造成的测序错误,减少对下游生物信息学分析造成的不良影响,需要对测序得到的原始数据进行优化处理。通过初步质控并去除接头(Barcode)和引物(Primer)的序列,获得1 048 909条真菌序列,去除嵌合体得到1 047 633条真菌有效序列,每个样品的有效序列百分比均达99%以上,说明本次测序所得的有效序列达到后续微生物多样性分析的要求。稀释性曲线可以反映不同测序深度下各样品中物种的相对丰度,能在一定程度上衡量每个样本的多样性情况[25]。在贮藏过程中,鲜食花生发现真菌物种数的稀释曲线如图1所示,所有样本稀释曲线均随横坐标测序数量的增大趋于平坦,说明测序数据量足够,能够充分反映样品的微生物信息且满足后续生物信息学分析要求。

图1 鲜食花生贮藏过程中发现真菌物种数的稀释曲线Fig.1 Rarefaction curves of fungal species found in fresh peanut during storage
Alpha 多样性分析是根据97%相似度水平下的OTU 信息,通过Chao 1 指数、Ace 指数、Shannon 指数、Simpson 指数等对样品微生物物种丰富度和多样性进行评估[20]。其中Chao1 指数和Ace 指数用来反映样品的菌群丰度,Shannon 指数和Simpson 指数用来反映样品中微生物群落的多样性[26]。在贮藏过程中,鲜食花生真菌群落Alpha 多样性相关指标如表1所示,所有样品的测序覆盖率均大于99%,表明测序可以反映实际情况,能够满足样品中真菌多样性分析的需要。随着贮藏时间的延长,冷藏组Chao 1 指数、Ace 指数、Shannon 指数整体呈下降趋势,Simpson 指数整体呈上升趋势,表明冷藏组真菌群落多样性和丰富度随贮藏时间的延长呈下降趋势;常温组Chao 1指数、Ace指数、Shannon 指数整体呈先升高后下降趋势,表明常温组真菌群落多样性和丰富度随贮藏时间的延长呈先上升后下降趋势。冷 藏 组Chao 1 指 数、Ace 指 数、Simpson 指 数 和Shannon 指 数 均 值 分 别 为243.03、247.91、0.26 和1.94,常温组Chao 1 指数、Ace 指数、Simpson 指数和Shannon 指 数 均 值 分 别 为273.51、266.37、0.17 和2.57,除Simpson 指数外,常温组数值普遍高于冷藏组,表明常温组真菌群落多样性与丰富度高于冷藏组,这可能因为常温组温度更适宜微生物生长。
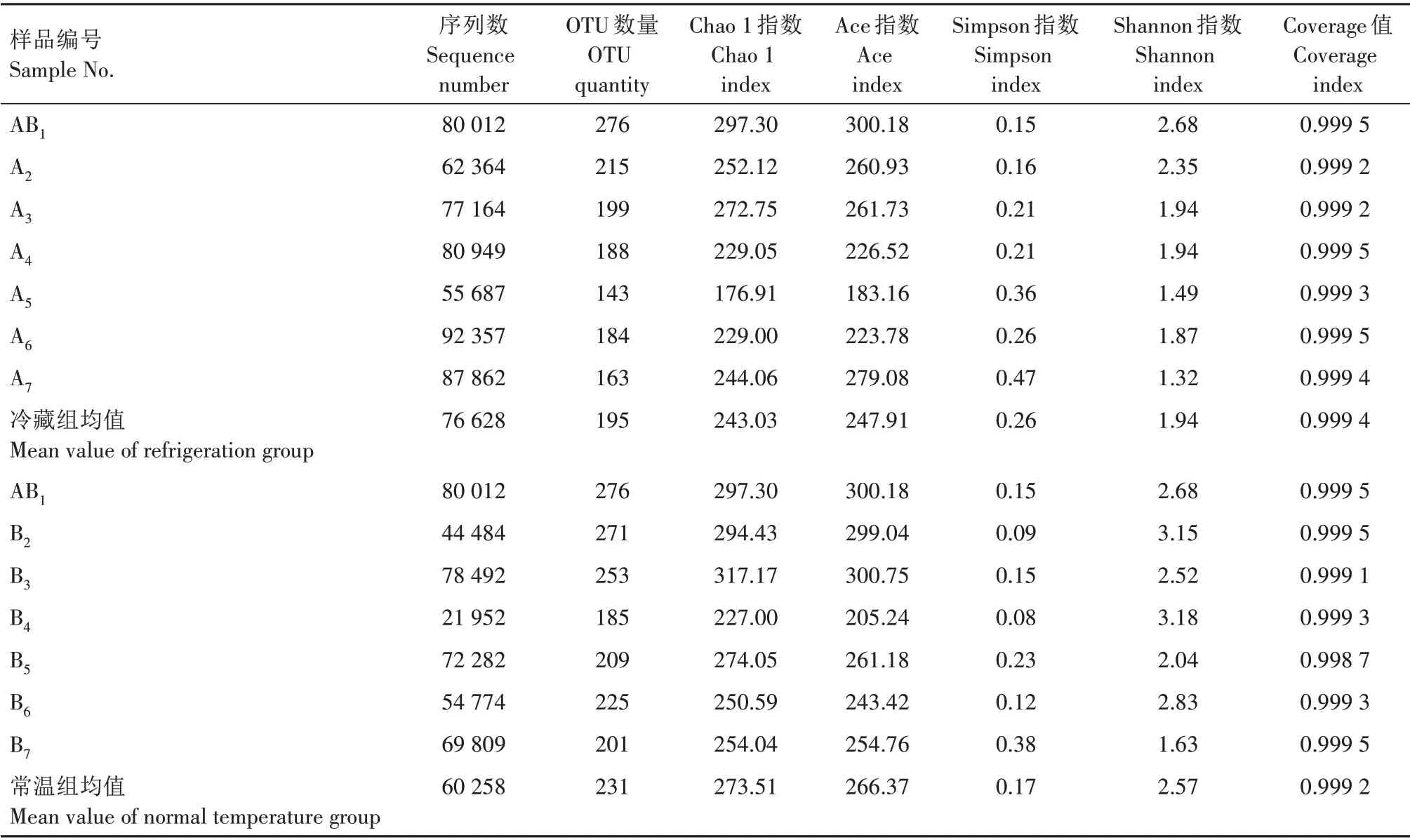
表1 鲜食花生贮藏过程中真菌微生物多样性指数Tab.1 Fungal microbial diversity index of fresh peanut during storage
2.2 鲜食花生贮藏过程中真菌群落Beta多样性分析
主 成 分 分 析(Principal component analysis,PCA)可以从原始数据中提取出样本之间最重要的差异[27]。由图2 可知,第1 主成分的贡献率为62.76%,第2 主成分的贡献率为34.84%,两者的叠加解释度达97.60%。冷藏组主要分散在第三和第四象限,常温组主要分散在第一、二和三象限,B7组与B1~B6组距离较大,而B1~B6组之间距离较小,表明B7组与B1~B6组真菌结构差异较大;冷藏A1~A7组之间均有一定分散,表明冷藏A1~A7组间真菌结构存在一定差异。

图2 鲜食花生贮藏过程中真菌群落门水平PCA分析Fig.2 PCA analysis of fungal community at phylum level during storage of fresh peanut
对距离矩阵进行层级聚类分析,构建树状结构,可以更直观观察不同处理组间真菌群落的相似性及差异性。由图3可知,B7组单独聚为一类,说明该组真菌群落组成与其他组真菌群落组成存在较大差异,B1~B6组、A2~A4组、A5~A6组之间在聚类关系上趋同性较强,表明其真菌群落组成的亲缘关系较近。
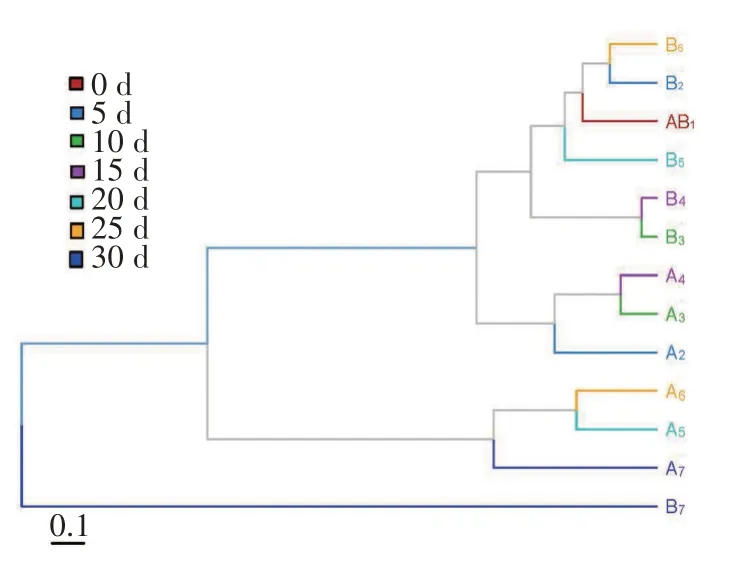
图3 鲜食花生贮藏过程中真菌群落门水平层次聚类分析Fig.3 Hierarchical cluster analysis of fungal community at phylum leved during storage of fresh peanut
2.3 鲜食花生贮藏过程中真菌群落结构变化分析
对贮藏过程中鲜食花生样品的真菌群落进行分析,共鉴定出8 个门、28 个纲、62 个目、115 个科、196 个属、302 种真菌,此外还有一些无法鉴定的真菌。选取相对丰度占比在1%以上的菌为优势菌、占比小于1%的菌归为Other进行分析。
门水平下鲜食花生优势菌群落变化如图4 所示,主要有子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)和其他未识别真菌(unclassified_Fungi)。随着贮藏时间的延长,子囊菌门相对丰度整体呈下降趋势,且在贮藏前期为绝对优势菌。常温组鲜食花生在贮藏30 d,被孢霉门成为绝对优势菌,相对丰度达58.69%;而冷藏组鲜食花生在贮藏后期,未识别真菌成为优势菌,且随贮藏时间延长整体呈升高趋势,表明冷藏组鲜食花生在贮藏后期真菌多样性增多。

图4 鲜食花生贮藏过程中门水平下优势菌群落变化Fig.4 Changes of dominant fungal community at phylum level during storage of fresh peanut
纲水平下鲜食花生优势菌群落变化如图5 所示,粪 壳 菌 纲(Sordariomycetes)、座 囊 菌 纲(Dothideomycetes)、未分类的子囊菌群体(unclassified_Ascomycota)为常温组鲜食花生在贮藏前25 d 的主要优势菌,而在贮藏末期(30 d)被孢霉纲(Mortierellomycetes)成为绝对优势菌,相对丰度高达58.69%。粪壳菌纲为冷藏组鲜食花生贮藏前15 d 的绝对优势菌,且随着贮藏时间的延长整体呈下降趋势,而未知真菌则在贮藏后期成为优势菌,相对丰度高达46.00%以上。

图5 鲜食花生贮藏过程中纲水平下优势菌群落变化Fig.5 Changes of dominant fungal community at class level during storage of fresh peanut
目水平下鲜食花生优势菌群落变化如图6 所示,冷藏组与常温组优势菌不同,常温组在贮藏前25 d,主要优势菌有肉座菌目(Hypocreales)、小丛壳目(Glomerellales)、格孢腔菌目(Pleosporales)、座囊菌目(Dothideales)、未知真菌及未分类的子囊菌群体,而在贮藏30 d 时,被孢霉目(Mortierellales)成为绝对优势菌,相对丰度高达58.69%。冷藏组主要优势菌为肉座菌目和未知真菌,随着贮藏时间的延长,肉座菌目相对丰度整体呈下降趋势,而未知真菌整体呈上升趋势,表明常温组鲜食花生真菌多样性增多。

图6 鲜食花生贮藏过程中目水平下优势菌群落变化Fig.6 Changes of dominant fungal community at order level during storage of fresh peanut
科水平下鲜食花生优势菌群落变化如图7 所示,新鲜花生科水平下优势菌为未分类的子囊菌群体、丛赤壳科(Nectriaceae)、小不整球壳科(Plectosphaerellaceae)及短梗霉科(Aureobasidiaceae),相对丰度分别达35.21%、15.55%、15.21%和7.16%。随着贮藏时间的延长,常温组鲜食花生子囊菌群体、丛赤壳科相对丰度整体呈下降趋势,小不整球壳科、格孢菌科(Pleosporaceae)相对丰度整体呈先上升后降低趋势,并于贮藏20 d 和25 d 达到最高值,分别为40.11%和24.19%,至贮藏末期,被孢霉科(Mortierellaceae)成为绝对优势菌,相对丰度高达58.69%。丛赤壳科与未知真菌是冷藏组鲜食花生主要的2种优势菌科,随着贮藏时间的延长,丛赤壳科相对丰度整体呈下降趋势,未知真菌相对丰度整体呈升高趋势。
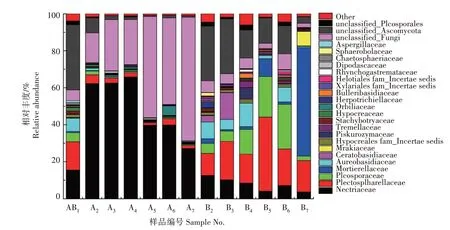
图7 鲜食花生贮藏过程中科水平下优势菌群落变化Fig.7 Changes of dominant fungal community at family level during storage of fresh peanut
属水平下鲜食花生优势菌群落变化如图8 所示,新鲜花生优势菌属分别为未分类的子囊菌属(unclassified_Ascomycota)、小 不 整 球 壳 属(Plectosphaerella)、赤霉属(Gibberella)及短柄霉属(Aureoba sidium),相对丰度分别为35.21%、14.81%、10.32%和7.16%。镰孢菌属(Fusarium)、未知真菌和赤霉属是冷藏组鲜食花生主要的优势菌属,随着贮藏时间的延长,镰孢菌属相对丰度整体呈先上升后下降趋势,并于贮藏15 d 时相对丰度达到峰值,为53.41%;未知真菌相对丰度整体呈上升趋势,至贮藏期结束相对丰度高达66.78%。对常温组鲜食花生来说,随着贮藏时间的延长,未分类的子囊菌属相对丰度整体呈下降趋势,且一直为贮藏前15 d的绝对优势菌属,小不整球壳属与链格孢属(Alternaria)相对丰度整体呈先上升后下降趋势,相对丰度分别在贮藏20 d和25 d达到峰值,为39.90%和23.92%,为优势菌属;被孢霉属相对丰度整体呈上升趋势,至贮藏结束相对丰度高达58.69%,为优势菌属。
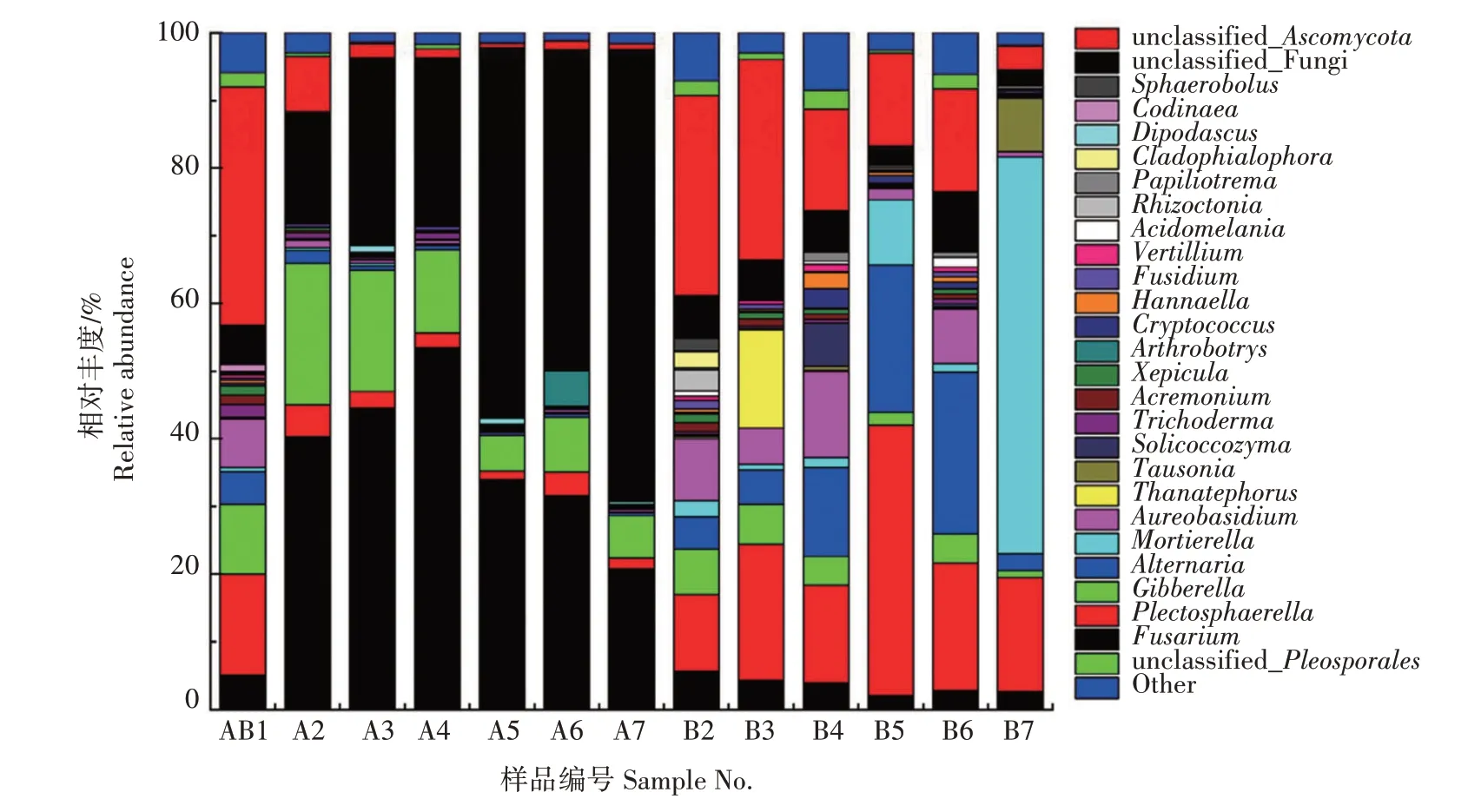
图8 鲜食花生贮藏过程中属水平下优势菌群落变化Fig.8 Changes of dominant fungal community at genus level during storage of fresh peanut
2.4 鲜食花生贮藏过程中真菌群落差异关键菌群LEfSe分析
冷藏组与常温组相比,鲜食花生真菌群落差异较大。LEfSe 分析(图9)表明,2 组样品在种水平上的66 种真菌具有显著性差异。冷藏组鲜食花生真菌群落差异关键菌群主要有13个,隶属于粪壳菌纲的赤霉属、镰孢菌属及未知真菌。常温组鲜食花生真菌群落差异关键菌群主要有53 种,隶属于7 个纲,分别为座囊菌纲的链格孢属、短柄霉属,锤舌菌纲(Leotiomycetes)的Acidomelania,粪壳菌纲的轮枝孢属(Verticillium)、Plectosphaerella属,未分类的子囊菌属,伞菌纲(Agaricomycetes)的亡革菌属(Thanatephorus)、丝核菌属(Rhizoctonia),银耳纲(Tremellomycetes)的隐球菌属(Cryptococcus)、汉纳酵母属(Hannaella)、Tausonia属、Solicoccozyma属,被孢霉纲的被孢霉属。

图9 鲜食花生贮藏过程中种水平下的菌群LEfSe 分析Fig.9 LEfSe analysis of fungal community at species level during storage of fresh peanut
3 结论与讨论
实现周年化供应是鲜食花生产业健康持续发展的关键。与花生干果储藏不同,花生鲜果因营养丰富,含水量高,更适宜真菌繁殖。花生采自地下,鲜食花生的安全贮藏与收获时花生果的带菌量关系密切,而带菌量与土壤中的真菌种类、温度、水分含量、湿度、病虫害的侵染等关系密切[27-32]。本研究采用Illumina MiSeq 高通量测序技术对鲜食花生贮藏过程中真菌群落组成和变化进行分析,发现新鲜花生的优势菌属分别为未分类的子囊菌属、小不整球壳属、赤霉属及短柄霉属,与JOFFE[15]、王连平等[7]检测的优势菌存在差异,推测这可能与花生所种植的地理位置、土壤及空气环境条件等相关。研究表明,冷藏组与常温组鲜食花生主要优势菌不同,镰孢菌属、未知真菌和赤霉属是冷藏组鲜食花生主要优势菌属。康彦平等[33]对采自我国东北、北方和南方花生主产区8 个省份的22 个果腐病样进行病原菌分离鉴定,发现病原菌主要为镰孢菌属、新赤壳属和丝核菌属;李术臣等[34]、张成玲等[35]也认为,引起花生果腐的病菌主要为镰孢菌。果腐病是花生生产上的一种灾害性病害[36],造成花生果腐病的原因有多种,尤以镰孢菌为主,此外,花生品种抗性也会直接影响微生物特别是黄曲霉的侵染[31,37]。
鲜食花生的安全贮藏除受产前因素影响外,更受后期温度、湿度等贮藏条件的影响。本研究中,常温组鲜食花生在贮藏前期优势菌主要为子囊菌属,贮藏后期优势菌为小不整球壳属、链格孢属、被孢霉属,真菌微生物群落多样性与丰富度均高于冷藏组,且随着贮藏时间的延长呈先上升后下降趋势。其中被孢霉属被认为与有益真菌相关,对植物的生长发育起促进作用[38-39],这可能由于前期微生物大量生长繁殖,导致代谢物和毒素积累,在抑制自身生长的同时促进了其他微生物的生长,这是微生态系统内各种因素相互作用、相互影响的综合结果。通过Alpha 多样性、Beta 多样性、差异关键菌群LEfSe 等分析,结果表明,冷藏组与常温组之间真菌结构存在差异,常温组真菌群落多样性与丰富度高于冷藏组,表明常温促使更多微生物生长繁殖。而低温则起到较好的抑制作用,因此,低温是鲜食花生后期贮藏的必备条件。

